多灶性胃癌病人淋巴结转移危险因素及预后分析
2020-09-15徐冉杨年钊赵海远李阳赵军张义胜
徐冉 杨年钊 赵海远 李阳 赵军 张义胜
胃癌是一种常见的消化道恶性肿瘤,在我国其发病率及死亡率均位于所有肿瘤中的第2位[1-2]。淋巴结转移是其主要的转移途径,也是胃癌病人预后不良的独立危险因素[3]。淋巴结转移情况可为后续临床治疗方案的选择提供参考。多灶性胃癌(multifocal gastric cancer,MGC)是一种特殊类型的胃癌,约占胃癌总发病率的6%~14%[4-6]。本研究探讨MGC病人淋巴结转移危险因素以及对病人预后的影响。
对象与方法
一、对象
我院2013年1月~2017年1月间收治胃癌手术病人2012例。经查阅手术记录及术后病理,筛选入组多灶性胃癌病人36例。入组标准:(1)胃内同时有2个或2个以上原发肿瘤,且均为腺癌;(2)符合同时性多原发胃癌诊断标准[7];(3)接受标准的胃癌D2根治术,RO切除;(4)术后病理资料及随访结果可靠。36病人中,男性26例,女性10例,平均年龄(63.08±10.66)岁,共有73个癌灶,其中2个癌灶35例,3个癌灶1例。病灶分布:贲门21个,胃体16个,胃窦18个,胃角18个。主辅灶位于同一区域(主辅灶分布于胃的上中下3个区域中任意1个区域)10例,不同区域(主辅灶分布于胃的上中下3个区域中任意2个区域)26例,主灶直径(3.68±1.72)cm, 辅灶直径(2.15±1.02)cm。主灶:T1期 8例,T2期9例, T3期8例 ,T4期11例。辅灶:T1期21例,T2期6例 ,T3期5例 ,T4期4例。主灶:高分化1个,中分化25个,低分化10个,印戒细胞0个。辅灶:高分化0个,中分化27个,低分化9个,印戒细胞0个。共19例有淋巴结转移,转移率为52.8%。淋巴结清扫数目为16~56枚,平均(27.47±11.78)枚。神经侵犯(+)21例,神经侵犯(-)15例,脉管侵犯(+)18例,脉管侵犯(-)18例。手术方式:近端胃癌根治术3例,远端胃癌根治术9例,全胃切除术24例。病理诊断:根据Moertel等[7]标准定义,侵犯最深的癌灶定义为主灶,其余为副灶,若多个癌灶侵犯深度一样,病灶直径大的为主灶。若辅灶多个,取侵犯最深的病灶纳入统计。肿瘤大小为最长直径,肿瘤分化为高分化、中分化、低分化、印戒细胞癌。肿瘤部位为上、中、下3个区域。根据日本2010胃癌规约[8],在肿瘤定位方面,通过平分胃小弯及胃大弯3点的连线,将胃分为上中下3个区域。
三、方法
1.手术方式:近端胃癌根治术、远端胃癌根治术、全胃切除术。
2.临床病理因素分析:根据淋巴结转移情况,将所有纳入病例分为淋巴结阳性组及淋巴结阴性组,分析淋巴结转移与年龄、性别、肿瘤大小、主辅灶位置、分化程度、T分期、脉管及神经侵犯之间的关系。
3.预后分析:根据病人住院信息及复诊记录,查询及电话随访所有纳入病人,最后随访时间为2019年6月30日,随访时间为10~54个月,中位随访时间为28个月。
三、统计学分析
结 果
1.多灶性胃癌病人淋巴结转移危险因素分析见表1。根据淋巴结转移情况分为阳性组(19例)及阴性组(17例)。单因素分析显示,多灶性胃癌淋巴结转移与主灶侵犯深度、神经侵犯及主辅灶分布不同区域有关(P<0.05)。

表1 多灶性胃癌病人病理特征与淋巴结转移的关系(例)

续上表
2.多因素分析提示见表2。结果显示,主灶侵犯深度为多灶性胃癌淋巴结转移的独立危险因素(P<0.05)。
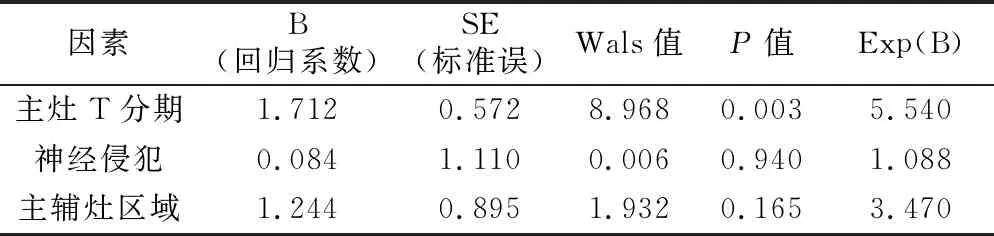
表2 多灶性胃癌淋巴结转移多因素分析
3.多灶性胃癌病人3年生存率:36例多灶性胃癌病人术后3年生存率(overall survival,OS)为69.4% ;淋巴结阳性组为 52.6%,淋巴结阴性组为88.2% ;阳性组生存率低于阴性组,差异有统计学意义(P<0.05)。多灶性胃癌在有淋巴结转移情况下,预后差。淋巴结阳性组及淋巴结阴性组生存曲线图见图1。
讨 论
MGC是胃内同时发生2个及以上的独立癌灶,多见于老年男性,常见分布近端胃,以早期胃癌常见[9]。目前关于MGC研究关注于多灶性早期胃癌与单发早期胃癌的病理特征,淋巴结转移情况及预后关系,目的是明确内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)的安全性及有效性[10-11]。本研究探讨MGC淋巴结转移因素及预后,为后续临床治疗方式的选择提供参考。
本研究中36例MGC病人约占我院同期2012例胃癌手术病人1.8%,与既往研究MGC占胃癌发病率6%~14%不一致[4-6]。可能原因:(1)纳入病例均为外科手术病例,遗漏内镜下局部治疗病例。(2)Kitamura等[12]研究表明,多灶性早期胃癌存在肿瘤碰撞现象,即两处或者多处多灶性早期胃癌可能通过垂直或水平生长融合成一个进展期肿瘤。
早期MGC(主灶T1期)约占22.2%(8/36),进展期MGC(主灶T2-T4期)约占77.8%(28/36),早期MGC相对少见,与相关研究不一致[11,13]。可能与纳入研究对象有关,本研究纳入对象为行外科手术切除病例,并不包含早期MGC行ESD手术病例。本研究中主辅灶位置分布约27.8%(10/36)主辅灶位于同一区域,与Otsuji等[14]结果并不一致,其研究对象多为早期MGC,50%以上主辅灶分布于同一区域。本研究中,样本量少,研究对象多数为进展期MGC,这些可能导致研究结果不一致。我们认为,主辅灶的位置分布可能决定手术方式的选择。若主辅灶位于同一区域,相距较近,病灶不大,在保证安全切缘的情况下,可采用部分胃切除,即使术前漏诊辅灶,手术仍有可能完整切除,若主辅灶不同区域,病灶大,一般采用全胃切除术,避免肿瘤残留。主辅灶的分布可能决定了手术切除范围,淋巴结转移情况决定清扫范围。影响胃癌病人淋巴结转移相关研究已经广泛开展,陈应驹等[15]研究认为,肿瘤大小、脉管侵犯、神经侵犯以及肿瘤的浸润深度是淋巴结转移的独立危险因素。黄晓东等[16]研究结果显示,肿瘤直径大、低分化、浸润程度深的胃癌易发生淋巴结转移。本研究单因素分析显示,MGC淋巴结转移与主灶侵犯深度、神经侵犯及主辅灶分布不同区域有关;多因素分析显示,主灶侵犯深度为MGC淋巴结转移的独立危险因素。本研究发现,随着主灶浸润深度增加,淋巴结转移概率增高,其中淋巴结阳性组(主灶T3-T4)所占比例约84.2%(16/19)。在预后分析中,淋巴结阳性组生存率低于阴性组,差异有统计学意义。 MGC在有淋巴结转移情况下,预后较差,与单发胃癌特点一致。有研究表明,单发胃癌与MGC,不论是早期还是进展期,两者间的总生存率无差异[11,14]。
目前,对MGC的治疗方式还有较大争议。有研究认为,早期MGC与早期单灶胃癌相比,淋巴结转移风险比没有升高,ESD仍然是一个可靠的治疗手段[11]。对进展期MGC手术方式是全胃切除还是部分胃切除依然没有定论。Moertel等[7]研究支持全胃切除,预防残胃复发风险。本研究中全胃切除占比66.7%,其余病例采用部分胃切除,其特点为主辅灶分布于同一区域,并且病灶较小。近期研究报道,对于远端MGC,胃部分切除并不增加局部复发率,且总生存率两者也无差异[17]。我们以为对于进展期MGC,需考虑主灶侵犯深度及主辅灶分布,若主辅灶非一个区域,一般采用全胃切除。若主辅灶处于同一区域,病灶T分期较早,也可采用部分胃切除。
MGC是一种少见类型胃癌,淋巴结转移与主灶侵犯深度有关,而与辅灶部位、侵犯深度、分化程度无关,淋巴结转移病人预后不佳。
