内蒙古锡林郭勒冬季放牧蒙古牛肠道微生物多样性和功能预测分析
2020-09-14阿日查斯木吉德王纯洁何利娜崔银雪敖日格乐
阿日查 斯木吉德 王纯洁 张 剑 陈 浩 刘 波 何利娜 张 晨 崔银雪 敖日格乐*
(1.内蒙古农业大学 动物科学学院,呼和浩特 010018; 2.内蒙古农业大学 兽医学院,呼和浩特 010018)
蒙古牛是一个古老的驯化畜种,其祖先为亚洲野牛[1]。原产于蒙古高原地区,现广泛分布于内蒙古、新疆和甘肃等地区。在内蒙古地区,锡林郭勒盟的蒙古牛数量最多,锡林郭勒草原属北部温带大陆性气候,主要气候特点是风大、干旱和寒冷[2]。年平均气温3.1 ℃,寒冷期长达7个月,1月气温最低,极端最低气温可达-42.4 ℃,为华北最冷的地区之一。在极为寒冷的冬季,牧草虽处于枯草期,但自然放牧且无补饲条件下蒙古牛依然正常生存,并具有较高的生产性能和遗传稳定性[3]。经当地牧民长期适应性选择后,蒙古牛逐渐形成了抗寒、抗病、耐粗饲和适应性强等特点,这些优良特征使其成为蒙古高原的优势畜种之一。
哺乳动物的肠道是一个复杂的生态系统,由多种多样的微生物群组成[4]。肠道菌群是机体正常菌群的重要组成部分,它们对宿主的疾病或健康状态下的发生及发展有着密切的关系[5]。与宿主漫长的进化过程中,可直接参与宿主食物的消化、能量代谢和营养吸收等多种生理活动,相当于一个后天的重要器官[6-7]。目前,肠道微生物在草食性反刍动物中研究较为广泛,如绵羊[8]、牦牛[9]和肉牛[10]等。健康机体的肠道菌群相对稳定,但由于饮食、环境(温度变化)及季节的不同,其菌群多样性会发生动态变化[11-15]。淡瑞芳等[16]在研究不同季节绵羊瘤胃菌群结构的季节性动态变化时发现,其冬季瘤胃细菌丰度显著低于秋季。刘春朋等[17]研究表明,急慢性冷应激会改变鹌鹑十二指肠内肠道菌群的数量和种类。冷应激3、6和12 h时鹌鹑十二指肠内逐渐出现新的菌群且产生了波动性的变化。在急慢性冷应激时,雏鸡肠道大肠杆菌呈逐渐增多,而乳酸杆菌含量下降[18]。Li等[19]比较春季和夏季奶牛的粪便微生物多样性时发现,夏季热应激时,微生物丰度Chao1和ACE指数呈下降趋势,夏季的Shannon和Simpson多样性指数明显低于春季,春季奶牛粪便中微生物的种类数量高于夏季,该研究揭示动物肠道微生物多样性受季节因素的影响。然而,在自然放牧而无补饲条件下,季节因素对蒙古牛肠道微生物多样性的影响迄今尚未报道。本研究以冬季自然放牧而无补饲条件的蒙古牛肠道微生物为研究对象,利用16S rRNA Illumina Hiseq测序,监测食物短缺的冬季放牧蒙古牛肠道菌群多样性及结构的变化,以期为深入研究放牧蒙古牛肠道微生物的组成与营养物质的消化吸收和肠道健康之间的关系提供理论基础。
1 材料与方法
1.1 采样地点及时间
分别于2018年11月28日、12月27日和2019年1月30日在内蒙古锡林郭勒盟苏尼特左旗满都拉图镇某牧户家的牧场进行样品采集。
1.2 试验动物及粪便样品采集
内蒙古锡林郭勒盟苏尼特左旗满都拉图镇某牧户家提供的20头3~4龄健康无病的放牧蒙古母牛为试验动物。其常年自然放牧,自由采食牧草和饮水,无补饲情况。采集蒙古牛新鲜直肠粪样于无菌管中,放置液氮罐送回实验室于-80 ℃,待检。
1.3 牧草样品采集
跟随放牧牛群,采集(1.0 m×1.0 m)样方牧草(芨芨草、锦鸡儿、沙葱和针茅)。除去杂质将其自然风干,带回实验室粉碎,进行牧草营养成分的测定。其测定方法参照张丽英[20]的《饲料分析及饲料质量检测技术》。
1.4 采样地点气候特征

表1 试验地点气候特征Table 1 Climatic characteristics of study site
1.5 粪便样品高通量测序分析
利用十六烷基三甲基溴化铵(CTAB)法对粪便样品基因组DNA进行提取[21],之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量于离心管中,使用无菌水稀释至1 ng/μL。以稀释后的基因组DNA为模板,扩增其 16S rRNA V3~V4高变区,特异性引物为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。PCR扩增及Illumina Hiseq测序均由北京诺禾致源科技股份有限公司协助完成。
1.6 生物信息
操作单元OTU聚类分析数据经过滤和质控后,对所有样品的全部有效序列进行聚类,默认以97%的一致性将序列聚类成为1个操作分类单元(OTUs)。对OTUs序列进行物种注释,用Mothur方法进行物种注释分析,在门和科分类水平上,统计样品的物种丰度和多样性。
LEfSe是一种基于线性判别分析(Linear discriminant analysis,LDA)效应量(Effective size)[22]的分析方法,其本质是筛选关键的生物标记物。LEfSe能自动对各分类水平的组成进行统计分析,并将其可视化,默认设置线性判别分析值(LDA Score)的筛选值为4。
利用QIIme(Version 1.9.1)软件计算α多样性,包括Chao1指数、ACE 指数、Shannon指数和Simpson指数。其中Chao1指数和ACE 指数计算菌群丰度,Shannon指数和Simpson指数计算菌群多样性。
利用β多样性分析评价样品在物种复杂性方面的差异,对OTU数据进行主坐标分析(Principle coordination analysis,PCoA),使用层次聚类方法非加权组平均法(Unweighted pair-group method with arithmetic means,UPGMA)构建系统发育树,对距离矩阵进行解释,结合细菌群落柱状图,研究不同组间或样品间的菌群相似性和分类学差异性。
PICRUSt(Phylogenetic investigation of communities by reconstruction of unobserved states)是基于以测细菌16S rRNA的测序数据,对粪便微生物的基因进行功能预测[23]。
1.7 统计分析
试验数据先用Excel进行前期处理,后使用SPSS 20.0进行单因素方差分析,P<0.05为差异显著,P>0.05 为差异不显著,P<0.01为差异极显著。
2 结果与分析
2.1 不同时间点牧草营养成分的变化
由表2可知,11月份牧草中的粗蛋白和酸性洗涤纤维显著高于其他时间点(P<0.05);中性洗涤纤维显著低于其他时间点(P<0.05)。次年1月份牧草中的中性洗涤纤维最高,粗蛋白最低。牧草中中性洗涤纤维的含量随着试验时间的变化逐渐增加,粗蛋白、粗脂肪和酸性洗涤纤维的含量随着试验时间的变化逐渐减少,粗脂肪含量在各时间点差异不显著(P>0.05)。

表2 不同时间点混合牧草的营养水平Table 2 Nutrient levels of mixed pastures at different time points %
2.2 不同时间点蒙古牛肠道微生物α多样性指数
基于Illumina HiSeq 测序平台对细菌16S rRNA基因V3~V4高变区测序分析,60份样品平均每个样品测得90 075条有效序列,经过质控平均得到 83 870条序列,质控有效数据量达63 802条序列,质控有效率达70.81%。以97%的一致性将序列聚类成为OTUs,共得到3 975个OTUs,对OTUs序列与Silva132数据库进行物种注释。注释结果中,84.60%的OTU注释到门水平,65.08%的OTU注释到科水平,29.56%的OTU注释到属水平。
通过绘制稀疏曲线来评判测序数据量是否足以反映样品中的物种多样性(图1),随着测序深度的增加,在测序量达到30 000时,曲线趋向平坦,说明取样的数量合理,测序深度已经基本覆盖到样品中所有的物种,且能够很好地反映出所有样品的细菌群落结构和多样性。
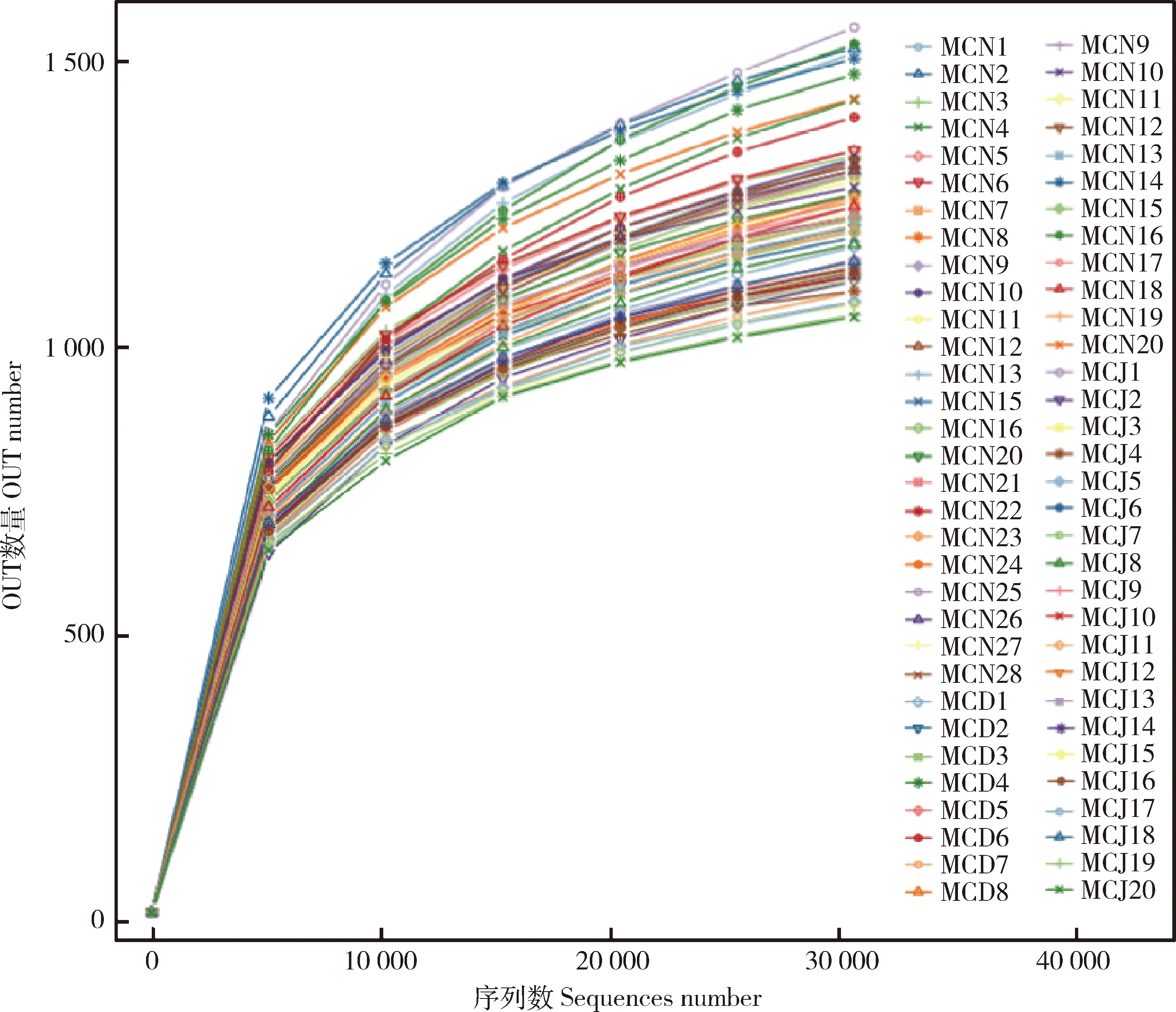
不同的样品用不同颜色的曲线表示Different samples were represented by different color curves图1 60份样品的稀释曲线Fig.1 Dilution curve of 60 samples
表3显示了不同时间点放牧蒙古牛肠道菌群α多样性指数,直接反映微生物群落的丰度及多样性。Shannon和Simpson指数表示菌群多样性;Chao1和ACE指数表示菌群丰度;覆盖率表示样本的测序深度。由表2可知,所有样本覆盖率在99.1%~99.3%之间,表明测序深度足以检测粪便样本中的微生物群落信息。Shannon、Simpson、Chao1和ACE指数在11月时蒙古牛样品中高于其他时间点,次年1月时数值最小,表明11月时蒙古牛样品中微生物群落的丰度及多样性相对较高,随着天气变冷蒙古牛粪便中微生物群落丰度及多样性随着减少。

表3 不同时间点放牧蒙古牛肠道菌群α多样性指数Table 3 Alpha diversity indexes of intestinal flora of grazing Mongolian cattle among different time points
2.3 不同时间点放牧蒙古牛肠道微生物β多样性分析
基于加权的UniFrac距离进行了PCoA分析,并构建了系统发育UPGMA聚类树,分析样品间微生物的相似性。由图2可知,主成分PC1和PC2的贡献率分别为总变量的41.89%和16.55%,11和12月时的放牧蒙古牛样本相互聚集在一起,而次年1月时的蒙古牛样本则离散的较远,单独聚为一簇,说明寒冷的次年1月时的样本微生物群落组成与其他时间点差异性较大。基于加权的UniFrac距离计算后构建的系统发育树UPGMA聚类树得出了与PCoA分析相似的结论(图3),次年1月的样本与11和12月能够明显的区分开,11和12月的样品聚为一类,说明这两个时间点菌群组成有一定相似性。而与次年1月时具有差异性,这可能是由于次年1月时天气最为寒冷,牧草营养价值低,从而导致与其他时间点的蒙古牛样本的细菌多样性产生差异。
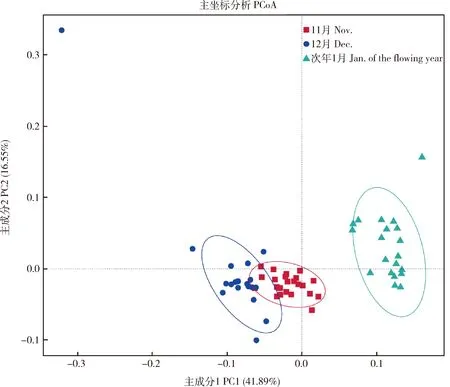
PC1值为41.89%,则表示x轴的差异可以解释全面分析结果的41.89%;PC2值为16.55%,则表示y轴的差异可以解释全面分析结果的16.55%;图中的每个点表示一个样品,同一组的样品用同一种颜色表示。The PC1 value is 41.89%,which means that the x-axis difference can explain 41.89% of the comprehensive analysis results;The PC2 value is 16.55%,which means that the difference on the y-axis can explain 16.55% of the comprehensive analysis results;Each point in the diagram represents a sample,and the samples of the same group are shown in the same color.图2 不同时间点放牧蒙古牛样本主坐标PCoA分析Fig.2 PCoA analysis of the grazing Mongolian cattle among different time points
2.4 不同时间点蒙古牛肠道菌群门分类水平下的结构
通过物种注释后,在门分类水平上,选择了丰度排名前10的物种。由表4可知,不同时间点蒙古牛肠道中占据主导地位的菌群主要包括厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),11、12月和次年1月厚壁菌门的丰度分别为61.83%、57.66%、54.84%;拟杆菌门的丰度分别为32.33%、32.55%和37.87%。其次分别为放线菌门(Actinobacteria)(0.38%、1.10%和0.70%)、变形菌门(Proteobacteria)(1.29%、3.51%和0.57%)、疣微菌门(Verrucomicrobia)(1.22%、2.70%和3.27%)、广古菌门(Euryarchaeota)(0.73%、0.15%和1.70%)、蓝藻菌门(Cyanobacteria)(0.13%、0.16%和0.01%)、纤维杆菌门(Fibrobacteres)(0.16%、0.30%和0.01%)和酸杆菌门(Acidobacteria)(0.02%、0.07%和0.00%)。不同时间点间放牧蒙古牛肠道微生物群落组成具有差异,随着天气逐渐变冷,厚壁菌门丰度减少,而拟杆菌门丰度增多。天气最冷的次年1月时放牧蒙古牛肠道中蓝藻菌门、纤维杆菌门及酸杆菌门几乎没有被发现。
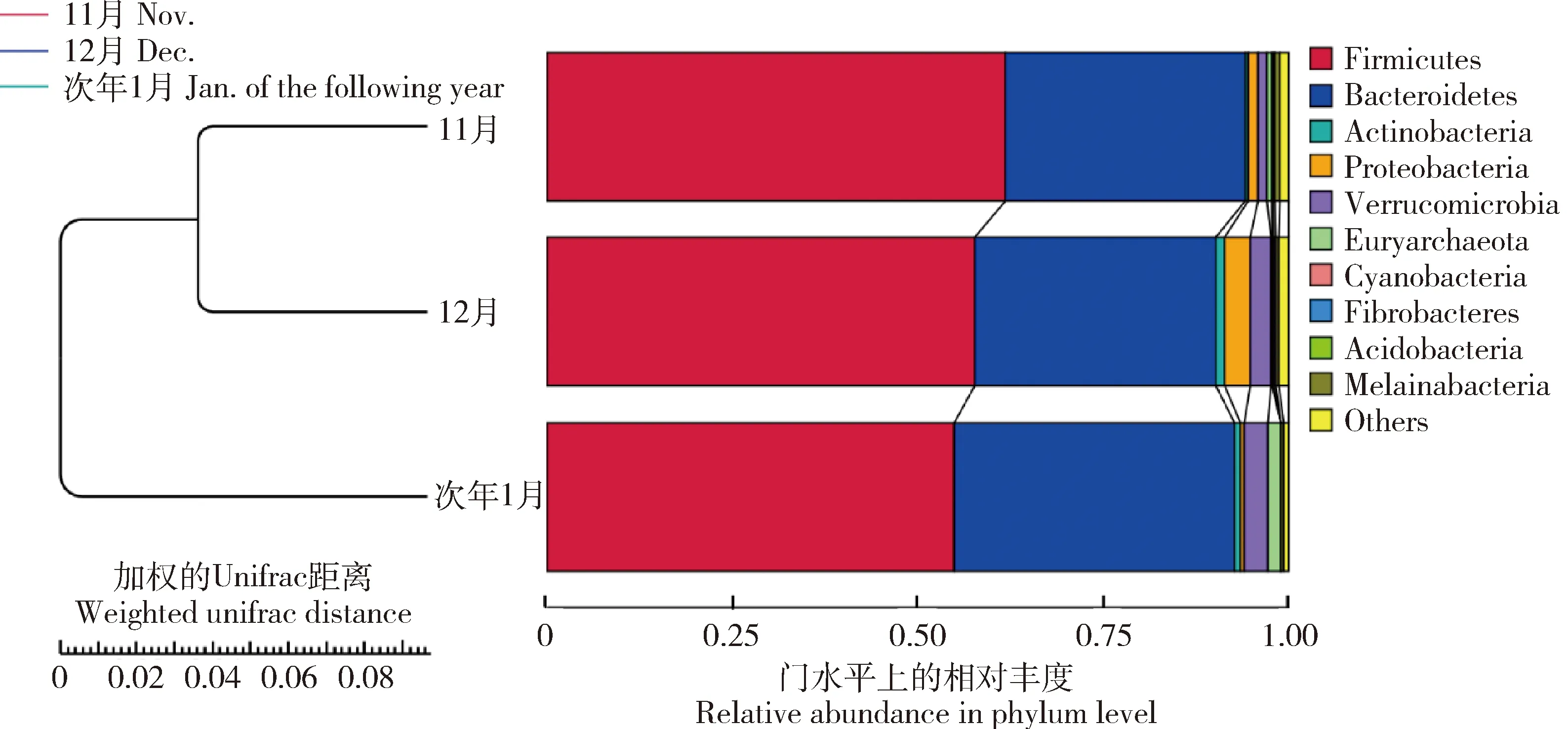
左侧是UPGMA聚类树结构,右侧的是各样本在门水平上的物种相对丰度分布图。UPGMA cluster tree structure is on the left,and the relative abundance distribution of each sample at the phylum level is on the right.Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Actinobacteria:放线菌门;Proteobacteria:变形菌门;Verrucomicrobia:疣微菌门;Euryarchaeota:广古菌门;Cyanobacteria:蓝藻菌门;Fibrobacteres:纤维杆菌门;Acidobacteria:酸杆菌门;Melainabacteria;Others:其他图3 不同时间点放牧蒙古牛肠道微生物结构的基于加权Unifrac距离的UPGMA聚类树Fig.3 Based on weighted Unifrac distance of UPGMA cluster tree of gut microbial structure of grazing Mongolian cattle among different time points

表4 门水平上蒙古牛粪便菌群丰度Table 4 Abundance of fecal microbiota for Mongolian cattle at phylum level %
2.5 不同时间点蒙古牛肠道菌群种分类水平下的结构
在属水平上,由于属的种类多且部分属的相对丰度较低,因而仅对排名前10的属进行了分析。由表5可知,不同组间放牧蒙古牛肠道菌群在属水平上的优势物种为拟杆菌属(Bacteroides)、艾克曼菌属(Akkermansia),其11、12月和次年1月拟杆菌属的丰度分别为5.84%、8.06%、6.32%;艾克曼菌属的丰度分别为1.22%、2.69%、3.26%。其次分别为未明确棒状杆菌科相关菌属(Unidentified_Corynebacteriaceae)(0.00%、0.61%和0.00%)、Romboutsia(2.27%、0.45%和4.29%)、甲烷短杆菌属(Methanobrevibacter)(0.52%、0.05%和1.54%)、别样杆菌属(Alistipes)(3.07%、3.69%和1.78%)、未明确梭菌目相关菌属(Unidentified_Clostridiales)(0.60%、0.88%和0.59%)、甲基杆菌属(Methylobacterium)(0.00%、0.17%和0.00%)、未明确蓝藻菌相关菌属(Unidentified_Cyanobacteria) (0.13%、0.16%和0.01%)、未明确瘤胃球菌科相关菌属(Unidentified_Ruminococcaceae)(1.72%、1.01%和0.98%)。寒冷的次年1月时蒙古牛肠道中艾克曼菌属、Romboutsia和甲烷短杆菌属的相对丰度高于其他时间点。
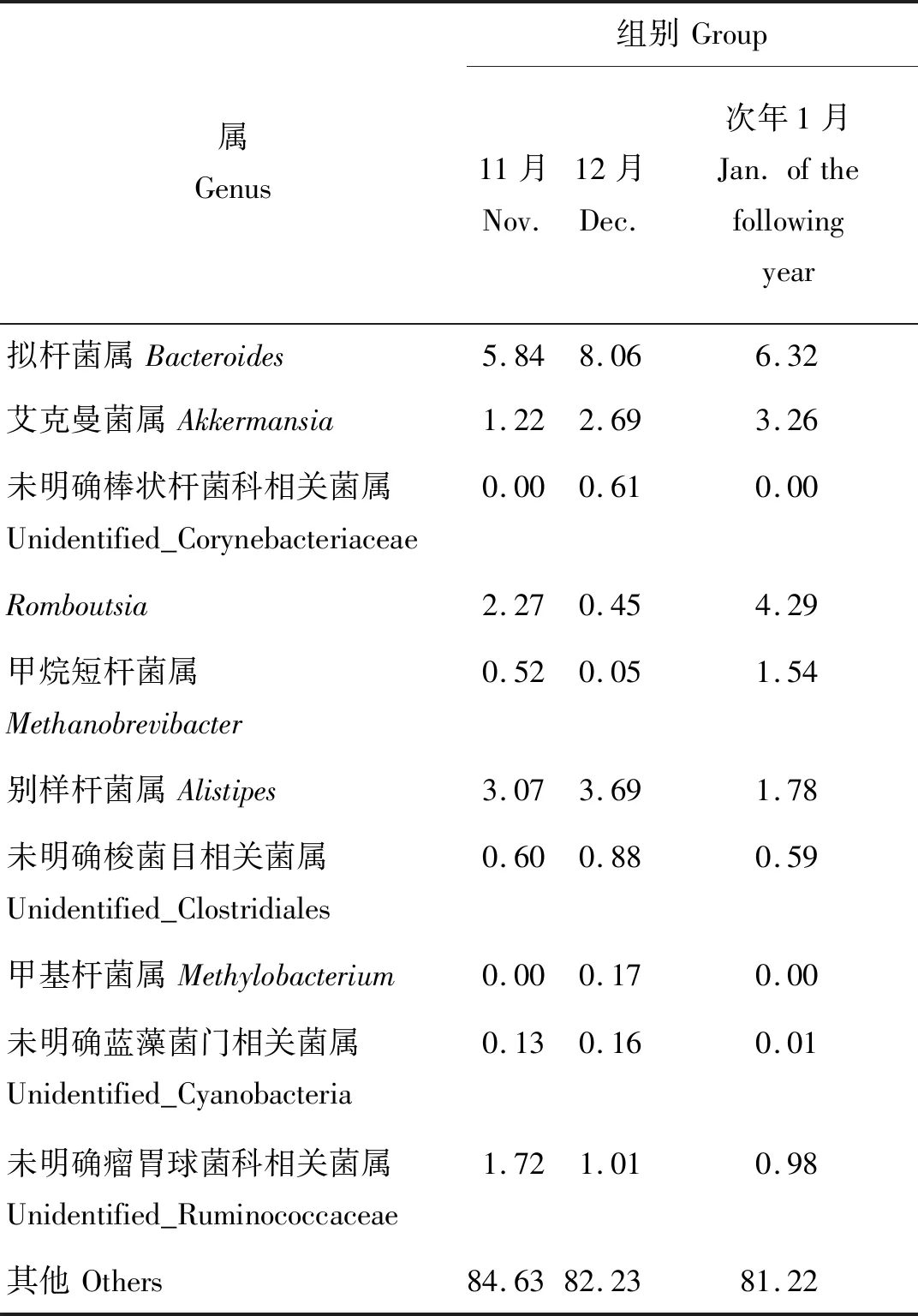
表5 属水平上蒙古牛粪便菌群丰度Table 5 Abundance of fecal microbiota for Mongolian cattle at genus level %
2.6 不同时间点蒙古牛肠道菌群物种LEfSe分析
组间物种差异分析能够判别出不同时间点的整体群落结构是否有显著性的不同。为了找出不同时间点具有显著差异的物种,可通过LEfSe分析寻找标记性质的物种(Biomarker)。LDA柱形图长度越长代表差异物种对组间差异性的影响越大。本研究利用LEfSe分析不同时间点的差异物种并通过线性判别分析评估差异物种的影响大小,最后绘制差异物种的线性判别分析值分布柱状图,可以清楚的展示出不同时间点各自的优势物种。线性判别分析值>4的标记性质的物种共有14个。次年1月时最多,有6个重要的微生物类群,包括理研菌科(Rikenellaceae)、消化链球菌科(Peptostreptococcaceae)、拟杆菌目(Bacteroidales)、拟杆菌门(Bacteroidetes)、拟杆菌纲(Bacteroidia)和Romboustia属,其中理研菌科的影响最大。而12月时最少,只有3个标记性质的物种,变形菌门、拟杆菌科(Bacteroidaceae)和拟杆菌属(Bacteroides)(图4)。
2.7 PICRUSt功能预测
PICRUSt可以根据16S rRNA 测序数据对样品中的微生物功能类别相对丰度进行基于KEGG数据库的功能预测。用PICRUSt对冬季放牧蒙古牛肠道微生物进行了功能预测。由图5可以看出,KEGG通路二级功能层面上丰度排名前35的预测功能基因及它们在每个组中的丰度信息。寒冷的1月时有18个功能基因通路的丰度增加,有15个功能基因丰度降低。丰度增加的通路包括糖的生物合成和代谢、运输和分解代谢、信号分子和相互作用、核苷酸代谢、次生代谢产物的生物合成、新陈代谢、碳水化合物代谢、辅因子和维生素的代谢、能量代谢和氨基酸代谢等相关通路。然而,丰度增加的这些功能基因通路在11和12月时丰度降低。丰度降低的功能基因通路有免疫系统、细胞运动性、环境适应性、转录、复制和修复、膜转运、细胞生长与凋亡、信号转导、内分泌系统、神经系统、癌症、遗传信息处理、细胞过程和信号和脂代谢通路。结果表明,随着天气逐渐变冷,免疫系统、环境适应性及细胞运动性相关通路丰度降低,氨基酸代谢通路丰度增加。
3 讨 论
随着国内外研究者对肠道微生物学研究的不断深入,诸多研究表明肠道微生物在营养预处理和能量获取方面发挥着至关重要的作用[24-25]。蒙古牛常年自然放牧,生理生态受外界影响甚少,其肠道微生物群落和组成保持原始状态。作为草食性反刍动物,其胃肠道需要对牧草中的纤维、淀粉和糖进行吸收利用,而反刍动物胃肠道本身并不能产生必需的纤维降解酶,这种酶必须由与宿主共生的肠道细菌产生,因此研究食物短缺的冬季放牧蒙古牛肠道微生物多样性具有重要意义。然而关于放牧蒙古牛肠道微生物受季节变化影响的研究尚未报道。
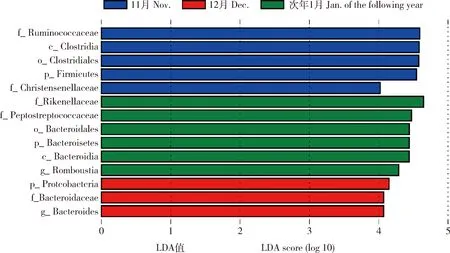
LDA值分布柱状图评判细菌分类在不同时间点的显著差异;纵坐标为不同时间点间具有显著差异的分类单元;横坐标为对应分类单元的LDA差异分析对数得分值;柱状的长度代表LDA得分。The histogram of LDA value distribution is used to evaluate the significant difference of bacterial classification at different time points.The ordinate is the taxon with significant difference among different time points.The abscissa is the logarithmic score value of LDA difference analysis of corresponding taxon.f_Ruminococcaceae:瘤胃球菌科;c_Clostridia:梭菌纲;o_Clostridiales:梭菌目;p_Firmicutes:厚壁菌门;f_Christensenellaceae:克里滕森氏菌科;f_Rikenellaceae:理研菌科;f_Peptostreptococcaceae:消化链球菌科;o_Bacteroidetes:拟杆菌目;p_Bacteroidetes:拟杆菌门;c_Bacteroidia:拟杆菌纲;g_Romboustia:Rombostia属;p_Proteobacteria:变形菌门;f_Bacteroidaceae:拟杆菌科;g_Bacteroides:拟杆菌属。图4 不同时间点放牧蒙古牛粪便微生物群落LEfSe多级物种差异LDA判别分析Fig.4 LDA discriminant analysis of LEFSe multi-level species diversity of fecal microbial community in grazing Mongolian cattle among different time points

越偏红表示相对丰度越高;越偏蓝色表示相对丰度越低。More red indicates higher relative abundance;while more blue indicates lower relative abundance.图5 PICRUSt基因预测聚类热图Fig.5 Heatmap of PICRUSt gene predicted function
周应敏等[26]利用高通量测序技术研究亚成体大熊猫肠道菌群多样性的季节性差异发现,冬季大熊猫肠道微生物结构比较复杂,微生物丰度也相对较高,冬季细菌的优势度明显高于其他季节。Oakley等[27]利用16S rRNA基因扩增子测序对肉鸡盲肠菌群进行了鉴定发现冬季肉鸡盲肠细菌属明显少于春季或夏季。Liu等[28]研究发现在相同的饲养条件和生活环境下,冬季组与夏季组相比,同一品系大鼠空肠和回肠厚壁菌门的相对丰度显著降低,而空肠、回肠和结肠的变形杆菌门的相对丰度显著增加。这些研究表明季节的变化影响宿主肠道微生物的组成和结构。在本研究中,11和12月时放牧蒙古牛肠道菌群多样性相似,而与次年1月时相比差异明显。
食物资源对动物的生存和繁殖至关重要,动物面临食物资源的可利用率和季节性变化以及寒冷冬季带来的食物短缺和能量消耗增加的压力[29]。处于季节性动态变化环境中的动物,其食物的质量也会随之而变化,动物需要调节自身适应这种食物资源变化带来的挑战。因此,了解放牧蒙古牛冬季如何解决这些生存挑战,更有利于加深对物种的适应性进化的理解。假设季节性的食物变化可以改变蒙古牛肠道微生物多样性。通过α多样性分析发现,11月到次年1月,蒙古牛肠道微生物丰富度及多样性均呈明显下降的趋势,且具有统计学意义(Shannon)。从PCoA和UPGMA分析来看,次年1月与其他月份的菌群种类明显分开,而11和12月的菌群种类相似。淡瑞芳等[16]研究放牧地冬春季、夏季和秋季各牧场的牧草营养成分发现混合草样营养成分随季节变化而变化。张盼盼[30]研究表明,牧草中营养成分随季节变化而变化,冬季牧草的营养价值最低,这与本研究结果相似。由于次年1月份时锡林郭勒盟属于最寒冷的气候,牧草营养成分及产量逐渐降低。这说明季节性食物的变化会影响宿主肠道微生物多样性。
在本研究中,观察到季节变化与肠道微生物的分类学组成有显著关系。在门分类学水平上,冬季放牧蒙古牛肠道中厚壁菌门和拟杆菌门占主导地位,这与诸多草食性反刍动物的研究结果一致,如绵羊[31]、骆驼[32]和奶牛[33-34]等。厚壁菌门和拟杆菌门在许多哺乳动物的肠道微生物群落中广泛分布,表明它们在消化道中的生态和功能意义[35-36]。胃肠道促进纤维分解的主要细菌是厚壁菌门,它能够将纤维降解为反刍动物可利用的短链脂肪酸共宿主使用,而拟杆菌门主要降解碳水化合物,促进胃肠道免疫系统的发育[37]。在本研究中,随着天气变冷,牧草质量降低,食物短缺,蒙古牛处于瘦弱状态,放牧蒙古牛肠道中厚壁菌门丰度减少,而拟杆菌门丰度增多。这与Ley等[38]研究的比较肥胖者和瘦者的肠道微生物组成相似,与瘦者个体相比较,肥胖者肠道中拟杆菌门的相对丰度有所减少,而厚壁菌门增多。现有的文献表明,肠道中变形菌门是鉴定哺乳动物肠道健康的关键标志,与肠道健康状态成反比,其数量越少越健康[39]。次年1月时蒙古牛肠道中变形菌门含量最低。说明即使寒冷的季节,蒙古牛肠道微生态系统处于健康状态。
在蒙古牛的肠道中发现了新抗癌明星细菌属—艾克曼菌属。有研究表明,该细菌通过竞争作用保护肠道免受病原体的侵害[40]。若肠道内该细菌的丰度越多,动物就不会有肥胖和炎症性疾病。除了抑制肥胖之外,还可以促进肠道屏障功能。即使在肠道中没有营养物质,它也可以蓬勃的繁衍生息,发挥着益生菌的作用[41]。在本研究中,随着天气逐渐变冷,蒙古牛肠道中艾克曼菌属丰度增加,说明蒙古牛肠道微生态系统越健康。最近的研究发现,Romboutsia是一种新发现的细菌属[42],通常在人体肠道中被鉴定,在维持宿主健康中扮演着重要的角色[43]。在本研究中,该菌属在1月时最多。表明在食物短缺的季节,蒙古牛肠道中具有保护肠道且与健康状况有关的细菌,有利于维持其肠道生态平衡。
肠道中微生物对免疫功能、营养物质的吸收、甚至酶的代谢作用等有一定的影响[44]。肠道微生物对机体的生理功能有一定的影响。PICRUSt软件预测微生物16S rRNA文库,对其功能基因和类群进行了探索,进而将菌群结构与宿主代谢相联系。研究表明,PICRUSt软件对肠道菌群功能基因预测的准确度为85%~90%[45]。通过与数据库比对搜索,肠道细菌编码的大多数基因与代谢相关。PICRUSt功能预测结果表明,寒冷的次年1月碳水化合物代谢、能量代谢和氨基酸代谢等18个功能基因通路的丰度增加;免疫系统、细胞运动性和脂代谢通路等15个功能基因丰度降低。说明放牧蒙古牛肠微生物与分子、糖的生成和代谢等基础生命功能有关。PICRUSt基因预测聚类热图显示,相同功能在各月份间热图颜色有变化,说明各月份样品虽然都具有相同的功能,但是由于每个月份的样品中所含微生物的种类和数量有区别,所以各月份的效能存在差异。
4 结 论
利用基于肠道微生物16S rRNA基因测序技术,探索了自然放牧条件下冬季放牧蒙古牛肠道微生物的组成和结构变化。本研究发现,随着天气变冷,蒙古牛肠道微生物多样性和丰度均下降,群落组成与结构也有相应的变化,可体现出微生物在不同时间点所表现出的消化与吸收功能的差异性。季节性食物的变化会影响宿主肠道微生物多样性。强调了肠道微生物在放牧蒙古牛营养生态学中的重要作用,为了解蒙古牛肠道微生物群的季节动态关系提供了重要的基础数据。
