不同抗氧化剂组合对蒙古马精液冷冻保存效果和抗氧化相关指标的影响
2020-09-14阿娜尔白东义纳日嘎
阿娜尔 白东义 纳日嘎 芒 来
(内蒙古农业大学 动物科学学院/内蒙古自治区马属动物遗传育种与繁殖重点实验室,呼和浩特 010018)
精液冷冻技术是使优秀种公马的遗传材料得以保存和使用的方法[1]。冷冻处理程序及种公马的个体差异等因素对精液造成冻融损伤,使精液受胎率低于新鲜精液和冷藏精液[2]。因此,在生产上用于人工授精时,多数采用新鲜精液和冷藏精液,冷冻精液尚不能满足生产需要。在我国,对马冷冻精液的研究还处于试验阶段。因此,进一步优化马精液冷冻保护液是一项必须攻克的课题。
马精液冷冻保存的程序与其他物种不同,其程序会从精液中清除大部分精浆,会降低抗氧化酶含量,破坏抗氧化酶系统的原有平衡,导致细胞膜和顶体的过氧化损伤[3]。因此,常通过添加相应的抗氧化剂保护精子质量[4]。谷胱甘肽和海藻糖是多个物种的精液冷冻保存中常用的抗氧化剂[5]。Joaquín等[6]发现,在猪精液解冻液中添加还原型谷胱甘肽可显著提高精子受胎率,且具有剂量依赖性。海藻糖是非酶类活性氧清除剂,通过渗透作用和与精子质膜中磷脂的特异性相互作用诱导其对氧化应激起保护作用,其对冷冻保存精子质量的有益作用已在公羊[7]、牛[8]、水牛[9]、小鼠[10]等物种中均得到报道。目前,马精液冷冻保存领域中有较多的有关单独添加不同剂量谷胱甘肽或海藻糖的相关研究,其适宜添加量因不同品种不同基础液而异[21,25]。研究发现,联合添加0.9 g/L维生素C和2.5 mmol/L谷胱甘肽显著提高了公驴冻融后精液质量[11];100 mmol/L 海藻糖结合2 mmol/L维生素E显著提高了公羊冻融后精液质量[12],但联合添加相关抗氧化剂的稳定性及其作用机理尚不明确。抗氧化酶活性的相关研究已在水牛[13]、羊[14]、猪[15]、马[3]及人[16]精液已有报道,而这些研究主要侧重于其产生机理、不同个体之间的差异及其与精液品质的关系,但对抗氧化剂是否通过影响酶活性而影响精子质量尚未有相关报道。因此,本研究分析了不同抗氧化剂组合对蒙古马精液冷冻保存效果和抗氧化相关指标的影响,旨在探讨抗氧化剂对蒙古马精液冷冻保存作用,并是否通过酶活性而影响精子质量,以期进一步优化马精子冷冻保护液,提高精子冷冻效果。
1 材料与方法
1.1 试验动物
种公马来自内蒙古自治区二连浩特市策格马场,品种为蒙古马。用于研究的精液样品是从每隔一天进行常规采集的精液中获得的等份试样,常规采集的精液用途为商业化的人工授精项目。采精季节均在马匹繁殖季节,于每年5—7月进行,试验连续进行了2年。采精期间,加强公马饲养管理。
随机选取体格健壮,繁殖性能良好,年龄4~15岁(平均9岁)的种公马10匹。每个试验阶段选取其中3~4匹。精液活力达鲜精质量要求才用于后续试验。在收集用于试验的精液之前,预采精2周以达到稳定的质量。
1.2 主要试剂
葡萄糖、乳糖、棉子糖、柠檬酸钠、柠檬酸钾、4-羟乙基哌嗪乙磺酸、海藻糖、还原型谷胱甘肽均购自Sigma公司。MDA、CAT、SOD、GSH-PX、GR试剂盒均购自南京建成生物工程研究所。
1.3 马冷冻精液的制作
1.3.1冷冻保护液的制备
INRA82基础液的配制:选取2.5 g葡萄糖、0.15 g乳糖、0.15 g棉子糖、0.025 g柠檬酸钠、0.041 g柠檬酸钾、0.476 g 4-羟乙基哌嗪乙磺酸(HEPES)、0.05 g青霉素、0.05 g庆大霉素,放入无菌容器中,加入双蒸水溶解,定容至100 mL,室温下用磁力搅拌器充分搅拌30 min。
卵黄液的获得:取新鲜鸡蛋,去除蛋清后,把卵黄膜刺透,卵黄液收集到用冰冷却的容器中。
脱脂奶的配制:按照脱脂奶粉说明书,取脱脂奶粉10.0 g放入无菌容器中,加入双蒸水溶解,定容至100 mL,室温下用磁力搅拌器充分搅拌10~20 min,获得10%脱脂奶。
INRA82稀释液构成:基础液50 mL+脱脂奶50 mL+2%卵黄液;将配制好的稀释液放置37 ℃水浴锅中,放置时间不得超过2 h。
INRA82冷冻保护液构成:基础液50 mL+脱脂奶50 mL+2.0%卵黄液+2.5%甘油。INRA82的pH为6.8~7.0,渗透压为300~330 mOsm/kg。冷冻保护液置于室温中,放置时间不得超过2 h。
1.3.2精液的采集
采精之前,应用温水清洗干净公马阴茎。用INRA假阴道(法国卡苏)采集精液。选取性情温顺的发情母马做台马。新鲜精液去除胶状物,再用Φ240 mm的滤网进行过滤后进行密度测定(ACUCELL密度仪),取10 μL原精在电子显微镜下镜检活力(200倍),色泽乳白色,精子活力≥60%,精子密度≥1.0×109个/mL的正常精液用于后续试验。
1.3.3精液的处理
3~4匹马精液中获得等份试样进行混合,用INRA82稀释液进行1∶1稀释,缓慢操作并轻轻摇均,随后在室温条件下离心(600 g)10 min,弃去上清液,再用INRA82冷冻保护液稀释至100×106个/mL,室温保存备用。稀释后精液密度用血细胞计数板来测定。
1.3.4精液的冷冻及解冻
用冷冻保护液稀释精液,使精子密度达到100×106个/mL,然后将其灌装至容积为0.5 mL的细管中,降温直到4 ℃,平衡100 min后在离液氮面3 cm的地方熏蒸15 min,投入液氮中保存。放入液氮中的样品至少保存1天。每组样品解冻3支细管,解冻温度和时间分别为37 ℃和30 s,在解冻后15 min内进行相关指标分析。
1.4 试验设计
冷冻保护液分为5个处理组,除了未添加组,其余组分别添加不同剂量的谷胱甘肽和海藻糖(表1)比较冷冻-解冻后TM、PM、AI、MI 4种精子质量指标,以明确谷胱甘肽和海藻糖最佳添加量;2)通过上述试验分别选取两组最佳添加量,交叉联合添加谷胱甘肽和海藻糖,同时测定MDA含量和SOD、CAT、GSH-PX、GR 4种抗氧化酶活性,以观察谷胱甘肽和海藻糖联合添加对蒙古马精液冷冻保存的效果及协同效应。
1.5 精子质量评价
试验期间,10匹公马随机选取3~4匹采集精液混匀,经过不同稀释液冷冻-解冻后检测精液常规品质及抗氧化相关指标。
1.5.1精子运动参数检测
精子运动参数用计算机辅助精液分析仪(CEROSS II,法国卡苏公司)检测。将冷冻-解冻后精液吹打混匀后取10 μL精液用90 μL PBS进行稀释,将2 μL添加到Leja 20 mm四腔载玻片(法国卡苏公司)腔中,在37 ℃条件下检测运动参数TM(运动精子比例)、PM(前进运动精子比例)。即在检测腔室中随机取5个不同视野,每个视野至少观测300个精子,并对上述参数进行分析,每支精液重复检验3次。
1.5.2精液质膜完整性检测
MI采用SYBR14/PI荧光染色试剂盒进行检测,详细步骤为:按1∶1比例用PBS稀释精液,室温离心(600 g)7 min。除去上清液,在其中注入HEPES缓冲液1 mL和SYBR14液5 μL,36 ℃孵育10 min,离心(600 g)7 min,弃上清,注入PBS液1 mL进行稀释,滴片,荧光显微镜(400倍)观察。每个试验组解冻3支细管,每支细管取3个观察视野,每个样本计数精子不少于200个,计算MI。
1.5.3精子顶体完整性检测
用FITC-PNA荧光染料对AI进行染色检测。当出现绿色荧光时说明精子顶体出现破损。将精液解冻之后使用PBS按照1∶1的比例进行稀释,离心(650 g,7 min,室温),在离心结束之后除去上清液,注入1 mL的PBS清洗1次。注入20 μL的FITC-PNA溶液,放到温度为36 ℃的温度下孵育10 min,将其滴片放到荧光显微镜下进行检测。每个组别解冻3支试管,每支试管选取3个观察视野,每个样本中精子的数量不能低于200个。计算AI。
1.5.4抗氧化相关指标的检测
对冷冻-解冻后精液,MDA含量、CAT、SOD、GSH-PX和GR活性严格按照试剂盒说明测定。
1.6 统计分析
数据分析使用SAS 9.0软件统计分析,各组间差异采用单因素方差分析,使用“平均值±标准差”(Mean±SD)表示,当P<0.05时差异显著,P>0.05差异不显著。
2 结果与分析
2.1 不同抗氧化剂对冷冻-解冻后马精子质量的影响
2.1.1不同剂量谷胱甘肽对蒙古马精液冷冻保存效果的影响
由表2可以看出,添加5.0 mg/mL的谷胱甘肽组PM显著高于其他组(P<0.05),TM和MI均高于其他组,但差异不显著(P>0.05);添加7.0 mg/mL的AI显著高于其他组(P<0.05)。
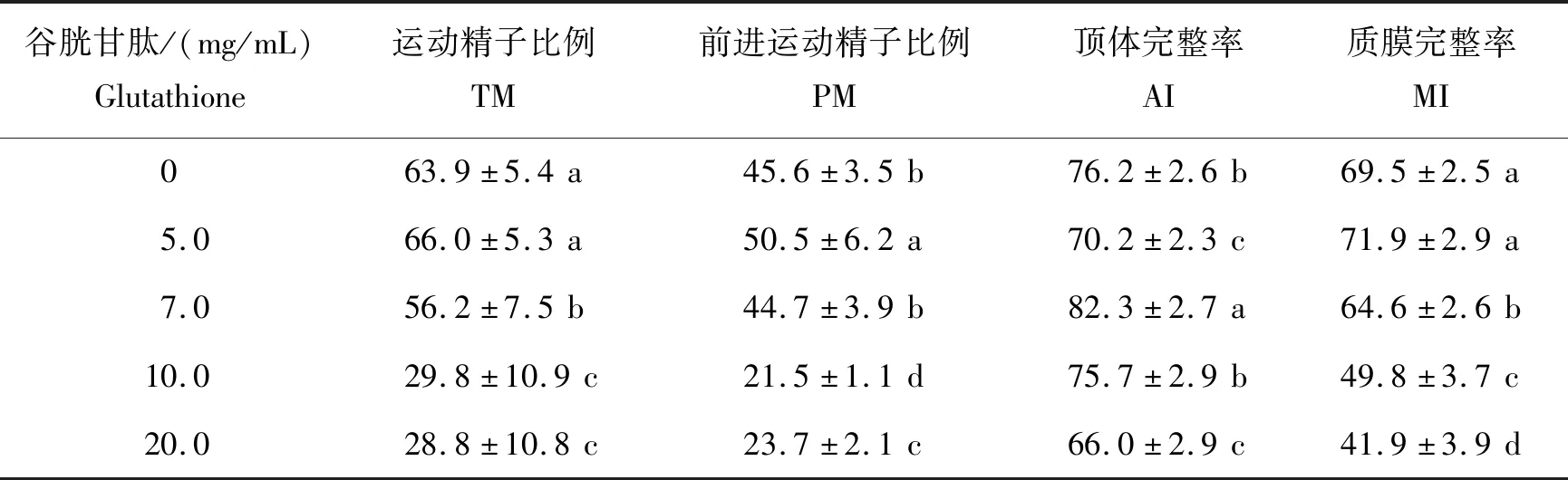
表2 不同剂量的谷胱甘肽对蒙古马精液冷冻保存效果的影响Table 2 Effects of different doses of glutathione on the quality of frozen-thawed Mongolian stallion spermatozoa %
2.1.2不同剂量海藻糖对蒙古马精液冷冻保存效果的影响
由表3可以看出,添加50 mg/mL海藻糖组TM、PM和MI均显著高于其他组(P<0.05);不同剂量海藻糖组内AI未见显著差异(P>0.05)。
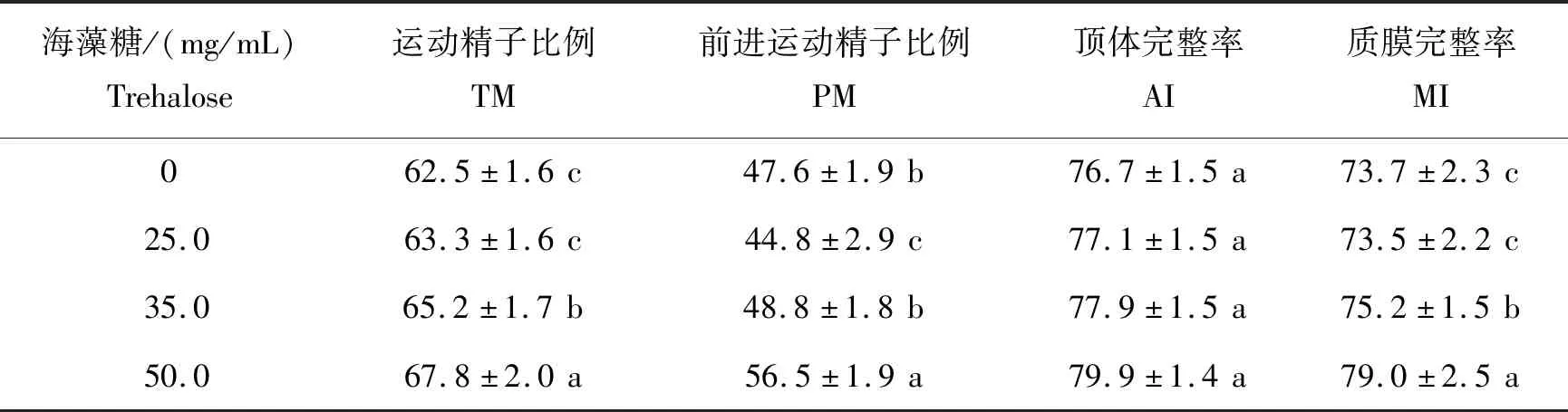
表3 不同剂量海藻糖对蒙古马精液冷冻保存效果的影响Table 3 Effects of different doses of trehalose on the quality of frozen/thawed Mongolian stallion spermatozoa %
2.1.3不同组合谷胱甘肽+海藻糖对蒙古马精液冷冻保存效果的影响
由表4可以看出,联合添加5.0 mg/mL谷胱甘肽+35.0 mg/mL海藻糖组冷冻-解冻后精子TM、PM、AI和MI均显著高于其他联合组(P<0.05),表明联合添加5.0 mg/mL谷胱甘肽+35.0 mg/mL海藻糖可明显提高精子活力、前进运动精子数、质膜完整率、顶体完整率,冷冻效果最好。
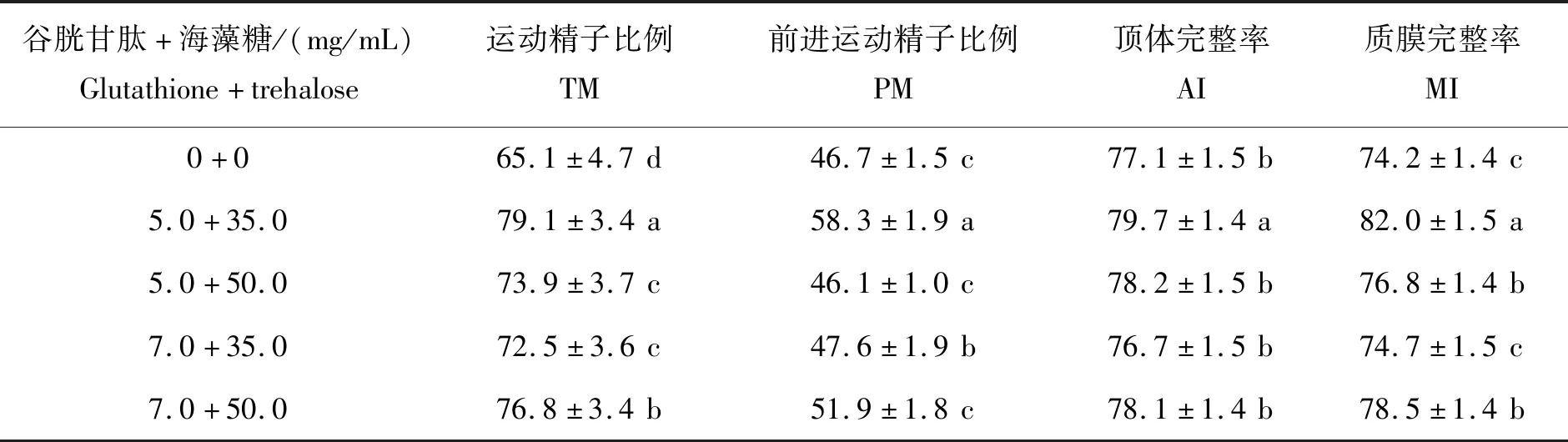
表4 不同组合谷胱甘肽+海藻糖对蒙古马精液冷冻保存效果的影响Table 4 Effects of the combination of glutathione and trehalose on the quality of frozen-thawed Mongolian stallion spermatozoa %
2.2 不同抗氧化剂对蒙古马精液中抗氧化相关指标的影响
2.2.1不同剂量谷胱甘肽对蒙古马精液中抗氧化相关指标的影响
谷胱甘肽对精液中MDA含量及4种抗氧化酶活性的影响如表5所示。由表5可见,与其他剂量组相比,5.0 mg/mL的谷胱甘肽可降低精液中MDA含量;添加4种剂量的谷胱甘肽均可显著提高精液中CAT活性(P<0.05);5.0 和7.0 mg/mL添加组GSH-PX活性均显著高于其他组(P<0.05);5.0 mg/mL 剂量的GR活性显著高于其他组(P<0.05)。
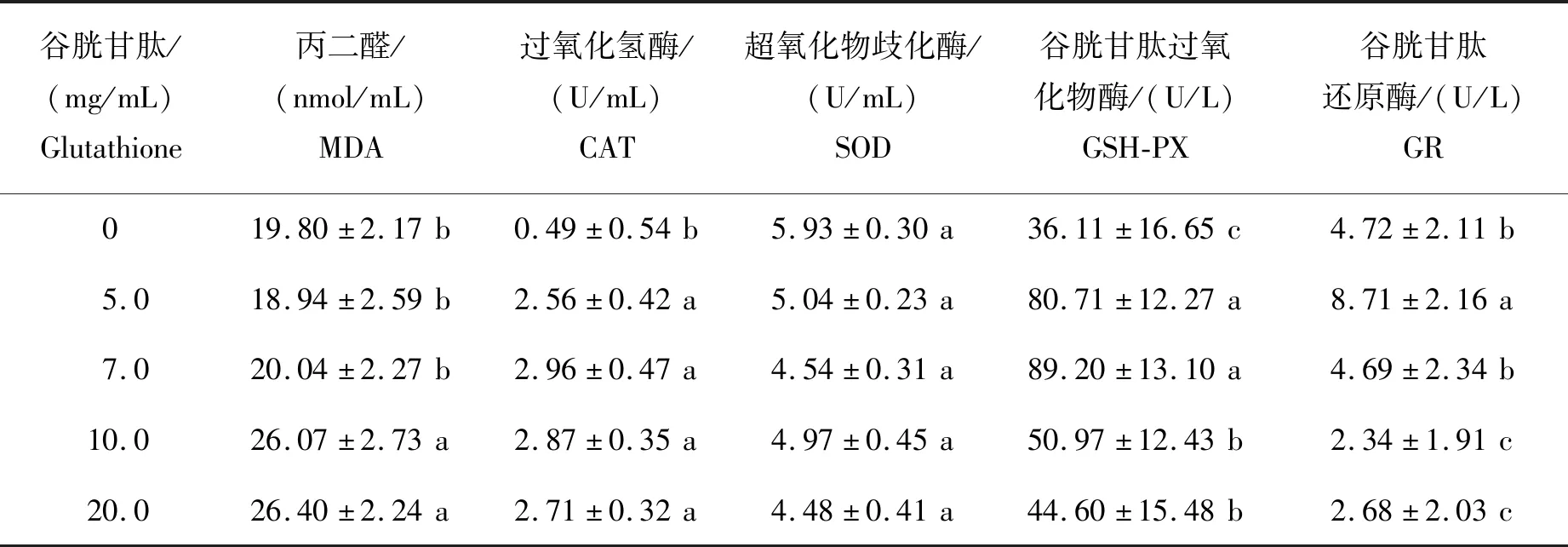
表5 不同剂量谷胱甘肽对蒙古马精液中抗氧化相关指标的影响Table 5 Effects of different doses of glutathione on antioxidase activity in Mongolian stallion semen
2.2.2不同剂量海藻糖对蒙古马精液中抗氧化相关指标的影响
海藻糖对精液中MDA含量及4种抗氧化酶活性的影响如表6所示。由表6可见,海藻糖剂量为35.0 mg/mL时,精液中MDA含量显著低于其他组(P<0.05);不同剂量的海藻糖均可显著提高SOD活性(P<0.05)。
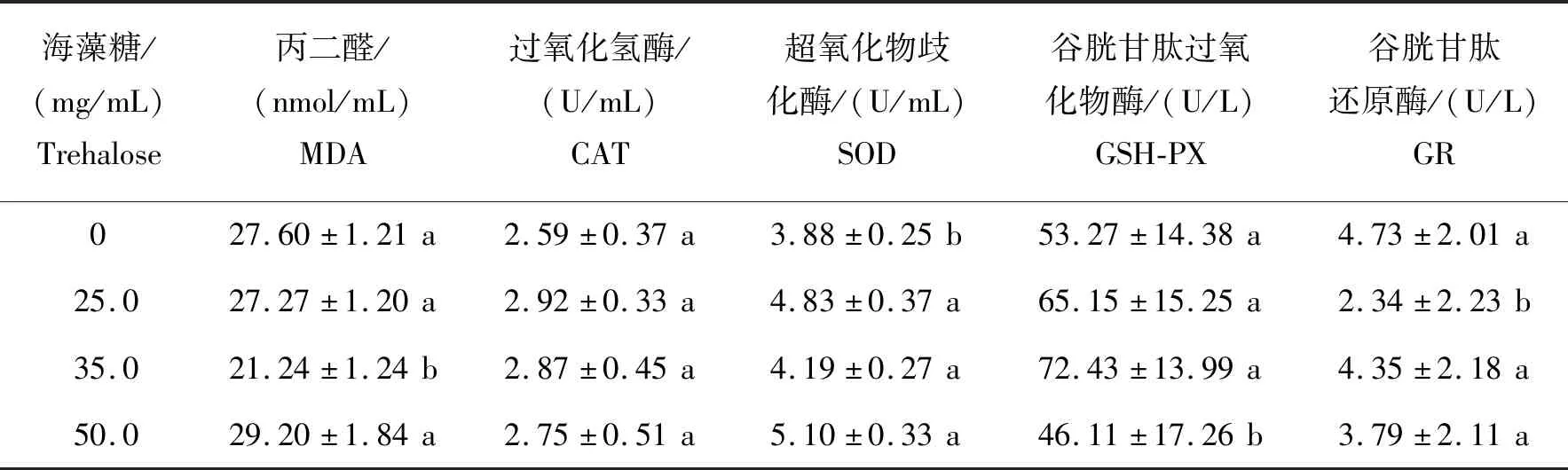
表6 不同剂量海藻糖对蒙古马精液中抗氧化相关指标的影响Table 6 Effects of different doses of trehalose on antioxidase activity in Mongolian stallion semen
2.2.3不同组合谷胱甘肽+海藻糖对蒙古马精液中抗氧化相关指标的影响
不同组合谷胱甘肽+海藻糖对精液中MDA及4种抗氧化酶活性的影响如表7所示。由表7可知,联合添加量为(5.0+35.0)mg/mL时,精液中MDA含量显著低于其他组(P<0.05),GSH-PX活性显著高于其他组(P<0.05);添加组SOD活性均显著高于其他组(P<0.05);CAT、GR的活性组内未见差异(P>0.05)。结果表明,联合添加 5.0 mg/mL谷胱甘肽+35.0 mg/mL海藻糖可显著降低精液MDA含量,提高GSH-PX和SOD活性,避免其遭受过氧化损害,能够在一定程度上提高马冷冻-解冻后精液质量。
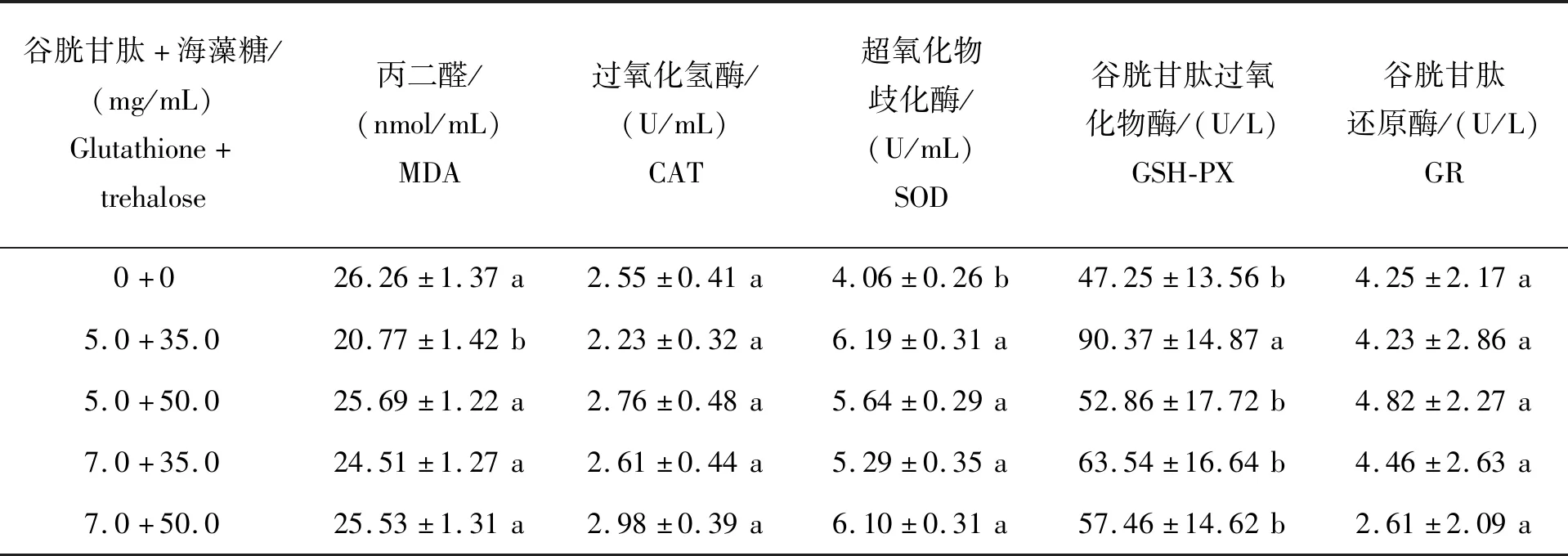
表7 不同组合谷胱甘肽+海藻糖对蒙古马精液中抗氧化相关指标的影响Table 7 Effects of the combination of glutathione and trehalose on antioxidase activity in Mongolian stallion semen
3 讨 论
马精子拥有防御活性氧的主要酶系,当精液经过离心去除精清导致抗氧化酶浓度降低,整个酶系统稳态就失去平衡,清除活性氧效率下降,导致精液质量下降[17]。在冷冻保护液中,加入抗氧化剂能够在一定程度上提高冷冻-解冻后的精液质量,同时能够提升受精能力[3]。SOD主要来源于精清,CAT是精液中最重要的抗氧化酶,而还原型谷胱甘肽参与体内GSH-PX酶促反应,有效促进GSH-PX清除活性氧,同时,作为辅助因子与SOD和CAT相互作用,抑制活性氧产生[4]。海藻糖通过改善抗氧化酶活性而降低了精子的脂质过氧化[18]。Ball等[19]研究发现,活性氧的增多导致脂质过氧化反应,降低马解冻后精子活力,使马精子质量显著下降。Rodrigo等[20]将2.5 mmol/L(0.77 mg/mL)还原型谷胱甘肽添加到种公马冷冻保护液中,改善了精液的TM、PM和MI。Mahdi等[21]将5 mmol/L(1.54 mg/mL)还原型谷胱甘肽添加到种公马稀释液中,改善了精液的TM、PM和MI,降低了MDA含量。Hu等[22]在牛精液中添加的还原型谷胱甘肽组与未添加组相比,MDA含量显著降低,SOD和GSH-PX活性显著升高。本研究发现,5.0 mg/mL谷胱甘肽对精子TM、PM和MI均有提高,可降低精液中MDA含量,添加谷胱甘肽可显著提高CAT和GSH-PX活性,说明添加5.0 mg/mL谷胱甘肽对蒙古马精液品质有改善作用,酶活性的改变可能是由于抗氧化剂参与了酶促反应,提高了精液活性氧清除系统的能力,从而保持精液冻融后的酶系统稳定性,并一定程度上保持了精液质量。然而,Baumber等[23]将10 mmol/L(3.07 mg/mL)谷胱甘肽添加到马精液后均未改善其TM和PM。其原因可能是不同精液冷冻程序、不同马品种精液对不同剂量的差异性。
Diya等[24]添加34.2 mg/mL海藻糖提高了马冷冻精液TM、AI和MI。本研究发现,随着海藻糖的剂量增加,精液各项指标均得到了改善,35.0和 50.0 mg/mL 海藻糖可提高TM、PM、AI和MI,且35.0 mg/mL海藻糖可显著降低MDA含量。综合考虑精液质量和抗氧化相关指标的变化,35.0 mg/mL 剂量的海藻糖可能提高了酶促系统的防御能力,其精液质量也得到了相应的改善。而Arifiantini等[25]添加的50 mmol/L(17.1 mg/mL)海藻糖对冷藏状态下的马精子质量没有产生有益的影响。其原因可能是在冷藏环境下,未产生大量的死精子及其活性氧产物,精液抗氧化酶系统自身能够应对低温应激,因此,海藻糖未能够发挥明显的保护作用。
添加单一的抗氧化剂可能不足以提高精液的冷冻保存质量[26-27]。近年来,联合添加抗氧化剂的组合已成功用于人类[28]、公牛[29]和公猪[15]精子的冷冻保护液中。这些联合添加的组合对精子的保护作用与脂质过氧化物的减少以及抗氧化剂在清除冷冻保存过程中产生的活性氧的协同作用相关。基于单独添加不同剂量抗氧化剂的精子各项指标基础上,本研究分别选取两组最佳添加量,交叉联合添加谷胱甘肽和海藻糖,结果显示,联合添加5.0 mg/mL谷胱甘肽+35.0 mg/mL海藻糖可显著降低MDA含量,提高SOD和GSH-PX活性,可间接反映精子的脂质过氧化反应受到减弱,其抗氧化能力增加,对精子的氧化应激起到了保护作用。与此同时,其TM、PM、AI和MI均显著高于其他联合组,进一步说明,比起单独添加更能提高冷冻精液抗氧化应激能力,从而能更好地发挥其冷冻保护能力。因此,通过测定酶活性进一步探究抗氧化剂对酶系统的作用,对精液整个活性氧清除系统的稳定性具有重要参考意义,也是对进一步研究常规抗氧化剂或对寻找新型抗氧化剂提供重要依据。
本试验中使用的简单离心程序无法将精清全部清除,精液中可能残留少量的抗氧化剂,这些抗氧化剂可能影响精子质量和抗氧化酶活性。因此,优化精液离心程序或选取不受残留精清影响的、更具有代表性的抗氧化剂对精液品质和抗氧化相关指标的作用机理尚需进一步探究,为精液冷冻保存技术提供更全面、更科学的理论依据。
4 结 论
在蒙古马精液冷冻保护液中联合添加5.0 mg/mL谷胱甘肽+35.0 mg/mL海藻糖可显著降低MDA含量,提升SOD和GSH-PX活性,提高了蒙古马精液冷冻-解冻后质量,提示此种组合的抗氧化剂对精子的氧化应激起到了保护作用,但其作用机理仍待进一步研究完善。
