蛋白质对蒙脱石基药物缓释及其生物效应影响*
2020-09-14潘璧莹魏均曼夏觅真吴琳梅
潘璧莹,魏均曼,夏觅真,吴琳梅
(安徽医科大学生命科学学院,安徽 合肥 230032)
粘土矿物(如蒙脱石、高岭石和海泡石等)是层状含水铝硅酸盐矿物,作为一种天然的纳米材料,其有大比表面积,丰富孔隙率,良好吸附性能,较高吸附容量和离子交换能力。因而,可作为多种药物的载体材料,具有载药容量高,缓释性能好等特点[1-2]。虽然将药物负载到粘土矿物基纳米材料上展现出了众多优势,但是纳米材料由于其特殊的物理化学性质,如大的比表面积和高的吸附活性,很容易和生命体系中的蛋白质发生相互作用,在纳米材料表面形成蛋白质冠,这层蛋白冠的形成不仅会影响蛋白质分子本身的结构和生物功能,也可能会改变纳米材料的生物学行为、药物释放和药效情况[3-6]。因此,本实验以蒙脱石为模型粘土矿物,5-氟尿嘧啶(抗癌药物)为模型药物,制备5-氟尿嘧啶/蒙脱石(5-Fu/Mt)缓释药物;以BSA为模型蛋白质,考察BSA浓度、反应时间等因素对药物释放的影响;并采用肺癌A549细胞体外培养的方法,观察BSA存在情况下5-Fu/Mt缓释药物对细胞增殖情况的影响。
1 实 验
1.1 实验材料
主要试剂和仪器:蒙脱石与5-氟尿嘧啶由上海麦克林生化科技有限公司提供;肺癌A549细胞由安徽医科大学生物工程实验室提供;牛血清白蛋白BSA、1640培养基、噻唑蓝(MTT)、二甲基亚砜(DMSO)、透析袋(分子量8000~14000)、考马斯亮蓝等试剂均购于北京索莱宝科技有限公司;UV-5200紫外-可见分光光度计,上海元析仪器有限公司;酶标仪(Infinite M200, Tecan, Austria)。
1.2 5-Fu/Mt缓释药物的制备
烧杯中加入50 mL NaOH,2 g Mt与0.4 g 5-Fu,并在加热至80 ℃的油浴锅中搅拌4 h,去离子水洗涤,离心过滤取上清,在265 nm处测定其平均吸光度。沉淀干燥,研磨得到5-Fu/Mt缓释药物[7]。缓释药物中5-Fu的含量通过吸附前后溶液吸光度的变化,对照5-Fu标准曲线后计算得出。
1.3 BSA分子的吸附
用50 mL 0.01 mol/L pH=7.4的PBS缓冲液配制浓度为0.2、0.4、0.6、0.8和1.0 mg/mL 的BSA溶液,并向其中分别加入200 mg上述方法制备的5-Fu/Mt,于37 ℃条件吸附一定时间(1 h、2 h、4 h、6 h、10 h、16 h、24 h)。而后,取出离心,取上清液利用考马斯亮蓝在595 nm测蛋白质的吸光度,并计算蛋白质吸附量。蛋白质吸附量Qe=[(C0-Ce)×V]/m,Qe为5-Fu/Mt药物对BSA的吸附量,mg/g;C0为吸附前BSA溶液的浓度,mg/mL;Ce为吸附平衡后溶液中BSA的浓度,mg/mL;V为BSA溶液的体积,mL;m为5-Fu/Mt药物的加入量,g。
1.4 药物体外释放
用PBS(0.01 mol/L,pH=7.4)缓冲液配置0.2 mg/mL与1 mg/mL的BSA溶液。实验组:透析袋中加入200 mg 5-Fu/Mt 及 5 mL上述BSA溶液;对照组:透析袋中加入200 mg 5-Fu/Mt及5 mL PBS溶液。将以上透析袋放入装有100 mL PBS的烧杯中,37 ℃水浴下反应。分别于反应10 min、30 min、1 h、2 h、3 h、4 h、6 h、8 h、10 h、12 h后从烧杯中取样5 mL,并将事先预热好的5 mL PBS加入补充。取样液体经过滤后,测其265 nm处吸光度,计算累计释放量(Er)[8]。
式中:Er为5-Fu的累积释放量,%;Ve为释放介质置换体积,mL;V0为起始释放液体积,mL;pi为第i次置换时,释放液中药物浓度,mg/mL;n为置换释放介质的次数;mdrug为起始5-Fu/Mt药物的质量,mg。载药量(D)=蒙脱石所载药物(5-Fu)质量/蒙脱石载药复合物(5-Fu/Mt)质量×100%。
1.5 细胞培养
取肺癌A549细胞在含有10%胎牛血清的1640培养基中,于培养箱内进行培养(5% CO2,37 ℃)。细胞每2天进行传代和换液,取对数生长期细胞开展各项实验。
1.6 MTT检测
处于对数期的肺腺癌A549细胞,用1640培养基(含10%胎牛血清)调整细胞浓度为3.3×104个/mL接种于96孔板,每孔150 μL,于培养箱(37 ℃,5% CO2)培养24 h,每组设置5个复孔。细胞贴壁后弃去培养基,每个孔用PBS清洗两遍。5-Fu/Mt使用前于15 mL离心管中高压蒸汽灭菌(121 ℃,25 min)。
(1)无BSA时5-Fu/Mt对肺癌A549细胞的影响:PBS清洗后,96孔板中分别加入150 μL不同浓度的5-Fu/Mt悬液(10、30、50、100、250、500 μg/mL,无血清1640培养基配制);(2)BSA存在条件下5-Fu/Mt对肺癌A549细胞的影响:分别用25、50、100、200、400 μg/mL的BSA溶液(无血清1640培养基配制,过滤灭菌)为溶剂,配制浓度为30 μg/mL的5-Fu/Mt悬液。PBS清洗后,96孔板中分别加入上述配制的5-Fu/Mt悬液150 μL。为消除5-Fu/Mt对吸光度的影响,设置空白对照组,仅加入150 μL的5-Fu/Mt悬液不接种细胞;阴性对照组则是在含细胞孔中仅加入150 μL的无血清1640培养基;调零孔只加入同体积无血清的1640培养基不接种细胞。
按照上述方法孵育24 h后,弃上清,每孔中加入5 mg/mL MTT试剂20 μL,继续孵育4 h,而后弃MTT试剂,加入200 μL DMSO,震荡处理5 min,保证结晶充分溶解,经酶标仪在490 nm处测定每孔的OD值。细胞存活率=(实验组OD值-对应空白组OD值)/(阴性对照OD值-调零孔OD值)×100%,采用SPSS统计软件进行数据处理,对比采取t检验,在P<0.05时,视为差异存在统计学意义。
2 结果与讨论
2.1 5-Fu/Mt缓释药物对BSA的吸附
图1a为在pH=7.4,37 ℃,吸附24 h条件下,5-Fu/Mt药物对BSA的吸附等温线。结果表明:BSA在5-Fu/Mt缓释药物上吸附等温线形状呈S型。S型吸附等温线是常见的等温线,以表面吸附为主[9]。吸附等温线中,平衡浓度升高时吸附量平缓变化部分表示固体表面已经被溶质单层饱和;浓度再增加,吸附量再增大,可能是溶质分子发生了多层吸附或者溶质分子形成更密集地排列。图1b显示,在吸附开始阶段,BSA快速吸附到5-Fu/Mt表面,并在4 h达到吸附极值。而后,随着吸附的进行,BSA脱附速率大于吸附速率,部分吸附的蛋白质重新回到溶液中,吸附量减小,并在吸附10 h后,达到平衡,使得5-Fu/Mt表面的BSA吸附量基本保持恒定。蒙脱石对蛋白质或氨基酸的吸附主要是通过蒙脱石表面电荷与蛋白质分子发生静电吸引完成[10-11]。蒙脱石为2:1型层状硅酸盐矿物,表面电荷以永久负电荷为主。BSA分子的等电点为4.8,吸附在pH=7.4的PBS缓冲液中进行,因此BSA分子所带的负电荷增加,BSA分子和蒙脱石之间的静电引力减弱,随着吸附时间的增加,BSA分子容易从蒙脱石表面脱附出来[12-14],造成BSA吸附量减小。
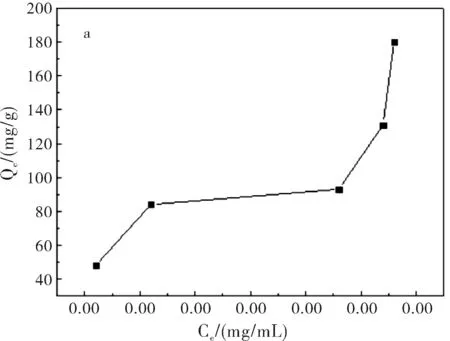
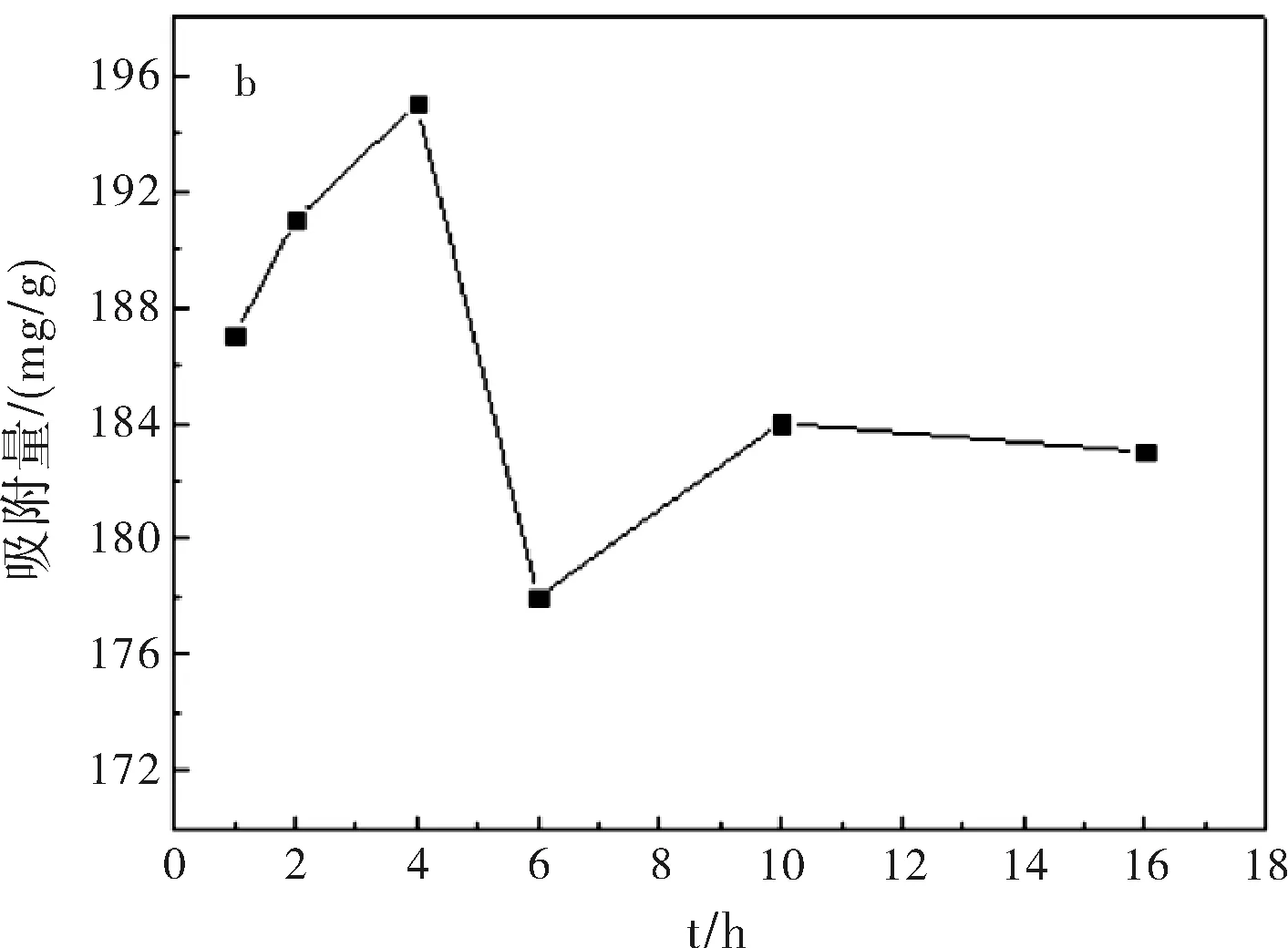
图1 5-Fu/Mt缓释药物对BSA吸附等温线(a)及时间对BSA(1 mg/mL)吸附量的影响(b)
2.2 BSA对5-Fu/Mt药物体外缓释的影响
BSA对5-Fu/Mt药物体外释放的影响如图2所示:0~4 h阶段,BSA的存在明显抑制了5-Fu的释放,且BSA的浓度越大,抑制程度越大;4~12 h阶段,BSA对5-Fu释放的抑制作用减弱,低浓度BSA(0.2 mg/mL)存在时5-Fu的释放量与对照组(0 mg/mL BSA)几乎相等。结合BSA的吸附实验数据(图1b)推测造成这一现象的原因可能是:BSA分子在0~4 h内大量吸附到5-Fu/Mt表面,与5-Fu发生相互作用,从而影响其从Mt载体中释放,且BSA的浓度越大,吸附量越多(图1a),抑制作用越明显;4 h后,由于大量吸附的BSA从5-Fu/Mt上脱附出来,因此BSA对5-Fu释放的抑制作用减弱。
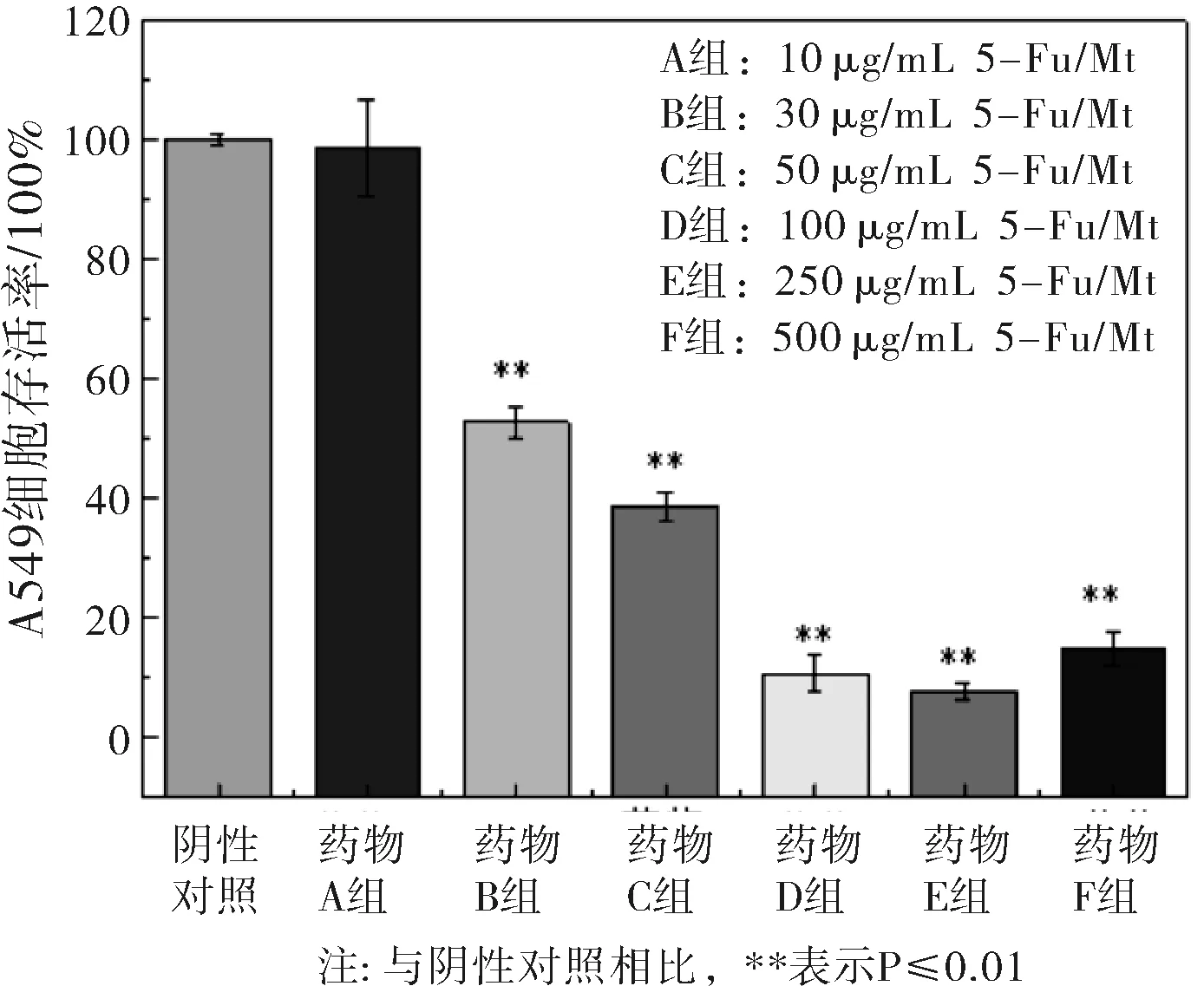
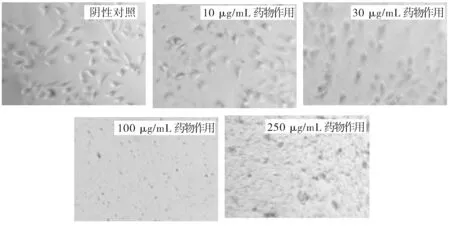
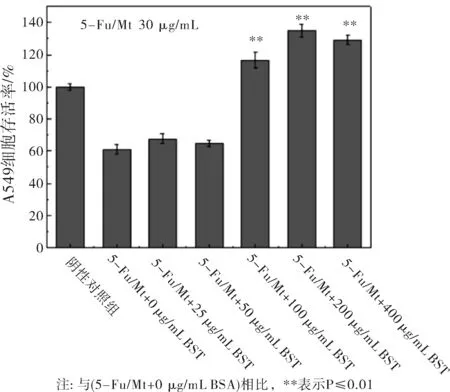
利用DDSolver软件对5-Fu/Mt药物在不同BSA浓度下的释放数据进行Peppas方程(Q=Ktn)拟合,研究药物释放机制。式中,Q为累积释放百分率,t为释放时间,n为释放机制表征参数。当n≤0.45时,药物的释放机制为Fick扩散;当0.45 图2 BSA浓度对5-Fu/Mt药物体外缓释的影响 图3 5-Fu/Mt药物浓度作用下A549细胞的存活率 5-Fu可引起细胞的自噬或者凋亡以此来抑制细胞的生长,从而导致细胞的存活率降低[16]。当5-Fu负载到Mt上时,其对细胞的影响如图3所示:无BSA情况下,5-Fu/Mt对肺癌A549细胞的存活有一定的抑制作用,且5-Fu/Mt浓度越大,抑制作用愈明显(P<0.01)。肺癌A549细胞与不同浓度(10、30、50、100、250、500 μg/mL)5-Fu/Mt药物作用24 h后,细胞形态的变化如图4所示:阴性对照组的肺癌A549细胞贴壁生长,细胞呈多边形或者梭形,视野下细胞数量较多。低浓度(<50 μg/mL)5-Fu/Mt药物作用下,随着浓度的增加,视野下细胞数量减少,并且细胞固缩变圆,体积变小,呈半贴壁状态;然而,进一步增大药物浓度到100和250 μg/mL时,由于药物浓度过大,视野下只看到悬浮在培养基里的5-Fu/Mt药物,几乎看不到细胞。由改良寇式法计算得出的半数抑制浓度(IC50)=27.67 μg/mL。综合考虑,在后续实验中,5-Fu/Mt药物的浓度设置为30 μg/mL。 当体系中BSA存在时,其浓度是影响5-Fu/Mt药效的重要因素。如图5所示:低浓度(25 μg/mL、50 μg/mL)BSA分子的加入,并未能显著引起细胞存活率的改变(P>0.05)。但是,当BSA浓度大于100 μg/mL时,5-Fu/Mt药物对肺癌A549细胞的抑制作用失效,细胞存活率显著提高(P<0.01)。 图4 无BSA存在时显微镜下A549的细胞形态随5-Fu/Mt 图5 BSA存在条件下5-Fu/Mt对A549细胞存活率的影响 5-Fu/Mt药物能够吸附大量的BSA分子,并在10 h后达到吸附/脱附平衡。吸附上的BSA分子影响5-Fu/Mt药物的缓释,0~4 h阶段,BSA显著抑制了5-Fu的释放,且BSA的浓度越大,抑制程度越高,4 h后由于大量吸附的BSA分子脱附出来,BSA的抑制释放作用减弱。数据拟合结果显示5-Fu/Mt药物在不同BSA浓度下的释放机制均为Fick扩散。5-Fu/Mt对肺癌A549细胞的半数抑制浓度为27.67 μg/mL,高浓度BSA的存在减弱了5-Fu/Mt对肺癌A549细胞的生长抑制作用。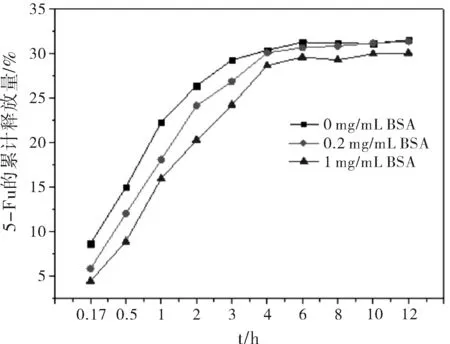
2.3 BSA存在时5-Fu/Mt对肺癌A549细胞的影响
3 结 论
