地黄叶片响应遮阴处理的分子响应机制解析△
2020-09-14李明杰谢彩侠古力杨超飞杜家方王丰青张重义
李明杰,谢彩侠,古力,杨超飞,杜家方,王丰青*,张重义*
1.福建农林大学 农学院,福建 福州 350002;2.福建农林大学 作物遗传育种与综合利用教育部重点实验室,福建 福州 350002;3.河南中医药大学 药学院,河南 郑州 450046;4.河南农业大学 农学院,河南 郑州 450002
药用植物与栖息地生境的相互作用是药用植物次生代谢产物合成的重要原因。其中,光照是影响药用植物生长发育、形态建成的核心生态因子,也是植物初生和次生代谢途径的重要驱动因子。药用植物所处生态区域的海拔、坡向、经纬度不同,其所受到光照辐射参数也存在明显的差异。药用植物在长期适应特定地区的光照尺度变化过程中,逐渐的适应并固化这些光照特质,形成了不同光照需求度和喜光特性以及特定外形[1]。因此,光照条件对于特定生态区中外源迁徙和驯化植物的成功生存起着极其重要的作用,是决定植物能否成功驯化并进化的重要决定性因素之一[2]。因此,光照也成为药用植物道地性形成过程中最为重要的生境支配因素之一。目前,光照强度对阴生药用植物影响的研究相对较多,但大部分研究集中在最适光强、光质的筛选以及光照对药用植物活性成分诱导性效应;但光照是如何调控药用植物发育和影响药用植物次生代谢合成的,其具体机制尚不清晰。
地黄RehmanniaglutinosaL.是玄参科植物,以块根入药,始载于《神农本草经》,被列为上品,为常用大宗药材。地黄药材味甘、苦,性寒,归心、肝、肾经,功用清热生津、凉血、止血。道地产区为古“怀庆府”,即今河南焦作地区,包括温县、武陟、博爱、沁阳等沁河两岸部分县区[3-4]。目前,在道地产区常年都有很大的种植面积,产值达数十亿元。在非道地产区山西、山东、河北也有较大的种植面积,甘肃、黑龙江等省份也有种植。地黄是典型的喜光药用植物之一,合适的光照强度对于地黄植株的形态建成、块根发育和药用成分合成起着极其重要的作用。在地黄的栽培生产实践中,充足的光照是保证地黄产量和品质的重要前提条件之一。前期研究发现地黄叶片和根组织中均含有毛蕊花糖苷、梓醇等地黄的代表性药用活性成分,而遮阴则能显著影响地黄的叶片发育,同时,导致其中毛蕊花糖苷的含量降低,遮阴程度越高其降低幅度越大[3]。为了进一步详细探究光照强度与地黄叶片发育和次生代谢产物的累积机制间的关联性,本研究以地黄作为研究材料,通过遮阴的方法人为模拟出不同光照强度条件,探究不同光照强度对地黄生长发育的影响;同时,用转录组测序技术(RNA-Seq)解析不同光照强度对地黄转录水平的扰动效应,从分子水平上探究光照强度对地黄叶片发育及内在代谢机制的影响。以期为阐明光照因子对药用植物代谢积累机制奠定基础,同时,也为道地药材的形成机制和建立合理的耕作制度研究提供参考。
1 材料与方法
1.1 实验材料与遮阴处理
选用地黄品种“温85-5”作为遮阴处理对象,经河南中医药研究院张留记研究员鉴定,所用实验材料为R.glutinosaL.。受试地黄“种栽”播种于河南农业大学农场隔离实验田内,生长发育期间的栽培管理措施与大田生产保持严格一致。在地黄出苗30 d后,利用不同透光水平的遮阴网进行梯度遮阴处理。具体操作方法如下:设置3个处理组,每组处理选择80~100株地黄苗。在地黄出苗后30 d左右,保留1组地黄在正常光照下进行生长(全光照),剩余2组地黄则分别进行60%和90%的遮光处理,3组处理平行进行实验。所有处理分别在遮阴处理后的30、60、150 d取样,每处理随机取10株长势一致植株,详细统计其叶长、叶宽及叶片数等叶部关键参数。选取不同处理下30 d的叶组织制备石蜡切片,详细观察其组织结构的差异,同时,将90%遮阴及全光照样品用液氮冻存,进行下游的RNA-Seq转录组测序,获取遮阴处理下叶内的关键分子响应进程。
1.2 RNA-Seq及分析
用TRIzol法提取不同遮阴处理地黄叶的总RNA,利用DNase I去除样品总RNA中残存DNA片段。然后,利用嵌有Oligo(dT)接头的磁珠对样品中的mRNA进行富集。对富集出的mRNA进行片段化处理,并以这些碎片化的mRNA为扩增模板,反转录为cDNA。cDNA样品在经过末端修复、测序接头添加、特定片段切胶回收、多轮扩增及纯化等一系列步骤后,完成测序文库的制备。利用Agilent 2100 Bioanalyzer和ABI Step One Plus Real-Time PCR System对所已经构建的测序文库的质量和产量进行评测,将经过质控检测的文库进行高通量测序(华大基因),选用Ion Proton平台进行测序。
对测序所获取的原始数据(raw reads)进行质控处理,过滤掉其中低质量、接头等污染序列,获取clean reads序列。将clean reads与地黄参考序列库进行比对,统计不同样品的reads比对率以及分布,进一步评估不同样品所获取的reads序列中外源序列污染水平。在此基础上,根际地黄参考序列中reads匹配数来计算不同样品转录本的表达水平,表达量用FPKM表示。对比分析遮阴前后地黄叶片中转录本的表达水平,获取响应遮阴处理的特异响应基因,并对其进行GO和KEGG富集分析,获取遮阴处理下地黄叶片内关键分子响应进程。
1.3 实时荧光定量PCR
提取不同处理叶片的总RNA,利用反转录试剂盒(TaKaRa,大连)进行cDNA第一链合成。反转录体系:<2 μg总RNA,1 μL oligo dT Primer(50 μmol·L-1),0.5 μL RNAase Inhibitor(40 U·μL-1),1 μL dNTP Mixture,4 μL 5×PrimeScript Ⅱ Buffer,1 μL的PrimeScript Ⅱ RTase(200 U·μL-1),加ddH2O补充至20 μL。在42 ℃ 60 min,95 ℃ 5 min的条件下进行反转录。以不同差异基因的编码区序列为模板设计qPCR引物(见表1),选用RgTIP41基因作为内参。利用SYBRPremix ExTaqTMⅡ (Tli RNaseH Plus) (Takara,大连)荧光实时定量PCR试剂盒对不同基因的表达量进行分析。qPCR采用25 μL反应体系,包括2 μL上述反转录cDNA,1 μL上游引物(10 μmol·L-1),1 μL下游引物(10 μmol·L-1),12.5 μL SYBRPremix ExTaq,8.5 μL ddH2O。具体反应程序设置:95 ℃下30 s;95 ℃下5 s,60 ℃下30 s,循环数40。反应结束后,导出不同样品的扩增Ct循环数,利用2-ΔΔCt法来计算不同转录本的相对表达水平。
2 结果与分析
2.1 遮阴对地黄叶片的表型和组织解构的影响
为了详细了解不同光照强度对地黄叶片生长和发育影响,在大田条件下,在其他因素不变情况下,分别用60%、90%的遮阴网对地黄进行人为的遮阴处理。结果发现,遮阴后地黄的生长受到明显的影响。遮阴后地黄叶片变平展,叶色由黄绿变深绿(见图1A)。叶片上的泡状凸起减少或变小,且随着遮阴程度的增加而消失(见图1A)。叶片变薄,叶肉栅栏组织和海绵组织细胞减少、变小(见图1B)。遮阴30 d后,2种遮阴叶片大小与对照相差不多,但叶片数量减少;遮阴60 d时,90%遮阴的叶片长度、宽度和叶片数均显著低于60%遮阴和未遮阴对照;150 d时,60%和90%遮阴的叶片长度、宽度和叶片数均显著低于未遮阴对照(见图1C)。说明遮阴对地黄地黄部叶片的生长有着显著的影响,且随着遮阴程度的增加和遮阴时间的延长表型变化更加明显。

表1 用于确认RNA-Seq差异表达基因准确性的qPCR引物
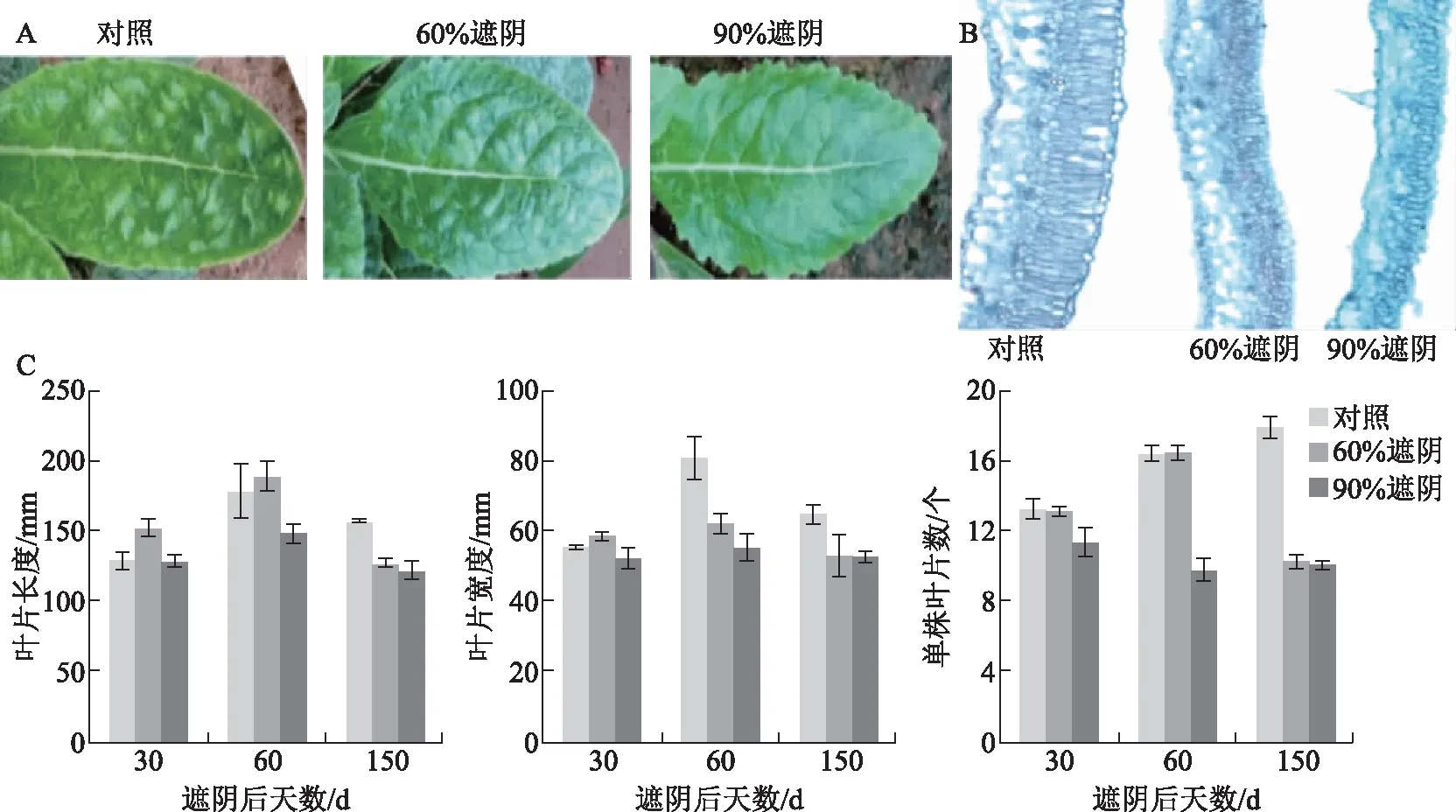
注:A.遮阴对地黄叶片泡状凸起的影响;B.遮阴对地黄叶片解剖结构的影响;C.遮阴对地黄叶片长度、宽度和叶片数的影响。图1 遮阴对地黄叶片生长的影响
2.2 遮阴对地黄叶内的关键细胞进程的影响
为了深入解析遮阴处理对地黄叶片内在分子进程的影响,选取对地黄叶片表型和组织解构具有明显影响的90%遮阴处理,通过RNA-Seq技术详细分析其与正常叶片间的响应基因差异。结果在全光照地黄、90%遮阴的地黄的叶中分别获取了11 865 182和10 606 388个clean reads(见表2)。将这些序列与前期已经构建的地黄转录组库进行比对,发现全光照和遮阴处理叶中分别有98.99%和98.91%的clean reads可以匹配到转录组上,其中,特异匹配的序列分别占到总序列的76.00%和75.32%。从2个样品的reads匹配率可以明显看出,2个样品中所产生的clean reads,有98%以上的序列可以匹配到地黄转录组,说明2个样品的测序质量均达到了较高水平,可以进行下游的定量分析。
为了进一步获取遮阴处理和正常光照间的差异响应基因,分别将遮阴处理样品和对照样品的基因进行定量,同时,进行差异显著性分析。结果发现有2393个基因在90%遮阴处理和对照间出现差异表达,其中,有1456个基因在遮阴处理后叶内显著上调,有937个下调(见图2)。为了确证这些通
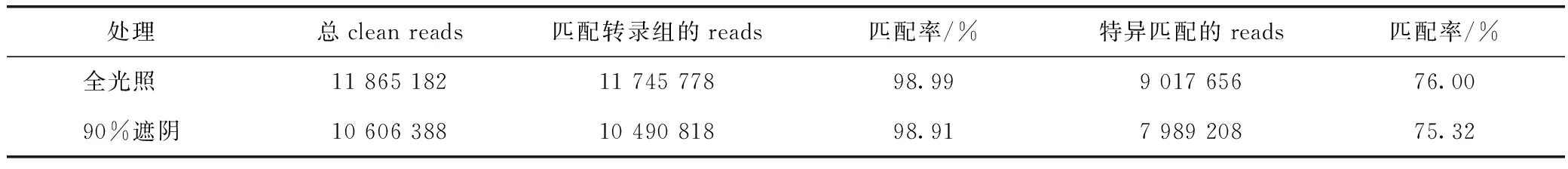
表2 遮阴处理地黄和对照地黄叶片RNA-seq测序结果统计
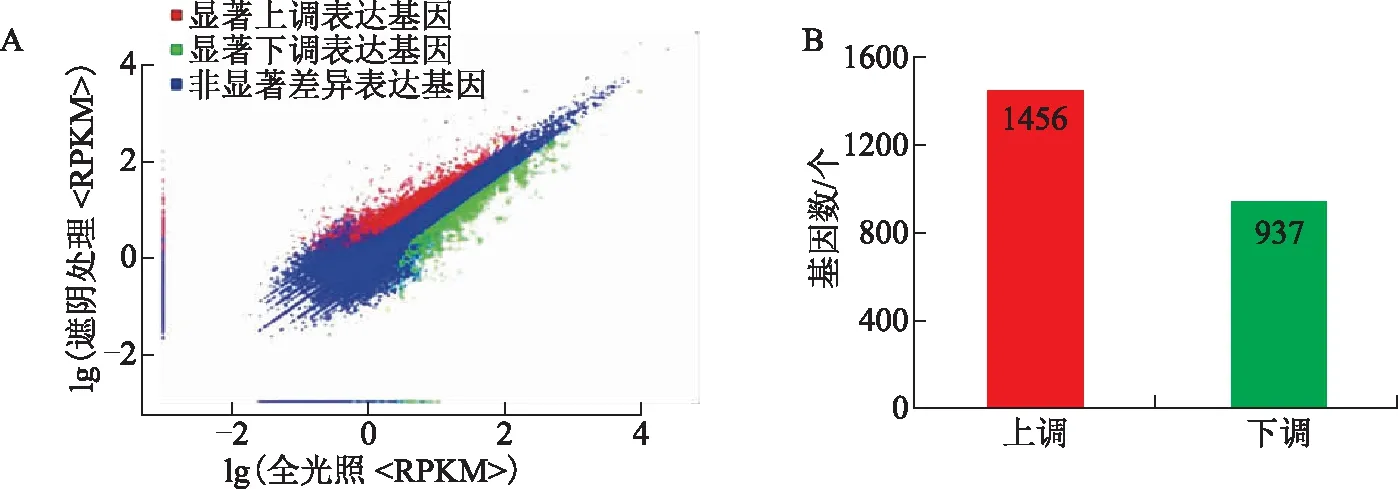
注:A.遮阴处理地黄与正常光照处理地黄间显著差异表达基因分析;B.遮阴处理地黄与正常光照处理间显著差异表达基因数量。图2 遮阴处理与正常光照(全光照)地黄叶片间显著差异表达基因的鉴定与筛选
过数字基因表达分析所获取差异基因的准确性,从上述显著差异表达的基因中挑选RgWRKY(CL4160.Contig2)、RgBRI-KI(CL4599.Contig2)、RgA-AAR(CL3002.Contig2)、RgERF(Unigene2558)、RgMYB(Unigene21429)、RgEXPA8(Unigene10535)、RgEXPA1(Unigene13756)和RgCAD(CL379.Contig1)等8个基因,利用 qRT-PCR方法对其进行定量。结果发现qRT-PCR 与通过数字基因表达谱分析中所获取的上、下调基因的差异表达趋势基本一致,相关系数达到 0.936(见图3),这表明本研究通过数字基因表达谱方法所鉴定差异基因是较为可靠性的。
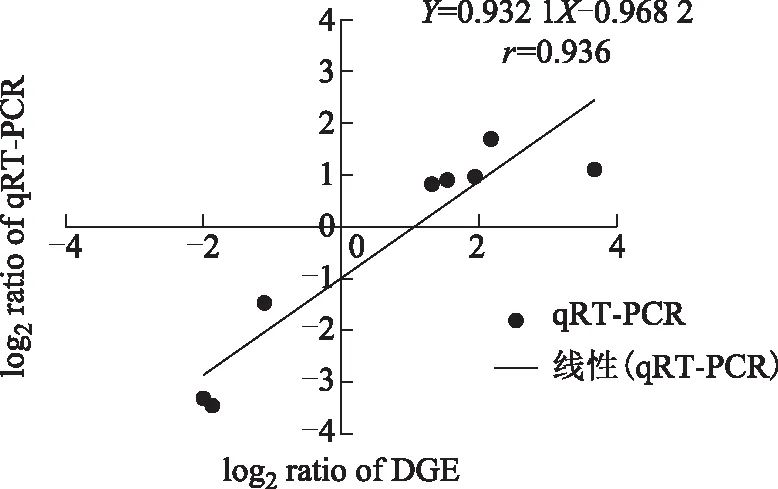
图3 RNA-seq数据与qRT-PCR结果的相关性分析
2.3 地黄叶片中响应遮阴处理关键基因的功能分析
为了解析遮阴处理下地黄叶片中关键表达基因功能,将已经获取差异表达基因进行GO和KEGG功能注释。GO功能分类主要从分子功能(molecularfunction)、细胞位置(cellular component)、生物进程(biological process)3个层级上来描述相应基因的功能。详细分析遮阴处理和对照间差异基因的GO的功能分类发现:在生物进程分类中有22个GO条目匹配了相应差异基因,其中,细胞代谢进程(metabolic process)和细胞进程(cellular process)条目中所包含的基因数量最多,而细胞节律(rhythmic process)和细胞杀伤性(cell killing)条目中基因最少。在细胞位置分类中,共有11类GO条目匹配了相应基因,其中,细胞(cell)、细胞部位(cell part)2个条目中所匹配的基因数量相对较多,细胞器(organelle)条目中较少,细胞连接(cell junction)、胞外区部位条目中所占基因数量最少。此外,在分子功能分类中,共有10类GO条目匹配了相应基因,其中,催化剂活性(catalytic activity)、结合(binding)条目所匹配的基因最多,其次为转运活性(transporter activity),其它7类GO条目所匹配基因总数均在50以下(见图4)。上述结果表明遮阴处理影响了地黄叶内的多重细胞进程。
同时,为进一步深入解析遮阴处理内叶片差异响应基因功能,利用KEGG数据库对所获取的差异基因所涉及的代谢通路进行分析。结果发现遮阴处理与对照间有 1278个差异表达基因可以富集归类到120个代谢进程中,占总差异基因的53.4%,有23个
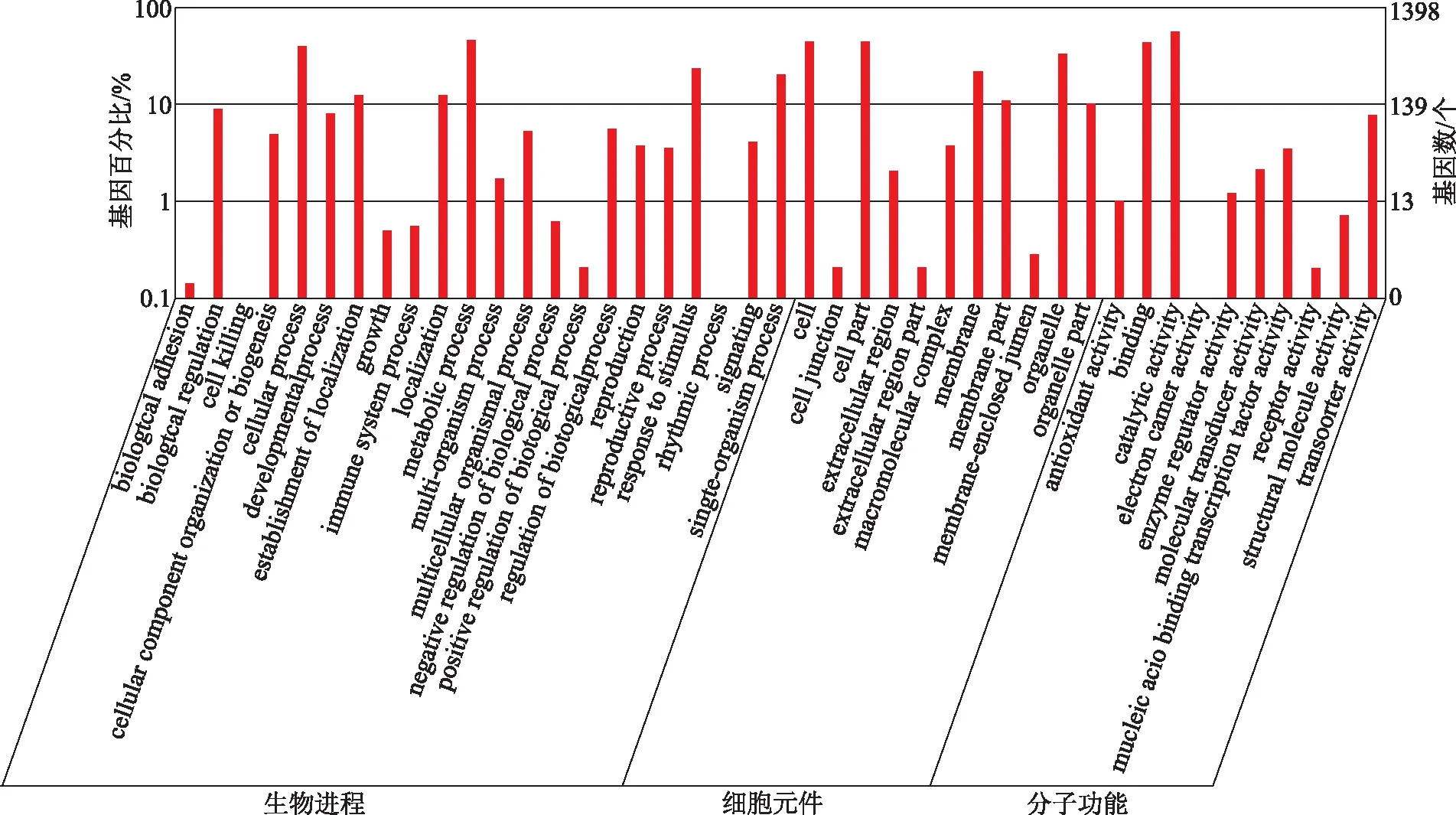
图4 遮阴后地黄叶片中差异表达的基因GO分类
代谢通路达到了显著富集水平(P<0.05)(见表3)。其中,有139个差异基因在真菌和植物互作进程中(Plant-pathogen interaction)显著富集,占到总差异基因的10.88%,这侧面反应了遮阴可能引发了植物叶片内应激逆境响应。有104个差异表达基因在植物激素信号转导(Plant hormone signal transduction)通路中显著富集,这说明遮阴处理扰动了地黄叶片中正常激素信号系统响应,间接影响了叶片的正常生长发育。有59个差异表达基因在苯乙醇苷类物质生物合成(Phenylpropanoid biosynthesis)通路也被显著富集,这表明遮阴处理可能影响了地黄叶片中次生代谢产物的正常合成。此外,值得注意的是,与淀粉与蔗糖代谢(Starch and sucrose metabolism)、类胡萝卜素生物合成(Carotenoid biosynthesis)、黄酮类物质的生物合成(Flavonoid biosynthesis)、单萜类物质的生物合成(Monoterpenoid biosynthesis)以及倍半萜和三萜类物质的生物合成(Sesquiterpenoid and triterpenoid biosynthesis)等初生、次生代谢进程密切关联的通路中也显著富集了大量差异表达基因,这表明遮阴处理显著影响了地黄初生代谢以及次生代谢产物正常合成进程,从而间接的影响了地黄叶内干物质的积累以及关键药用活性成分的累积。总之,通过遮阴处理下关键差异基因的功能途径的初步解析,为进一步了解地黄叶片生长发育、逆境胁迫和次生代谢产物积累的分子调控机制研究提供了关键参考信息。
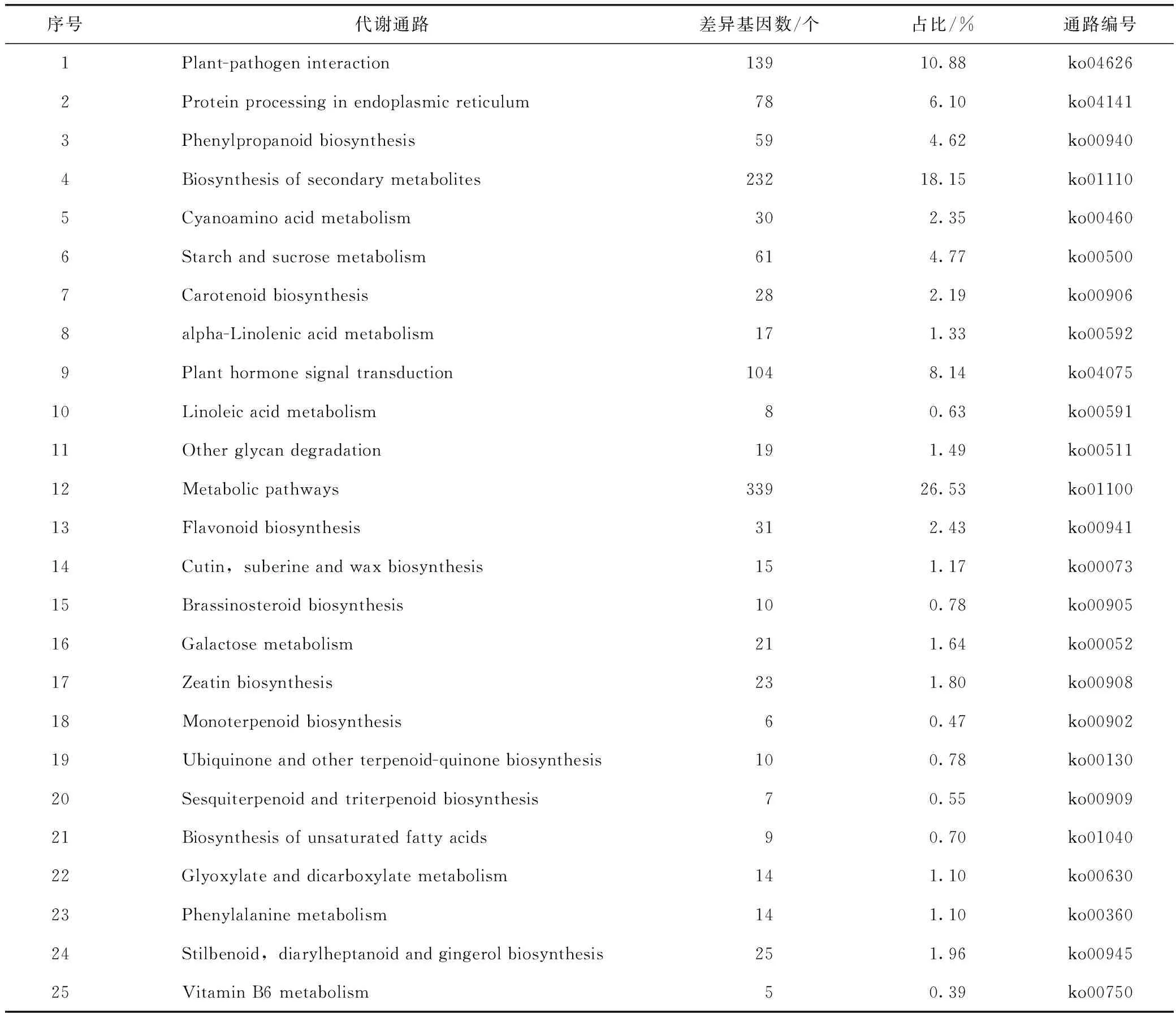
表3 遮阴处理后差异基因富集的前25个代谢通路
2.4 地黄叶片中响应遮阴处理关键分子事件
2.4.1遮阴处理干扰了光合通路关键基因的表达 分析遮阴后地黄叶片中参与光合作用相关基因表达情况,发现参与光合通路(Photosynthesis)的11个基因均在遮阴后下调表达(见表4)。这些基因主要包括光系统I的P700 叶绿体a脱辅基蛋白A2基因psaA和亚基Ⅷ基因psaI,光系统II的反应中心D1蛋白基因PsbA和13 kDa蛋白基因Psb28,细胞色素b6/f复合体的脱细胞色素f基因petA,以及F-ATP酶α基因、β基因和a亚基基因。
2.4.2遮阴处理影响了叶片中关键激素代谢和关键信号通路 在遮阴地黄叶片差异基因富集的KEGG信号通路中,植物激素信号通路显著被富集(见表5)。鉴定出生长素信号通路中AUX1基因、AUX/IAA蛋白基因、生长素响应蛋白ARF基因和生长素应答GH3基因等17个多数差异表达的基因,在遮阴后的地黄叶片中14个基因上调表达,仅有3个下调表达。在细胞分裂素信号通路中,细胞分裂素受体蛋白基因CRE1、 B型ARR蛋白基因上调表达,A型ARR蛋白基因下调表达,说明遮阴后叶片细胞的分化受了影响。在赤霉素信号通路中,有10个DELLA蛋白基因均呈下调表达。乙烯信号通路中,1个乙烯受体蛋白基因ETR下调表达,而5个苏氨酸蛋白激酶基因CTR1均呈上调表达。这些结果表明遮阴处理改变了叶片内关键激素信号系统调节功能,这种变化更多的体现了叶片在弱光环境下适应性调节变化。
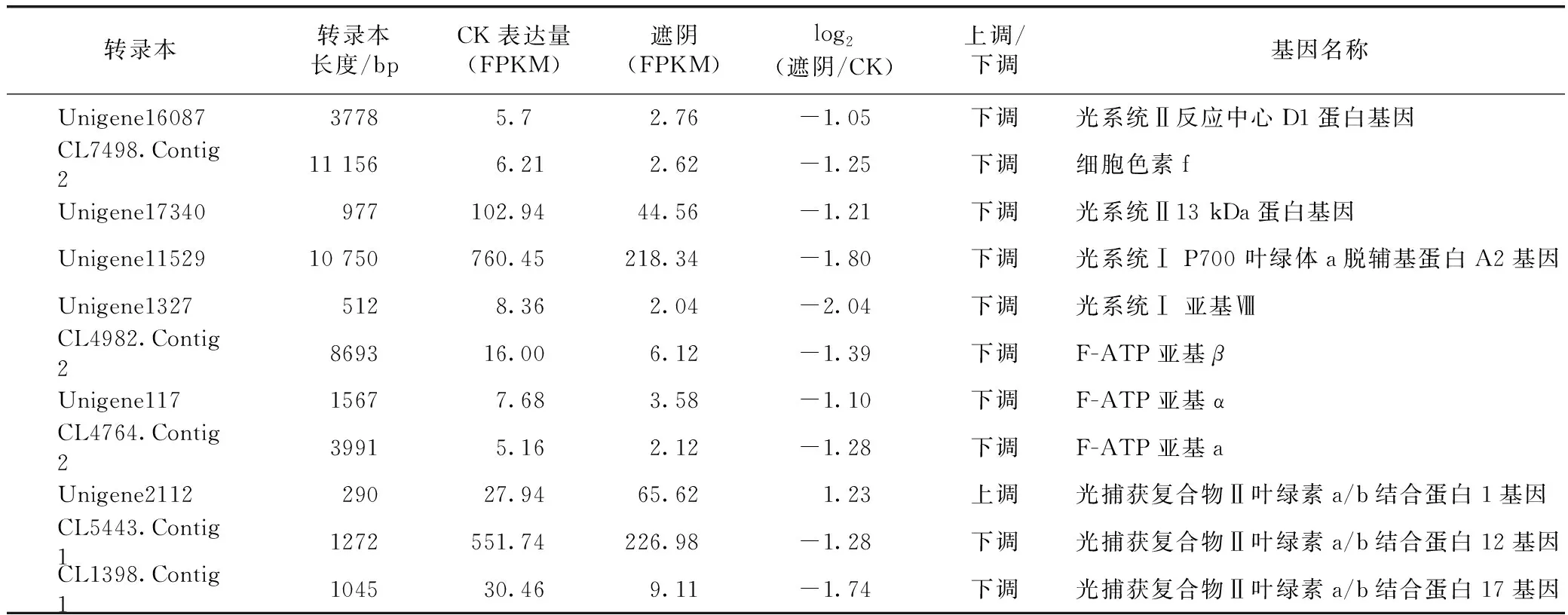
表4 RNA-Seq分析鉴定的光合系统相关的差异表达基因
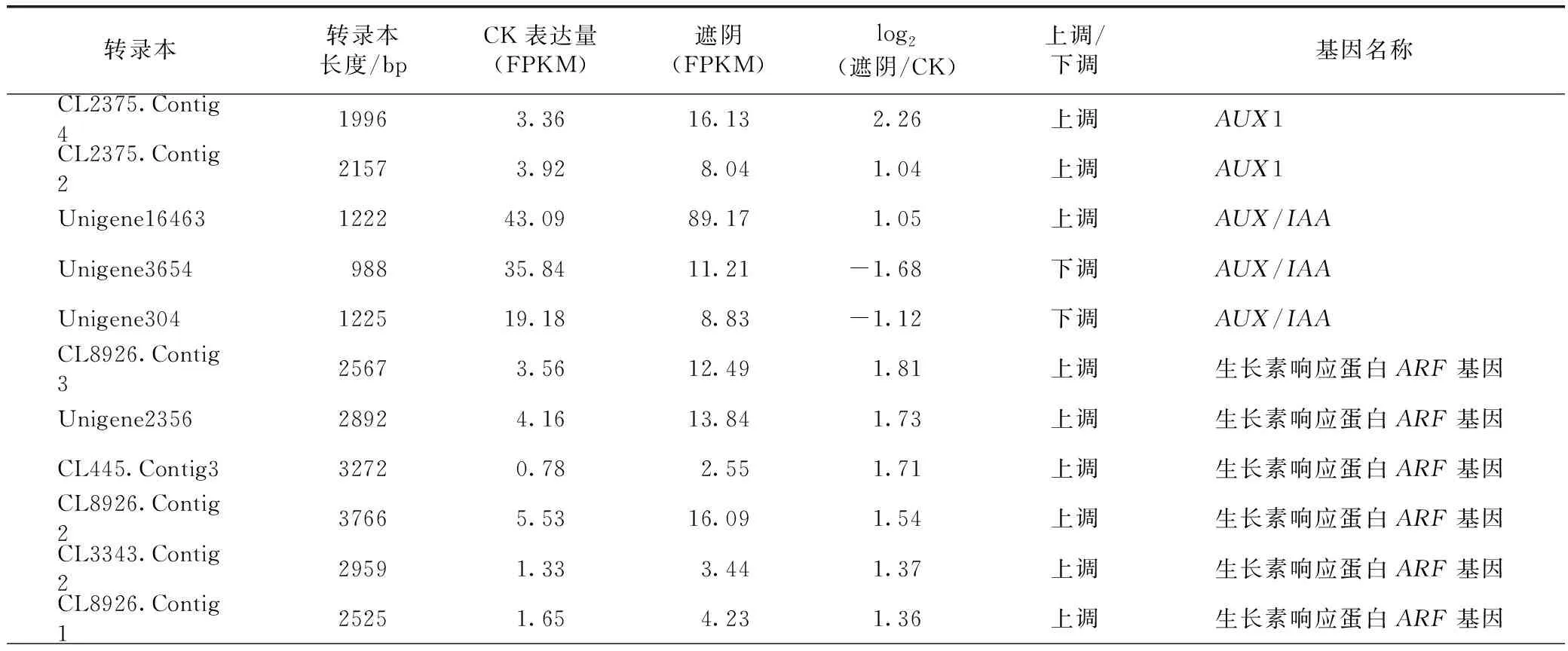
表5 RNA-Seq分析鉴定的激素调控相关的差异表达基因
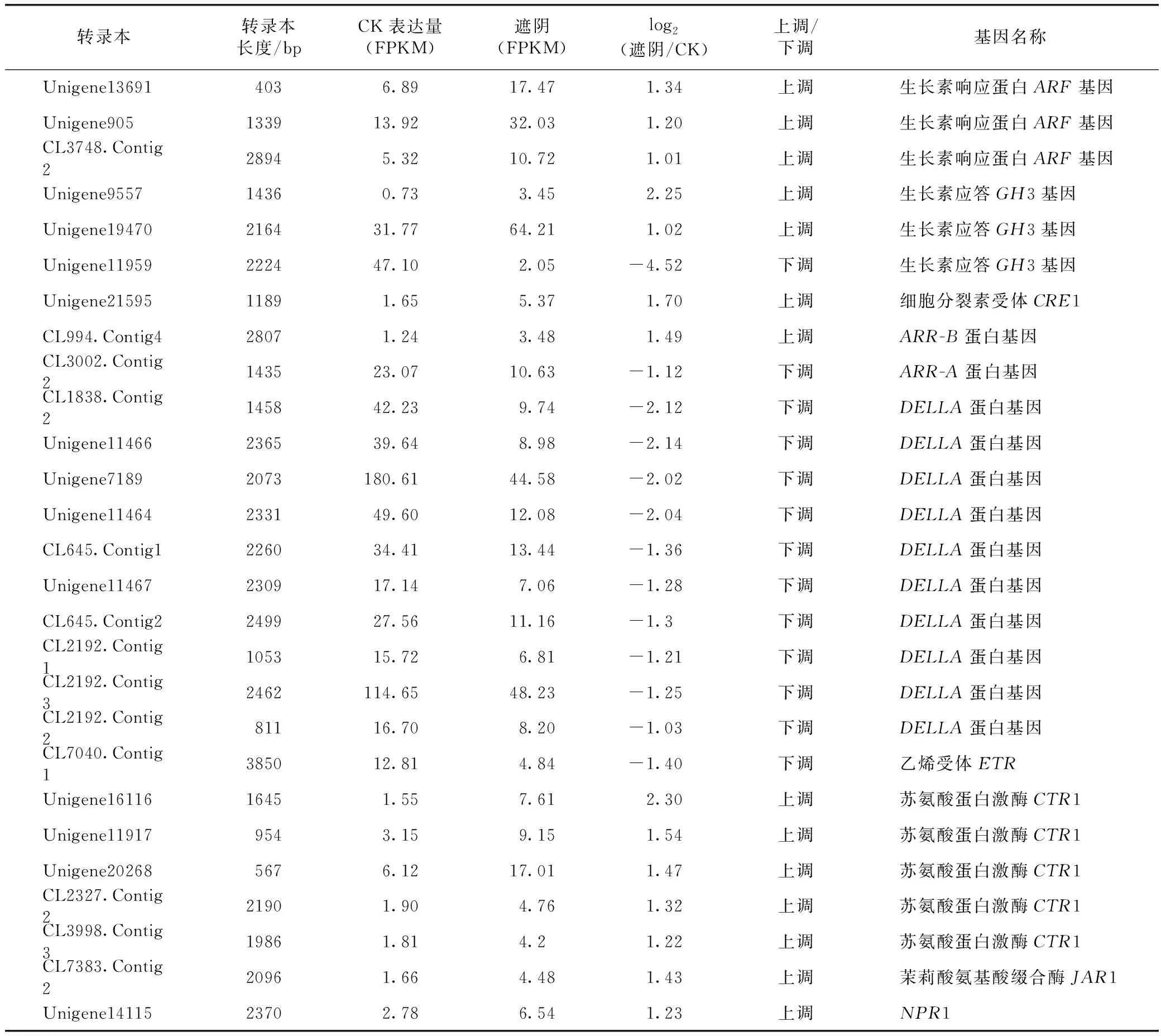
续表5
2.4.3遮阴处理抑制了梓醇和毛蕊花糖苷合成通路中关键催化酶基因的表达 梓醇和毛蕊花糖苷是地黄植株中标志性药用活性成分,为了解析遮阴对地黄叶片中2种关键药用活性成分的影响,对遮阴处理下梓醇和毛蕊花糖苷代谢通路中关键催化酶基因的表达变化进行了详细分析。结果发现鉴定出12个差异表达的催化酶基因涉及梓醇合成,其中11个下调表达,仅有1个基因上调表达(见表6)。在下调表达的关键基因中,包括1-脱氧-D-木酮糖-5-磷酸合成酶(DXS)、4-羟基-3-甲基-2-丁烯基焦磷酸还原酶(HDR)和异戊二烯基二磷酸δ-异构酶(IPI)等萜类成分合成的骨干催化酶。此外,梓醇合成通路中的关键酶异戊二烯合酶(GES)、8-羟基香叶醇脱氢酶(10HGO)和鲨烯单加氧酶(SQM)在遮阴也呈现显著下调。这些与梓醇、毛蕊花糖苷合成密切相关催化酶基因的下调表达,暗示着遮阴对萜类成分的积累可能具有明显的抑制作用。
对毛蕊花糖苷合成通路中的关键催化酶基因在遮阴后的表达变化进行分析,发现有10个基因出现显著差异表达(见表7)。其中,2个苯丙氨酸解氨酶基因PAL在遮阴后显著上调表达,5个4-香豆素-CoA连接酶基因4CL中有4个则在遮阴后下调表达。在酪氨酸途径中,有3个多酚氧化酶PPO基因,2个在遮阴后上调表达,1个下调表达。这些下调表达的关键催化酶基因可能在地黄毛蕊花糖苷的合成和积累中起着重要作用。
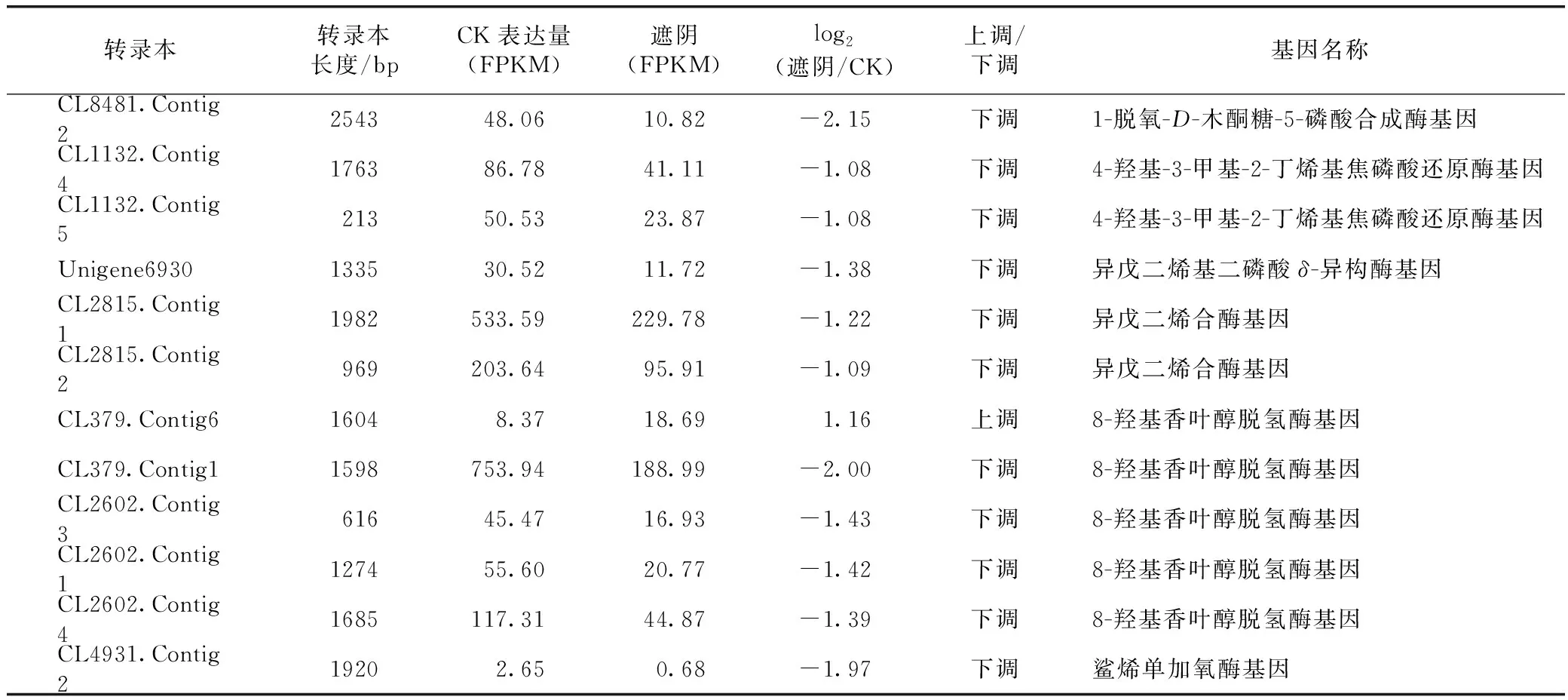
表6 通过RNA-seq分析鉴定到的参与梓醇合成的差异表达基因
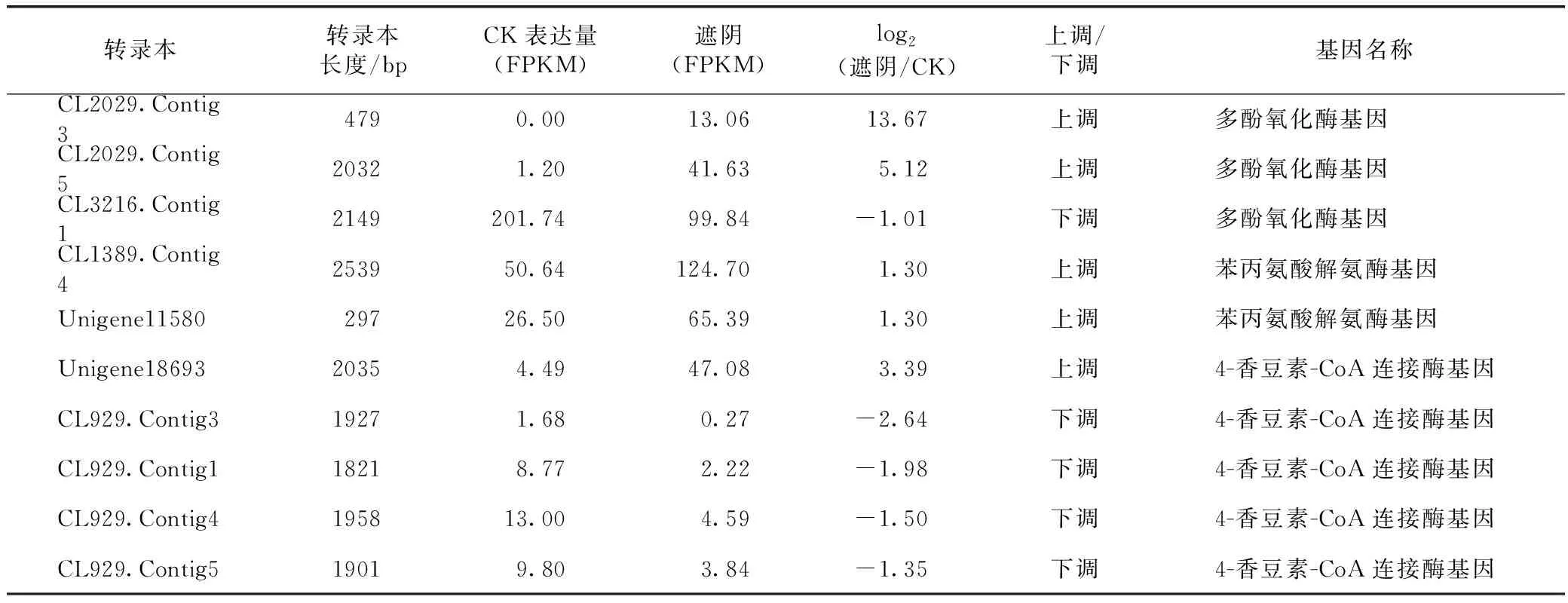
表7 通过RNA-seq分析鉴定到的参与毛蕊花糖苷合成的差异表达基因
3 讨论
光照强度主要通过光周期、光强(光密度)和光质影响药用植物的生长发育进程和活性成分合成。如:许翔鸿等[5]在延胡索栽培中发现适当遮荫可显著提高其生物碱含量;向红等[6]发现不同光照强度显著影响当归产量及阿魏酸含量。因此,在药用植物栽培生产中,需根据药用植物典型的需光特性,人为配置合适光照强度(光配方)以提高其产量和药用品质。如:典型的喜阴药用植物三七,适当遮荫是其生产中必须考虑栽培措施[7];金线莲是典型的林下阴生药用植物,生产中需要选择具有合适郁闭度的林下环境种植[8]。喜光植物具有较高的光饱和点,全生育期都需要充足的光照,若生长季节中光照不足,则会使植物生长发育受到不同程度的影响。如:光照强度不足会降低高山红景天根的生物量和红景天苷的含量[9];在曼陀罗及紫花曼陀罗植株中,随着光照强度的增强,其茎内的花色素苷、类黄酮以及总酚等次生代谢产物的积累量也会相应增加[10]。耐阴植物的光饱和点较低,在较低的光照强度下即可达到光饱和点,弱光下比强光下生长好。低光照强度有利于石斛株高和可溶性蛋白含量的增加[11]。光照强度不仅能够显著改变叶片中关键药用活性成分含量,对药用植物叶片形态、生理和解剖结构也有显著的影响[12]。如:遮阴使芍药的光合能力变差,花鲜质量降低[13];遮阴会使白三叶的光合速率降低,栅栏组织厚度变小,叶片变薄[14]。本研究发现,遮阴后地黄的叶片变薄,叶肉细胞海绵组织和栅栏组织厚度均降低,叶片数减少,叶片泡状凸起程度变弱甚至消失,说明遮阴严重影响了地黄的叶片生长和分化。但光照是如何调控地黄叶片发育及其内在药用成分合成机制目前并不清晰。
随着高通量测序技术的快速发展,遮阴对植物发育调控的分子机制研究已经受到科研人员的关注。如:在玉米中,通过转录组分析就发现,遮阴能显著影响叶片内光合作用、激素代谢相关基因的表达,其中,光合相关基因表达下调,而生长素、赤霉素代谢相关基因的表达上调,茉莉酸合成相关的基因则表达下降[15]。本研究中,在遮阴处理地黄叶内所有参与光合的基因均下调表达,说明遮阴下地黄光合能力不足可能是地黄生长不良的主要原因。同时,在遮阴地黄叶片中,与生长素信号转导密切关联的表达基因则显著上调表达,这表明在遮阴处理下地黄通过提高生长素早期应答基因AUX1、AUX/IAA、ARF、CH3的表达来应对遮阴胁迫。DELLA蛋白是赤霉素信号通路的关键调控因子,DELLA下调表达可降低植物对GA的敏感性,加速植物茎的伸长[16-17]。遮阴处理地黄体内DELLA下调表达,与地黄茎伸长增加变化趋势一致,说明遮阴后通过降低DELLA的表达降低地黄对GA的敏感性。乙烯信号通路中,乙烯受体蛋白基因ETR下调表达,而CTR1上调表达,说明地黄通过降低ETR表达,并提高CTR1表达来抑制下游的乙烯响应,以提升叶片对遮阴的适应。
叶片除了是重要的光合器官外,也是药用植物次生代谢产物产生和贮藏的重要组织或药用部位,前期的研究已经发现地黄叶片也含量有大量梓醇、毛蕊花糖苷等关键药用活性成分。因此,药用植物叶片为研究光照与药用成分互作机制提供了良好基础材料。光照强度还会影响药用植物次生代谢产物的积累。如:强光有利于喜光药用植物高山红景天景天苷的积累[9],也有利于曼陀罗茎花色素苷、类黄酮及总酚的积累[10],但不利于耐阴药用植物石斛可溶性蛋白的积累[11]。遮阴后,葡萄皮中的花色苷含量降低,参与花色苷合成的催化酶基因表达量也显著降低[18]。梓醇和毛蕊花糖苷在地黄块根和叶片中均有较高的含量,是《中华人民共和国药典》中地黄质量控制的指标性成分。本研究发现参与梓醇生物合成的绝大多数催化酶基因在遮阴后呈下调表达,尤其是催化梓醇合成最后一步反应的鲨烯单加氧酶基因SQM表达量下调,与遮阴后梓醇含量下降的变化趋势一致。本课题组前期完善了毛蕊花糖苷生物合成的代谢通路,克隆了部分催化酶基因[19-20]。这些催化酶基因中有10个在遮阴处理后出现显著差异表达,有4个4-香豆素辅酶A连接酶基因和1个多酚氧化酶基因下调表达,表明遮阴同时也影响了毛蕊花糖苷的 代谢,但这种影响作用可能更为复杂。总之,本研究初步揭示了光照可能通过生长素、乙烯等激素响应调控了叶片的耐阴适应性,同时,光照强度影响了梓醇等地黄关键药用成分关键催化酶基因的转录变化,本研究为进一步揭示地黄光照强度响应机制和药用成分合成机制提供了基础数据。
