玉米矮杆突变体A5的表型鉴定及转录组分析
2020-09-14杨睿张正杨丽莉张彦琴董春林常建忠
杨睿,张正,杨丽莉,张彦琴,董春林,常建忠
(山西农业大学 山西有机旱作农业研究院,黄土高原东部旱作节水技术国家地方联合工程实验室,有机旱作山西省重点实验室,山西 太原 030031)
0 引言
玉米(Zeamays)是我国第一大粮食作物,是重要饲料来源,也是食品加工、医疗卫生和再生能源等行业不可或缺的原材料,有较高的经济价值。玉米具有较强的耐旱、耐寒、耐贫瘠等抗逆性,是确保我国粮食稳产和增产的主力军,也是保障我国粮食安全的关键农作物之一[1]。
矮化玉米株型紧凑,通风透光、适合密植,选育矮化玉米杂交种可有效减少玉米倒伏,稳定和提高玉米产量[2]。矮杆突变体是作物育种中重要的“矮源”,研究表明导入矮杆和半矮杆基因,可大幅度提高玉米抗倒伏能力和产量[3]。1960年代的第一次“绿色革命”,就是发现并利用了矮杆基因,从而使水稻和小麦产量在世界范围内大幅度提升[4-5]。因此,筛选玉米矮杆突变体,鉴定玉米株高基因,研究玉米株高调控机制,一直是现代玉米育种和理论研究的重要内容[6]。目前已报道玉米株高基因大多为隐性基因,如brachytic1(br1)、brachytic2(br2)、dwarf-1(d1)、dwarf-2(d2)、dwarf-3(d3)和dwarf-5(d5)等[7-9],少数为显性基因,如dwarf-8(d8)、dwarf-9(d9)和dwarf-11(d11)等[10-14]。br2基因可使茎秆变粗,节间缩短,抗倒性增强;br2矮生系与多基因矮生系组配,其F1植株高度可进一步矮化。
玉米株高发育与赤霉素(Gibberellins, GAs)、生长素(Indole-3-acetic acid,IAA)和油菜素内酯(Brassinosteroids, BRs)等植物激素密切相关[15]。植物矮化现象常与赤霉素代谢能力下降或赤霉素信号通路受阻有关。赤霉素在植物生长发育等许多方面起着至关重要的作用,如种子萌发[16]、茎节伸长[17]、叶片伸展[18]和花发育[19]等。根据突变体对赤霉素的敏感程度,可将玉米矮杆突变体分为赤霉素敏感型和赤霉素钝感型。赤霉素敏感型突变体通过阻断玉米体内赤霉素的合成通路,导致赤霉素含量降低和玉米植株矮化,喷施外源赤霉素后株高可恢复正常;赤霉素钝感型突变体的赤霉素合成通路正常,但赤霉素信号转导通路受阻,喷施外源赤霉素后株高无法恢复正常。
前期我们利用甲基磺酸乙酯(EMS)诱变玉米骨干自交系PH6WC获得一个玉米矮化突变体,命名为突变体A5,并通过连续自交后纯合。本文对其进行了表型鉴定、遗传分析、赤霉素敏感性、转录组分析等。研究结果为进一步利用该矮杆材料选育抗倒伏玉米新品种提供理论依据,也为克隆玉米矮杆基因奠定基础。
1 材料与方法
1.1 试验材料
玉米突变体A5为玉米骨干自交系PH6WC经EMS诱变所得,经连续自交,已纯合一致、稳定遗传。
1.2 试验方法
1.2.1 玉米突变体A5的表型分析
于2018年5月在山西省农业科学院东阳基地种植矮杆突变体A5和自交系PH6WC。种植密度为83 000株/hm2。突变体种植行长6.7 m,行距0.6 m,株距0.27 m,每行种25穴,每穴双粒播种,田间正常管理。连续取小区内正常的植株8株,测量自交系PH6WC和突变体A5相关性状。调查的性状主要有:株高、穗位高、雄穗分枝数、雄穗长、果穗穗长、穗粗、穗行数和行粒数等,采用t检验差异显著性。
1.2.2 玉米突变体A5遗传分析
将突变体A5与自交系PH6WC(野生型)杂交获得F1代,F1代杂交种自交得到F2代,统计F2代分离群体中野生型和矮杆突变体的植株数目,采用卡方检验验证突变体的遗传规律。
1.2.3 外源赤霉素处理玉米突变体A5
试验在山西省农业科学院东阳基地进行。将突变体A5单行区种植,行长2 m,株距0.27 m,每行7穴,双粒播种,常规肥水管理措施。设置突变体A5水处理组和赤霉素(GA3)处理组(GA3浓度:20、50和100 mg/L),自交系PH6WC组(野生型组),随机区组设计,3次重复。于2018年4月25日种植,出苗后10 d开始喷施,之后每隔7 d处理1次,整个过程使处理液充分且均匀分布于植株表面。取中间5株测量株高,从苗期到抽雄完全为止,每隔7 d测定1次株高。
1.2.4 自交系PH6WC突变体A5的转录组分析
自交系PH6WC和突变体A5种植于24℃人工气候箱,相对湿度70%,光照强度5 000 Lux。待幼苗长至5~6叶期取植株茎部样本,提取总RNA,送上海派森诺生物科技股份有限公司测序。测序原始数据去接头序列和低质量序列,获得高质量序列(Clean data)。利用Bowtie2将Clean data与玉米参考基因组(Zea_mays.B73_RefGen_v4.42)进行比对,获取基因组位置信息;用RPKM值(Reads Per Kilobase per Million mapped reads)对基因表达量进行标准化;通过DESeq对自交系PH6WC和突变体A5样本中的基因表达进行差异分析,筛选阈值为Fold change>2(P-value<0.05和FDR<0.05),对差异表达基因进行GO功能注释和KEGG通路富集分析。
2 结果与分析
2.1 玉米突变体A5的表型鉴定
突变体A5植株矮小,平均株高125.14 cm,较野生型PH6WC株高显著降低37.99%(P<0.01)(图1C)。穗位高度无显著性变化。株型紧凑,茎秆直径增加,叶片密集(图1A),叶宽厚,节间数目与野生型无差异,节间长度缩短(图1D),雄穗分枝数为1~4个,雄穗长29.60 cm,穗长12.23 cm,穗粗3.57 cm,穗行数12.80行,行粒数17.90粒,穗粗、穗行数、行粒数较野生型PH6WC有显著增高,其余性状无明显差别(表1)。
2.2 玉米突变体A5的遗传分析
玉米矮杆突变体A5和自交系PH6WC杂交得到的F1表型正常。F2分离群体中一个单穗197个后代中,有42株矮化植株;另一单穗179个后代中,鉴定到40株矮化型。卡方适合性检验表明此分离比符合孟德尔遗传分离比率3∶1(表2),该矮化突变体是由隐性单基因控制。
2.3 外源赤霉素对突变体A5株高的影响
用不同浓度赤霉素(GA3)喷施玉米突变体A5,于全生育期测量玉米的株高,见表3。结果表明在未喷施GA3前(出苗后10 d),突变体A5的株高显著低于PH6WC(P<0.01)。出苗后17 d,50 mg/L GA3处理的A5株高显著高于PH6WC株高(P<0.05),20 mg/L和100 mg/L GA3处理的A5株高与野生型株高差异不明显。在出苗后25 d、32 d和38 d,100 mg/LGA3处理的A5均高于野生型(P<0.05),20 mg/L和50 mg/L GA3处理的A5高度与野生型高度差异不明显。出苗后53和60 d,野生型株高均极显著(P<0.01)高于各浓度GA3处理的A5株高。以上结果表明喷施不同浓度的GA3均可提高突变体A5的株高,总趋势为100 mg/L GA3处理组>50 mg/L GA3处理组>20 mg/L GA3处理组,但最终都未能使突变体恢复至野生型株高。

注:A:植株;B:茎秆;C:株高;D:节间;A-C (左:PH6WC;右:突变体A5);D (上:PH6WC;下:突变体A5)**P<0.01图1 矮杆突变体A5和自交系PH6WC的表型比较Note:** Indicated extremely significant height differenceNote: A: Plant; B: Stems;C: Plant height; D: Internodes;A-C (Left: PH6WC; Right: mutant A5);D (Top: wild type; Bottom: mutant);**P<0.01Fig.1 Morphological comparison ofbetween mutant A5 and PH6WC
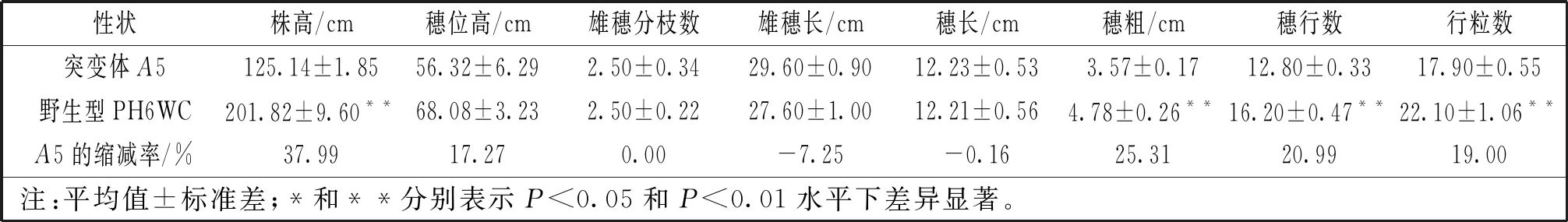
表1 矮杆突变体A5及其野生型PH6WC表型性状比较

表2 F2群体中正常植株和矮杆植株的分离比
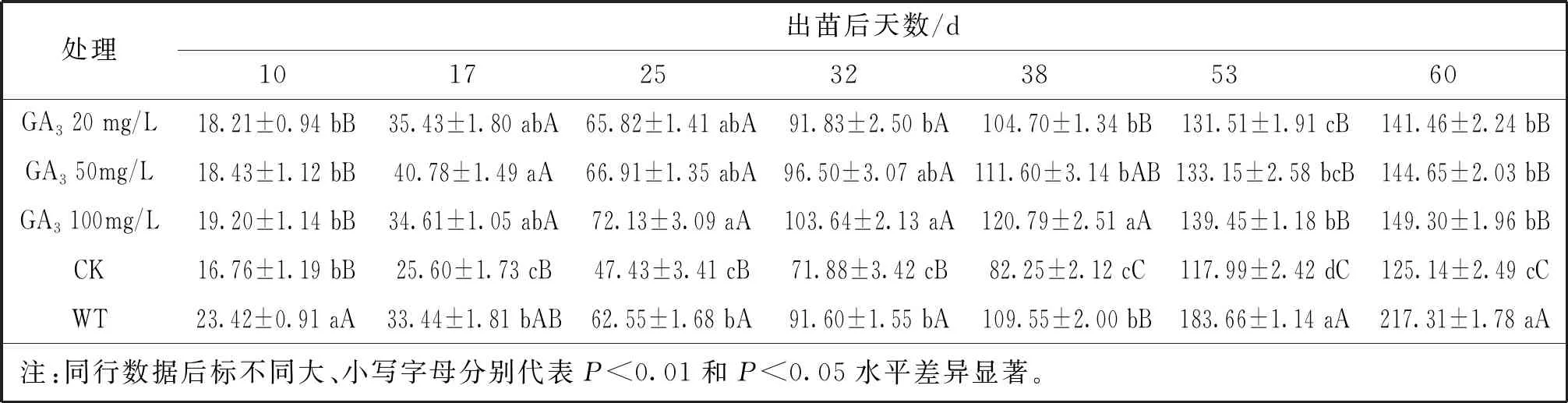
表3 GA3浓度梯度下突变体A5的株高变化
2.4 突变体A5的转录组分析
转录组分析共鉴定出2 040个差异表达基因,其中下调表达基因1 332个(4.39%),上调表达基因708个(2.33%)(图2)。差异表达基因中发现一些与株高发育相关基因,如d1(Zm00001d039634)和ga2ox(Zm00001d037565)等,还有与细胞分裂有关的基因,如tan1(Zm00001d038060)等。对差异表达基因进行GO富集分析发现共有713个差异表达基因获得功能注释,其中463个基因参与生物学过程,包括的功能条目DNA复制(GO:0006260)、细胞过程(GO:0009987)、发育进程(GO:0032502)和细胞发育过程(GO:0048869);118个基因参与细胞组分包括细胞器(GO:0043226)、微管细胞骨架(GO:0015630)和细胞外周(GO:0071944);132个基因参与分子功能包括蛋白激酶调节活性(GO:0019887)、错配DNA结合(GO:0030983)、错配修复复合体结合(GO:0032404)(图3)。
进一步采用KEGG分析(Kyoto Encyclopedia of Genes and Genomes)对玉米差异表达基因进行注释和分类,参与DNA复制、错配修复和同源重组等生理过程的23个、10个和12个关键基因获得富集,且均为上调表达(图4)。
3 讨论
株高对作物种植密度、抗倒性和光合效能有着非常重要的影响。玉米矮化突变体植株矮小、株型紧凑、抗倒伏能力强,是培育耐密植玉米杂交种的重要种质材料。然而目前生产上应用的玉米矮杆材料(基因)比较单一,不利于玉米产量和品质的进一步提升,发掘和创制新矮杆种质资源是玉米遗传育种的重要研究方向。本研究所用玉米矮杆突变体A5是经EMS诱变玉米自交系PH6WC获得玉米矮化突变体,株高较野生型显著降低了37.99%,总体表现为株型紧凑、耐密植,具有重要的研究和实际应用价值。遗传分析表明A5表型受一对隐性单基因控制,目前已报道的矮化单基因突变体中,绝大多数为隐性单基因控制[20-22],如d1、d2、d3、d5和antherear1(an1),突变体A5与它们的等位关系,需进一步分析证明。
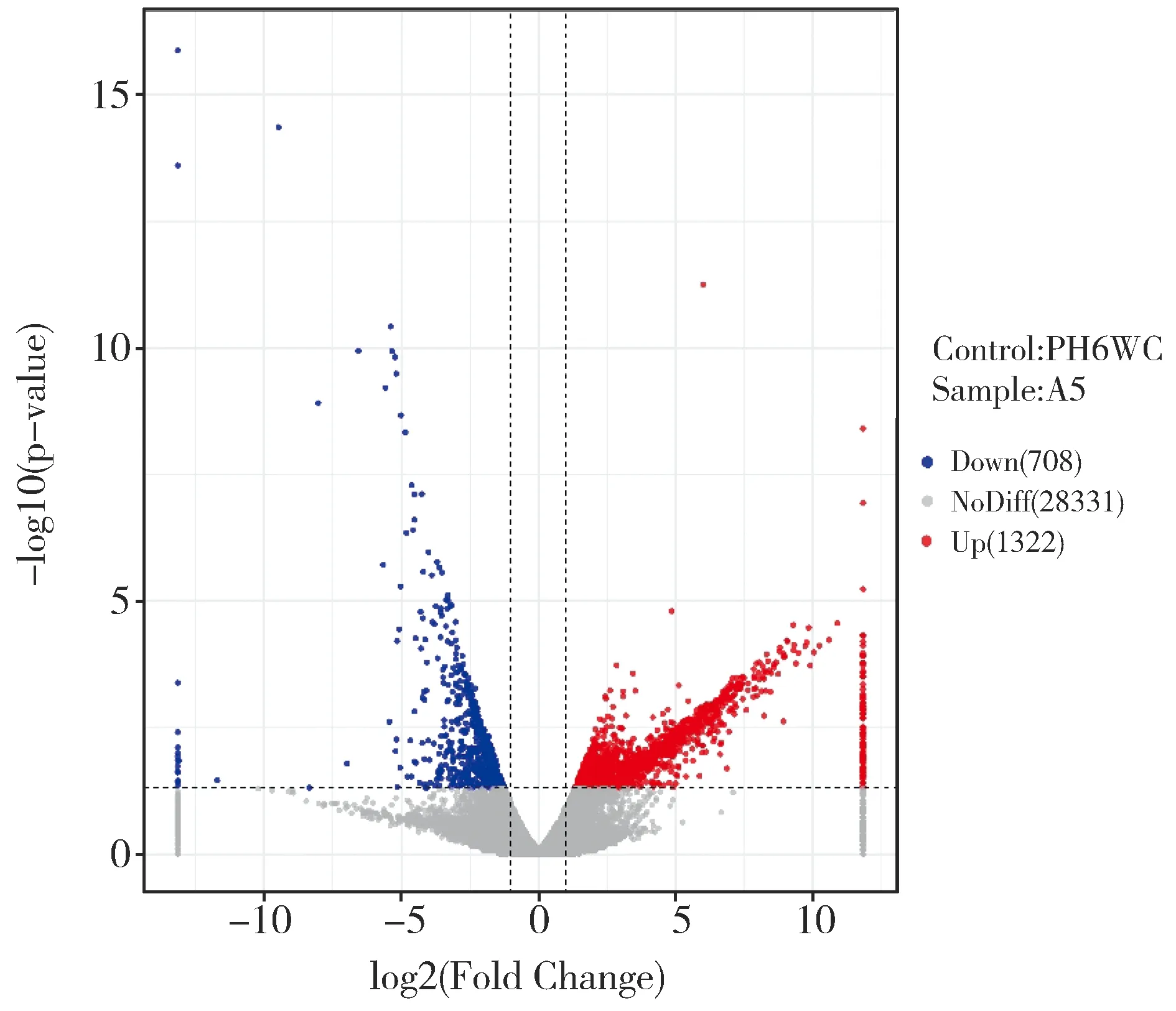
图2 自交系PH6WC和突变体A5的基因差异表达分析火山图Fig.2 Volcano plot of differential gene expression analysis between PH6WC and mutant A5
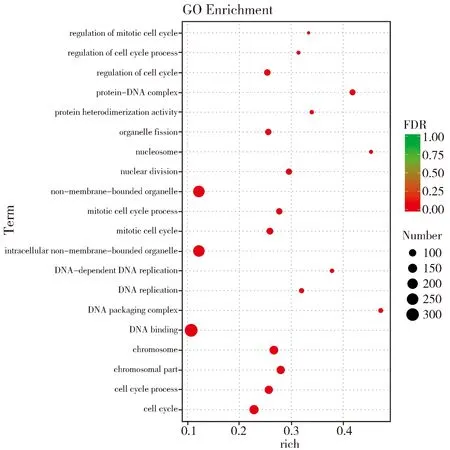
图3 差异表达基因GO分析Fig.3 GO analysis of the differentially expressed genes
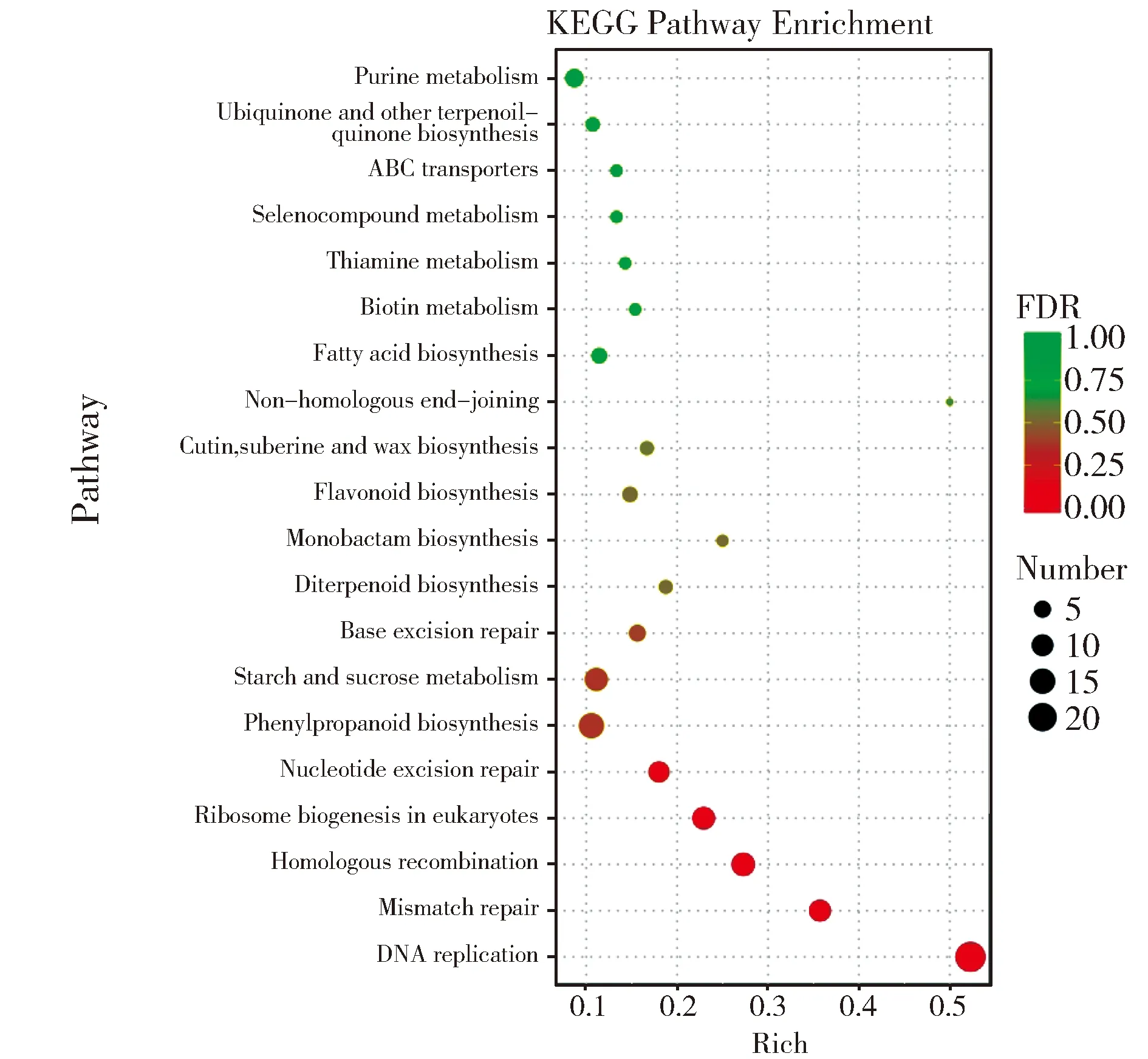
图4 差异表达基因KEGG富集分析Fig.4 KEGG enrichment analysis of differentially expressed genes
GAs作为内源激素之一,与IAA和BRs一起参与植物株高调控过程[23]。已发现玉米矮杆突变体中,D1[8]、Na1[21]、Dt[24]、D2003[25]、Dm1[26]、D8-1023[11]和D11[9]为赤霉素敏感型,外施激素后表型可恢复至野生型。本研究A5植株喷施不同浓度GA3后株高有所增加,总趋势为100 mg/L GA3处理组>50 mg/L GA3处理组>20 mg/L GA3处理组,但均未达到野生型高度。这一结果表明,突变体A5只能对外源GA3做出有限响应,因此推测该突变体的矮化表型不仅仅是赤霉素合成缺陷造成的[27]。
高通量测序技术成本低、准确性高和耗时短,已广泛用于各物种的组学分析[28]。对野生型和突变体进行转录组测序分析,有助于在全基因组水平上发掘对玉米株高有重要作用的功能基因[28],为矮杆候选基因的确定和克隆提供依据。本研究以突变体A5和野生型PH6WC于V5期(5叶期)玉米幼茎为材料,进行转录组分析。结果表明与野生型相比,A5中共2 040个差异表达基因(708个上调表达基因,1 332个下调表达基因),其中包含d1(Zm00001d039634)和ga2ox(Zm00001d037565)等赤霉素合成相关基因。矮杆基因d1编码GA3-氧化酶,催化生物活性GA合成的最后一步[20],本研究中d1的表达量在A5中比野生型显著上调2.21倍(P=0.007);ga2ox编码赤霉素2-氧化酶(Gibberellin 2-oxidase),其在A5中较对照下调表达3.18倍(P=0.01),GA2ox作用于有生物活性的GA1和GA4,通过调控GAs的水平来调节植物生长,如使植物节间缩短、矮化[29]。此外,还有与植物的细胞生长、分裂和分化有关的基因,如tan1(Zm00001d038060),Tan1是玉米细胞质分裂空间调控所必须的微管结合蛋白,是一种能直接与微管结合的高碱性蛋白质[30],其参与细胞分裂中细胞骨架结构的定向及骨架空间的排列[30- 31]。
GO富集分析表明与野生型PH6WC相比,突变体A5的差异表达基因富集在DNA复制、错配修复等关键生理过程。DNA复制是细胞分裂过程中的重要步骤,而错配修复是DNA复制过程中的重要“保真机制”,相关基因突变可影响植物株高发育。如水稻OsKu80基因在DNA双链断裂修复和端粒调控中发挥重要作用,该基因突变可导致植株矮化,花不育.[32]。对差异表达基因中的一些重要基因进行表达分析和功能鉴定将是我们未来工作的重点之一。
