染色质重塑因子Brahma调控果蝇生殖细胞发育
2020-09-14张欣李明发孟和张小民宣涛
张欣,李明发,孟和,张小民,宣涛*
(1.山西大学 生命科学学院,山西 太原 030006;2.上海交通大学 农业与生物学院,上海 200240)
0 引言
真核生物的基因表达不仅取决于基因组DNA序列本身,还在染色质结构层面上受到精确调控,这种调控即为表观遗传调控。表观遗传层面的基因表达调控在诸如细胞增殖、凋亡、命运决定与分化、干细胞及相关细胞谱系发育、组织器官的模式建成和形态发生等细胞与发育过程中的作用已日益显现,正受到广泛关注[1-4]。ATP依赖的染色质重塑因子通过利用ATP水解产生的能量可重新定位核小体,通过改变核小体的结构以及共价修饰组蛋白促进转录因子可结合到DNA区域,从而达到调控基因表达的目的[5-7]。染色质重塑因子Brahma(Brm)作为表观遗传因子被证实在多种细胞与发育过程中发挥重要功能,这些生物学过程涉及果蝇翅发育[8],肠干细胞增殖调控等[9]。我们的前期工作发现Brm染色质重塑复合物调控雌性果蝇生殖干细胞命运维持的实验证据[10]。
果蝇作为理想的模式生物被广泛地应用到发育的遗传控制研究中,其中涉及细胞增殖及分化的雌性果蝇生殖细胞发育过程在表观遗传学研究中有重要价值。雌性果蝇在成虫阶段不断产生配子,保持生殖活力与幼虫阶段性腺的正常发育密切相关。在幼虫阶段,雌性果蝇性腺包含生殖细胞和体细胞两大谱系,其中,原始生殖细胞(primordial germ cells,PGCs)是成蝇生殖干细胞的前体,在果蝇幼虫发育过程中经历了特征性的发育过程。PGC从1龄(1st instar)幼虫开始持续增殖直至3龄幼虫晚期(late 3rd instar larvae,LL3),数目从12个增殖至超过100个,在此期间,PGC分化始终处于被抑制状态,而进入幼虫向蛹转换期(larval/pupal transition),PGC开启适度、有序的细胞分化程序[11-12]。PGC的有序发育过程受到包括BMP信号通路[13]、表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路[14-15]在内的多种信号通路及特定转录调控因子[16-23]调控,而表观遗传调控在这一发育过程中的调控功能未见报道。本研究通过果蝇遗传学实验方法,发现染色质重塑因子Brm参与调控雌性果蝇幼虫原始生殖细胞有序分化过程的证据,证明表现遗传调控在此发育过程中行使重要的调控功能。
1 材料与方法
1.1 果蝇品系
果蝇品系饲养过程在温度25℃,湿度60%条件下进行。
果蝇杂交过程为挑取相应品系雌性处女蝇与相应雄性果蝇合管饲养。
果蝇品系:CantonS(CS)、w;;brm2/TM6B,Sb,Tb、w;;brmI21/TM6B,Sb,Tb、w;;brmT362/TM6B,Sb,Tb、w;;brmT485/TM6B,Sb,Tb、nos-gal4.NGT由上海交通大学李明发教授实验室馈赠,UAS-brm-RNAi(B34520)和UAS-brm-RNAi(B31712)购于BloomingtonDrosophilastock center。
1.2 抗体及荧光染料
本论文所用抗体及荧光素染料见表1。
1.3 果蝇遗传学实验方法
使用Gal4UAS二元表达系统及RNAi技术,在果蝇体内进行时空特异性下调brm表达量。需将UAS-brm-RNAi品系果蝇与Gal4品系果蝇进行杂交,后代中既包含Gal4又包含UAS-brm-RNAi的果蝇即可在组织特异性增强子驱动下下调brm表达量。本研究,观察nos-Gal4/+基因型果蝇幼虫性腺15例,nos-Gal4>brm-RNAi基因型果蝇幼虫性腺14例。
brm基因杂合突变果蝇制备。需要将其中一种基因型果蝇品系与配对另一种基因型果蝇品系进行杂交,后代中挑选brm基因杂合突变果蝇进行后续实验。本研究中观察brm2/T485基因型果蝇性腺13例,brmI21/T485基因型果蝇性腺8例,brmT362/T485基因型果蝇性腺11例。

表1 抗体和荧光素染料列表
1.4 果蝇幼虫性腺解剖
解剖的果蝇幼虫主要有3个时期,包括三龄幼虫中期(ML3)、三龄幼虫晚期(LL3)和蛹期早期(WP)。果蝇幼虫发育时间见表2。

表2 果蝇幼虫发育时间
发育至三龄幼虫中期(ML3)的幼虫仍在食物中;发育至三龄幼虫晚期(LL3)的幼虫大部分已经爬壁;WP时期果蝇蛹呈白色,处于正在成蛹或刚成蛹阶段。蛹期果蝇已成蛹。
雌性果蝇幼虫性腺位于其后1/3处,大约在第一体节处。解剖过程在PBS(pH=7.4)解剖缓冲液中进行。解剖时双手各持一支解剖镊,使用左手镊固定幼虫,使用右手镊从果蝇幼虫中间处扯开,将幼虫后半部分的组织剖出,将消化管、气管等多余器官剔除。性腺呈球形透明状,位于幼虫脂肪体中间,需仔细识别。
1.5 果蝇幼虫性腺间接免疫荧光染色
在含有PBS(pH=7.4)解剖缓冲液中解剖出幼虫或蛹期雌蝇性腺。荧光染色步骤如下:
(1)组织固定:于质量分数4%多聚甲醛中进行组织固定,固定时间为室温3 min。结束后,用含质量分数0.3% TritonX-100的PBS (PBST) 洗涤3次,每次10 min。
(2)组织预渗透:染色前组织需进行预渗透,条件为含质量分数1% TritonX-100的PBS缓冲液中室温放置1 h。
(3)组织封闭:渗透结束后,将组织移至含体积分数10%山羊血清(GS)的PBST室温下封闭2 h。
(4)一抗染色:用封闭液将一抗稀释到适当浓度,4℃孵育卵巢组织过夜。
(5)再次封闭:一抗染色结束后,用PBST洗涤3次,每次20 min,后将组织移至含体积分数10%山羊血清(GS)的PBST室温下封闭1 h。
(6)二抗染色:用封闭液稀释相对应的二抗,室温下孵育2 h,用PBST洗涤3次,每次20 min。
(7)涂片并封片后4℃避光保存。
1.6 原始生殖细胞识别
原始生殖细胞识别使用Vasa和α-Spectrin抗体染色。用Vasa抗体标记生殖细胞,用α-Spectrin抗体标记生殖细胞中的血影小体(spectrosome)。
原始生殖细胞中血影小体为圆形,而在分化的生殖细胞中血影小体形态发生改变,两细胞胞囊中血影小体为棒状,四细胞胞囊中血影小体为U型,八细胞与16细胞胞囊中血影小体呈分支状(branch)。根据血影小体形态判断生殖细胞分化程度并进行计数。
1.7 图像采集及处理
Nikon 80i荧光显微镜用于采集本研究的多色通道荧光照片。Adobe Photoshop软件用于对采集图片进行汇集和整理排版。
1.8 数学分析方法
秩和检验(MannWhitney Test)或χ2检验(χ2-test)用于本研究中对P值(P-values)的计算。当P<0.05时,差异显著;当P<0.01时,差异极显著。
2 结果与分析
2.1 brm基因在雌性果蝇性腺细胞中的表达模式分析
使用Brm特异性抗体进行免疫荧光染色,检测brm基因在果蝇幼虫性腺组织中的表达分布模式。如图1A所示,brm表达较为广泛,在PGC及卵巢体细胞谱系中均有表达,其中以体细胞表达更为显著。此外,还观察到Brm亚细胞定位于细胞核,这样的表达模式与其执行染色质重塑功能相关联。
2.2 Brm调控PGC有序分化
检测了brm的功能失活突变(loss-of-function mutations)(基因型:brm2/brmT485、brmI21/brmT485、brmT362/brmT485)对雌蝇幼虫性腺中PGC分化程序的影响,结果显示:brm基因突变显著促进三龄晚期LL3性腺组织中的PGC分化。在野生型LL3性腺组织后端,PGCs开始启动有序分化,此时免疫荧光染色可见一定比例的处于两细胞期的分化中的PGCs;而与对照组相比,处于同一发育阶段的brm纯合突变型性腺不仅含有处于两细胞期的分化中的PGCs,还可以检测到一定比例的源于PGC分化而来、细胞数目达到8的生殖系胞囊(图1C-1E中的箭头;数据统计见表3,P<0.01)。这说明,Brm对控制雌蝇幼虫期性腺中PGC的正常分化是必需的,其功能丧失可诱发PGC的过度分化。

(A) Brm的组织表达模式。抗体免疫荧光染色显示,brm基因广泛表达于LL3期性腺中的两大类型细胞生殖细胞PGC及体细胞,其中,体细胞中的表达水平更高。(B-F)在野生型LL3性腺组织中,部分PGC开启分化程序,此时可见处于两细胞期的分化中PGCs (B);而brm纯合突变显著促进LL3期PGC的分化。突变型性腺组织中可检测到一定比例的源于PGC分化而来的细胞数目达到4或者8的生殖系胞囊(C-E中箭头所指)。α-Spectrin抗体染色显示生殖细胞特有的膜性亚细胞结构Spectrosome/Fusome。依据Spectrosome/Fusome的形态及有无分叉对PGC的分化状态进行评判。PGC分化表型的外显率统计见图F。图1 染色质重塑因子Brm表达于雌蝇幼虫性腺组织并调控PGC的分化(A) Wild type LL3 gonad stained for Brm specific antibodies.Expression of brm is evident in almost all cells of gonad, predominantly in somatic cells.(B-E) control (B) and brm (C-E) mutant gonads stained for Vasa (red) andα-spectrin (green). Control LL3 gonad carries round fusome (B).brm (C-E) mutant gonads containing cysts harboring branched fusomes (C-E, arrowhead).(F) Graph showing the percentage of brm mutant gonads containing differenting cysts.Fig.1 Brm regulate PGC differentiation
2.3 Brm以细胞自治方式参与调控PGC有序分化
使用UAS/Gal4系统和RNAi技术,选择在性腺生殖细胞谱系中特异性表达的nanosGAL4(nos-GAL4),在生殖细胞谱系中下调brm表达量。采用免疫荧光染色方法,使用Vasa特异性抗体将生殖细胞标记,并使用α-spectrin特异性抗体标记血影小体,并根据血影小体形态判断生殖细胞分化程度并进行计数。
结果发现在对照组性腺中PGC所含的血影小体大部分呈球形,而仅有很少部分为U型(nos-Gal4/+,6.7%,n=15)(图2A和2A’),而生殖细胞谱系中下调brm表达的性腺中,PGC胞内均可以检测到明显的U型fusome,即出现了四细胞胞囊(4-cell germline cysts)的表型(nos-Gal4>brm-RNAi,100%,n=14)(图2B和2B’),与对照组相比差异极显著(P<0.01)。这说明,生殖细胞谱系中brm表达量下调,PGC有序分化过程都受到影响,表观遗传调控因子Brm以细胞自治性方式参与果蝇幼虫性腺PGC分化调控。
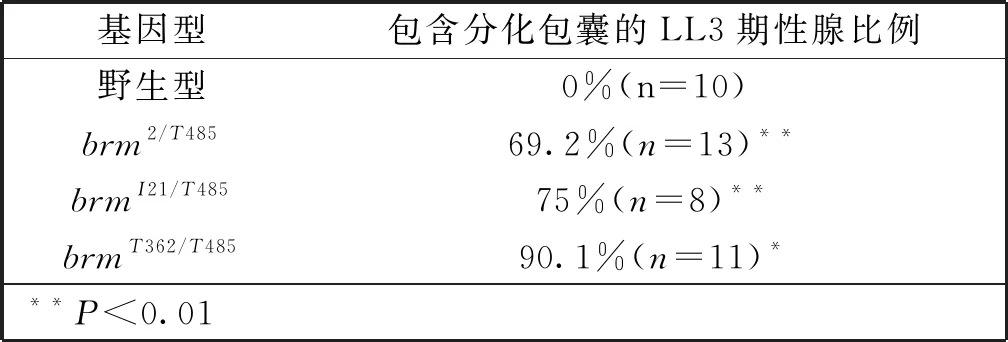
表3 Brm参与调控PGC分化

(A-B’)对照组雌性果蝇性腺(A-A’)和brm表达量下调(B-B’)的果蝇性腺,使用Vasa(红色)和α-spectrin(绿色)染色。在对照组中,PGC有序分化过程正常,Fusome均为圆点状或棒状(A-A’),而在生殖细胞谱系(B-B’)中下调brm表达量,PGC有序分化过程受到影响,出现U型或分叉状的Fusome(箭头)。图2 Brm以细胞自治方式调控PGC有序分化(A-B’) Control (A-A’) and mutant gonad expressing brm-RNAi (B-B’)under the control of specific gal4 driver stained for Vasa (red) and α-spectrin (green).Control LL3 gonad carries round fusome (A-A’). Gonads expressing brm-RNAi in germ cells (arrowhead, B-B’)result in formation of cysts harboring branched fusomesFig.2 Effect of down regulation of brm in germ cells or somatic cells on PGC differentiation
3 讨论
表观遗传学是指在不改变DNA序列的前提下,基因表达或功能的稳定的变化,这种稳定性一般是指可以在细胞分裂时遗传至子细胞。目前已知的表观遗传学变化包括非编码小RNA调控、组蛋白修饰、染色质重塑、DNA甲基化与去甲基化等。本文选择果蝇幼虫性腺生殖细胞谱系的增殖与分化发育过程,研究表观遗传调控在此发育过程中所行使的调控功能,证明染色质重塑因子Brm参与调控雌性果蝇幼虫原始生殖细胞有序分化;还通过在生殖细胞中特异性降低brm表达,证明其在生殖细胞中以自治性方式调控原始生殖细胞分化的调控模式。
Brm通常以复合物的形式参与调控器官发育,而果蝇中存在两种不同的Brm复合物,即BAP(Brm-associated protein)复合物和PBAP(polybromo-containing BAP)复合物。此两种复合物共享7个亚基,其中包括Brm、Snr1、Moiral(Mor)等,而BAP复合物特有Osa亚基,PBAP复合物包含BAP170和Ploybromo亚基[24]。Marenda等研究发现Brm以BAP复合物的形式参与调控果蝇翅发育过程中wingless信号通路下游基因的转录抑制[25]。我们之前的研究发现Brm参与调控雌性果蝇成体生殖干细胞的自我更新与有序分化过程是以PBAP复合物的形式完成的[10]。那么在雌性果蝇幼虫原始生殖细胞有序分化调控过程中,哪个复合物参与其中?这是我们接下来需要研究的课题。
已有研究报道,Brm参与调控多种信号通路活性。在果蝇翅发育过程中,wingless信号通路下游基因的转录抑制受到Brm的调控[25]。Jin等发现Brm受Hippo信号通路调控从而在肠干细胞增殖过程中发挥重要调控作用[9]。此外,而本课题组之前的研究发现,Brm通过调控JAK-STAT信号通路活性,从而参与果蝇成体干细胞的分化过程[10]。在果蝇幼虫性腺发育过程中,Brm参与调控何种信号通路活性,其转录又受到哪些信号通路的影响?这也是我们课题组未来要研究的问题。
本研究探讨表观遗传调控在果蝇器官发育过程中的调控功能,找到ATP依赖的染色质重塑因子Brm参与调控性腺发育的实验证据,为表观遗传调控参与细胞及器官发育过程提供新的证据。
