基于噻吩和8-羟基喹啉功能团设计用于pH检测的荧光探针
2020-09-14辛先荣王慧芳杨红陈志敏刘斌
辛先荣,王慧芳,杨红,陈志敏,刘斌
(1.太原工业学院 化学与化工系,山西 太原 030008;2.山西大学 分子科学研究所化学生物学与分子工程教育部重点实验室,山西 太原 030006)
0 引言
随着科学技术的快速发展,pH已成为许多领域的一个重要参数。对废水pH值[1-3]、土壤pH值[4-6]、医药药品pH值[7]、食品pH值[8]的测定在工业、农业、医药、食品安全检验等领域都具有重要意义。因此,发展快速检测和准确监测pH值的化学传感器是很有必要的。由于荧光分析技术具有灵敏度高、响应时间快、信噪比高、可连续动态监测等特点[9-11],基于此技术的pH检测荧光探针近年来得到了迅速发展。然而,目前许多pH荧光探针能够检测的pH值范围集中在2~7之间[12-16],能够用于碱性环境中引起荧光变化的探针较少[7,17]。需要关注的是,实际检测中部分样品的pH值变化范围较大,这导致目前大部分用于酸性环境响应的荧光探针无法使用,需要多种检测方法协同使用,才能达到对目标样品pH值的有效检测。因此,有必要开发能够全范围pH值检测的荧光探针。
在荧光探针中,荧光团通常是具有芳香结构的化合物[18-19],在芳香结构中引入氮、硫等杂原子,对荧光团性质的改善和荧光探针的合成具有重大作用。在含氮分子中,喹啉及其衍生物作为一类具有刚性结构和高量子产率的荧光团已经广泛被应用于荧光探针的设计中[20-26]。此外,硫原子具有丰富的电子,在芳环上引入硫原子后,硫上的孤对电子可与双键共轭,形成离域π键,一些含硫的化合物如噻吩[27]、苯并噻唑[28-30]、苯并噻二唑[31]等已经广泛应用于荧光探针中,并且表现出良好的性质。其中,噻吩基团结构简单、易于修饰,可与多种有机物进行反应,衍生出具有丰富结构的化合物。
在本研究中,噻吩和8-羟基喹啉都具有良好的光学性质。双酰肼键能够灵活调控单双键互变和交替。设计并制备的荧光探针N-[2-(喹啉-8-乙氧基)乙酰]噻吩-2-酰肼 (QATC)具有明显电子推拉结构,其中噻吩为电子给体,羟基喹啉为电子受体。在不同的pH环境下,探针分子结构中电子发生明显的转移,导致电荷分布改变,从而引起荧光光谱的变化,进而达到从酸性(pH=2)到碱性(pH=11)的检测。
1 实验部分
1.1 实验试剂与仪器
溴乙酸乙酯、水合肼、8-羟基喹啉、2-噻吩甲酰氯和色谱级乙腈购自上海安耐吉化学有限公司。金属离子都是硝酸盐,购自天津Alfa Aesar。其余有机溶剂购自北京化学试剂公司。实验所使用的水为超纯水。
核磁共振氢谱(1H NMR)和核磁共振碳谱(13C NMR)在Bruker ARX400超导核磁共振仪(Bruker biospin 公司,瑞士)上测定。高分辨率液相色谱质谱(HPLC-MS)在Thermo Scientific Q Exactive仪器(Thermo Fisher Scientific,美国)上测得。紫外吸收光谱在Hitachi 5300紫外分光光度计上测得。荧光发射光谱在Hitachi F-4600荧光分光光度计上测的激发波长为310 nm,激发缝宽度为5 nm,发射缝宽度为10 nm。使用上海雷磁PHS-3C pH计测量和调节溶液的pH值。采用密度泛函理论(DFT)(B3LYP/6-31G(d))对相关分子的几何结构和电子性质进行模拟计算。
1.2 探针的制备及其表征
化合物1和化合物2按照报道的文献[32]合成。在此基础上,目标化合物N-[2-(喹啉-8-乙氧基)乙酰]噻吩-2-酰肼 (QATC)合成如图1所示。氮气保护下,在50 mL三口瓶中加入0.26 g化合物2 (1.20 mmol),10 mL CH3CN以及0.15 g 2-噻吩甲酰氯 (1.00 mmol),在80℃下搅拌反应24 h。然后,将混合物倒入去离子水中,用二氯甲烷萃取3次。收集有机相,用饱和氯化钠溶液洗涤,然后用无水硫酸钠干燥。用旋转蒸发仪旋除溶剂,得到粗产物。粗产物通过柱层析分离,洗脱剂为甲醇/二氯甲烷(1/30,V/V),得到目标产物QATC 0.17 g,产率:52%。1H NMR (600 MHz,DMSO-d6) δ (ppm):10.49(br, 2H),8.90 (d,J=1.6 Hz,1H),8.36 (d,J=4.8 Hz,1H),7.85 (d,J=2.8 Hz,2H),7.53-7.62 (m,3H),7.30 (d,J=4.8 Hz,1H),7.19 (d,J=2.8 Hz,1H),4.93 (s,2H);13C NMR (150 MHz,DMSO-d6) δ (ppm):167.89,160.89,154.39,149.90,140.37,137.62,136.49,132.17,129.62,129.56,128.62,127.19,122.47,121.61,112.48,68.53. HR-LC-MS for C16H13N3O3S (m/z) [M+H]+:Calcd
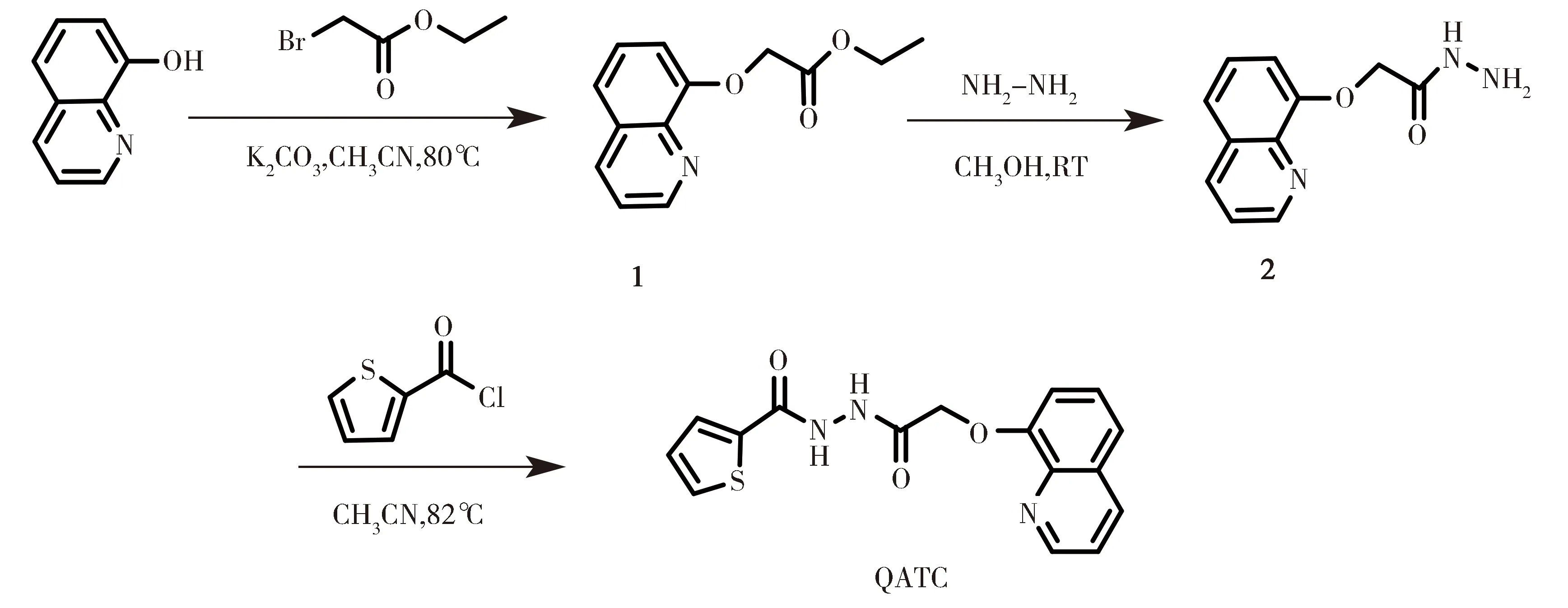
图1 探针QATC的合成路线Fig.1 Synthesis route of QATC
328.075 0,Found 328.074 9.
1.3 pH溶液和离子溶液的配制
在配制pH溶液之前,使用邻苯二甲酸氢钾(pH=4.00)和混合磷酸盐(pH=6.86)的标准溶液对pH计进行标定。不同pH的溶液通过HCl(0.1 mol/L)和NaOH(0.1 mol/L)进行调节。金属离子溶液由超纯水配制,在容量瓶中定容得到1.0×10-2mol/L的储备溶液。
1.4 紫外吸收光谱和荧光发射光谱的测量
紫外吸收光谱在Hitachi 5300紫外分光光度计上测量。荧光光谱在Hitachi F-4600荧光分光光度计上测量,激发和发射狭缝宽度分别为5 nm和10 nm。将QATC用乙腈溶解,配制1.0×10-3mol/L的储备溶液。测量时,取20 μL QATC的储备溶液加入装有2 mL溶剂的石英比色皿中,混合均匀后进行测定。在干扰性实验中,取20 μL金属离子的储备溶液加入装有2 mL PBS(1.0×10-2mol/L,pH=7.4)比色皿中,摇匀后,再加入20 μL QATC的储备溶液进行测量。所有实验均在室温下进行。
2 结果与讨论
2.1 探针QATC的光物理性质
首先,通过紫外吸收和荧光发射技术观察了QATC(1.0×10-5mol/L)在CH3CN中的光物理性质。如图2所示,化合物QATC的最大吸收峰在275 nm处,这是由分子中的π-π*跃迁和n-π*跃迁引起的。相对应的QATC的最大荧光发射峰处于386 nm,主要来自于喹啉结构单元的荧光,表明该化合物是能够发射蓝光的光学材料。进一步,通过经验公式[Eg=1 240/λabs]计算得出该化合物的能隙为4.51 eV。
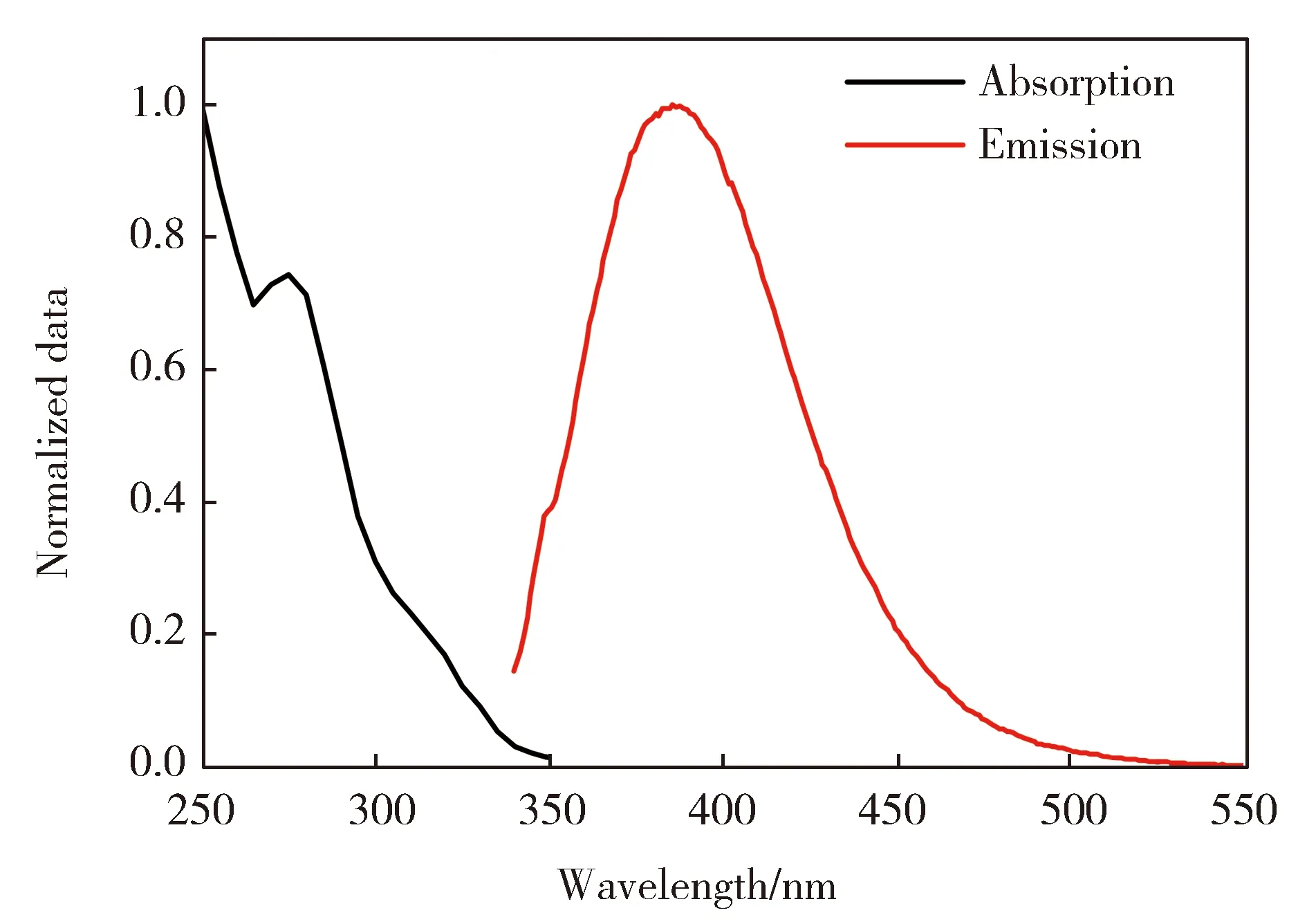
图2 探针QATC在乙腈中的紫外吸收和荧光发射光谱图Fig.2 UV-Vis absorption and fluorescence emission spectra of QATC in CH3CN
2.2 探针QATC对pH的光学响应
按照设计思想,在CH3CN/H2O=1/100(V/V)的混合溶剂中,研究了探针QATC(1.0×10-5mol/L)在不同pH下的紫外吸收光谱和荧光发射光谱(图3)。如图3(a) 所示,在酸性条件下,随着溶液的pH由7~2向酸性变化,探针QATC在355 nm处的吸收峰逐渐增强,相应探针的荧光发射光谱在475 nm处的强度也增强,如图3(b)所示。在365 nm紫外灯的照射下,可以观察到溶液的颜色由蓝色变为较为明亮的蓝绿色,且裸眼可见。然而,在碱性条件下,随着pH从7~11变化,探针QATC在300 nm处的吸收增强(图3(c)),对应地,探针在475 nm处的荧光发射峰发生蓝移且强度降低(图3(d))。在紫外灯照射下,溶液的颜色由蓝色变为暗蓝色。在pH值2~11的整个宽范围内,探针QATC的紫外吸收和荧光发射光谱以及溶液颜色都发生了明显的改变,展示了对不同pH的响应,由此可见,该探针是一个简便的广谱pH探针,可用于快速区分酸碱体系。

图3 在CH3CN/H2O=1/100(V/V)的混合溶剂中,随着pH由2~7变化,探针QATC(1.0×10-5mol/L)的紫外吸收光谱图(a); 荧光发射光谱图(b);随着pH由7~11变化,探针QATC(1.0×10-5 mol/L)的紫外吸收光谱图(c); 荧光发射光谱图(d)Fig.3 In the mixed solvent with CH3CN/H2O=1/100 (V/V),the UV-Vis absorption spectra of probe QATC (1.0×10-5 mol/L)with the pH range from 2 to 7 (a); fluorescence emission spectra (b);the UV-Vis absorption spectra of probe QATC (1.0×10-5 mol/L)with the pH range from 7 to 11 (c); fluorescence emission spectra (d)
2.3 金属离子对探针QATC检测pH的干扰性
金属离子在自然界中广泛存在,在许多pH检测领域中,金属离子的干扰性是非常严重和明显的。因此,本研究工作中研究了各种常见的金属离子对探针QATC检测pH的干扰性情况,结果如图4所示。研究工作选取pH在中性条件下,各种金属离子K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe3+、Fe2+、Hg2+、Ag+、Pb2+、Cr3+、Co2+、Ni2+、Mn2+对QATC检测pH的干扰性。结果表明,与未加入金属离子相比,大多数金属离子(1.0×10-4mol/L)的存在,对化合物QATC的荧光强度没有显著影响,仅Fe3+和Fe2+导致QATC的荧光发射强度降低了约20%。总之,探针QATC对pH的检测受金属离子的影响较小,表明其具有良好的抗干扰能力。
2.4 探针QATC对pH响应机理探索
依据不同pH下探针QATC的紫外吸收和荧光发射光谱变化情况,结合其结构特点,推测可能的作用机理如下。在酸性条件下,探针QATC会发生烯醇式结构的转变,导致整个分子的共轭程度增大。故pH从2到7的变化,QATC在355 nm处的吸收波长蓝移,同时,在475 nm处的荧光强度减弱。在碱性条件下,探针QATC分子中的联氨单元会脱质子,从而使电荷转移到O原子,分子的共轭程度也增大。因此,pH由7变为11时,QATC 在300 nm处的吸收增加,同时由于正负电荷的分离,QATC在水中的溶解度增加,分子的刚性减弱,荧光发生蓝移并减弱(图5a)。
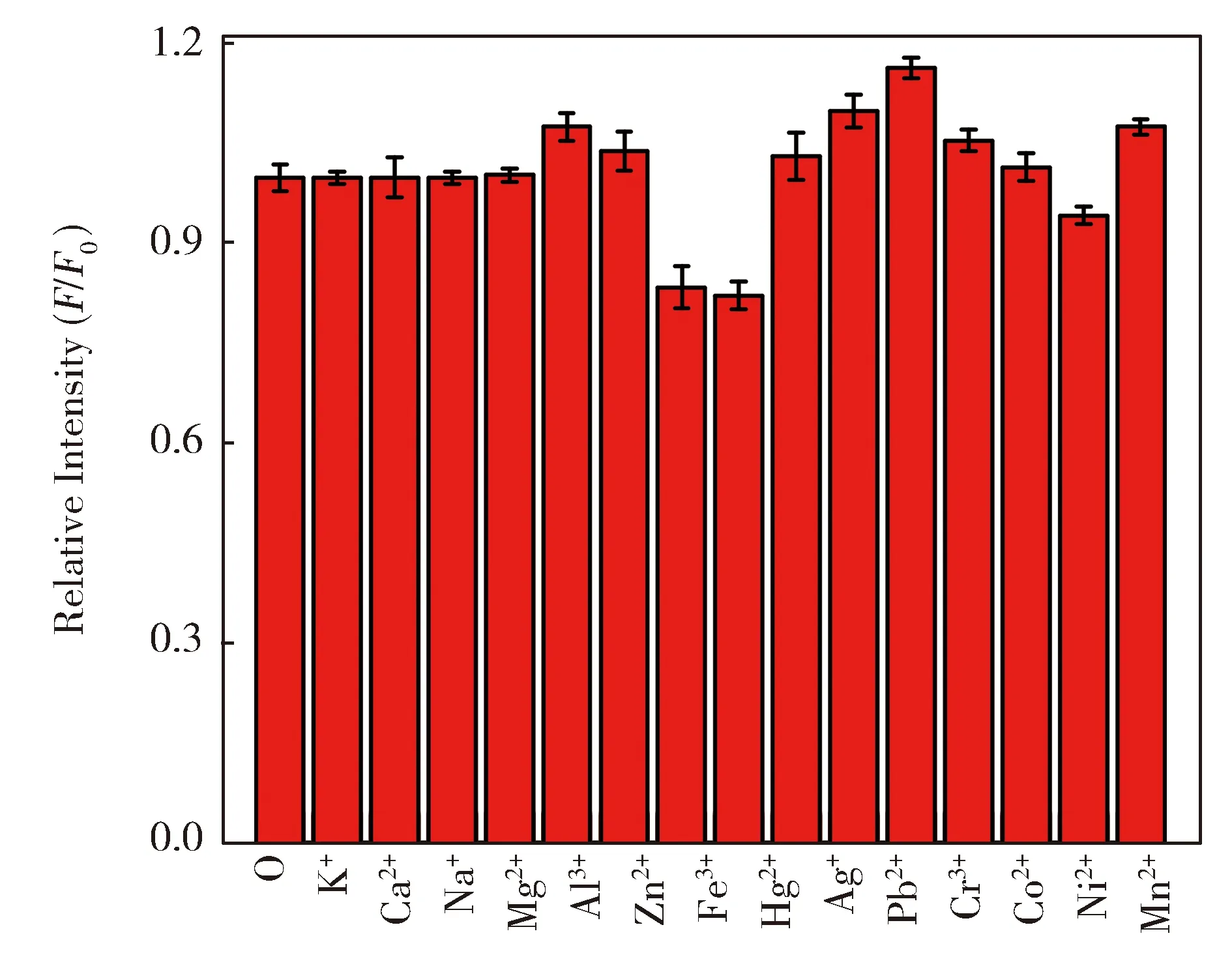
图4 探针QATC(1.0×10-5 mol/L)在CH3CN/H2O(1/100,V/V,pH=7.4)中分别加入各种金属离子(1.0×10-4 mol/L)的相对荧光强度变化图。Fig.4 Relative intensity of probe QATC(1.0×10-5 mol/L) with different metal ions (1.0×10-4mol/L) inCH3CN/H2O (1/100,V/V,pH=7.4)
为了进一步探索在不同pH介质下,探针QATC的结构变化,选择B3LYP/6-31G(d)作为基组,采用密度泛函理论(DFT)来模拟不同条件下探针QATC的结构。如图5b所示,在乙腈中QATC的LUMO电子云主要集中在喹啉单元,而HOMO电子云几乎分布在整个分子,LUMO和HOMO的能级分别为-1.40和-5.94 eV,Eg为4.54 eV。在酸性或碱性介质中,HOMO能级电子云均在喹啉上,能级分别为-2.83和2.43 eV。不同的是,酸性介质中LUMO电子云主要位于噻吩单元上,而碱性介质中LUMO电子云主要在酰肼部分,能级分别为-5.68和-6.25 eV,计算得到Eg分别为2.85和3.82 eV。依据QATC在乙腈、酸和碱中的紫外吸收和公式Eg=1240/λ计算得到QATC的实验Eg分别为4.51,3.49和4.13 eV。实验结果与理论计算结果基本吻合,表明所推测可能作用机理与实际的分子结构变化相一致。
3 结论
总之,我们设计并合成了一种能用于宽pH范围响应的荧光探针。该探针通过双酰肼键将噻吩给电子体和喹啉吸电子体连接起来。通过在不同酸碱介质中,探针分子上电子和共轭程度的变化导致光谱改变来实现对酸碱的检测。实验结果表明:在pH 2~11范围内,紫外吸收光谱和荧光发射光谱在波长和强度上都发生不同的变化,溶液的颜色也由蓝绿色变为蓝色,再变为暗蓝色。因此,该探针的开发对设计宽范围、高性能的pH荧光探针具有理论指导意义和实际开发应用参考价值。
