基于低共熔溶剂的微波辅助法提取连翘酯苷A
2020-09-14周立锦董哲张立伟杜会枝
周立锦,董哲,张立伟,杜会枝
(山西大学 分子科学研究所,山西 太原 030006)
0 引言
近年来,绿色溶剂在解决传统溶剂带来的环境问题、降低提取成本、提高产品安全性等方面具有广泛应用[1]。自2003年Abbott等[2]提出低共熔溶剂(Deep eutectic solvents,DESs)概念以来,其作为传统溶剂的替代品迅速受到广泛关注。DESs是由两种或三种不同组分以氢键作用结合得到的混合溶剂[3],包括氢键供体(Hydrogen bond donors,HBDs)和氢键受体(Hydrogen bond acceptors,HBAs),其中氢键受体多为氯化胆碱(Choline chloride, ChCl),氢键供体多为胺、酸、糖和醇等。由于合成简便、成本低、毒性低和物理化学性质的可设计性等优势,DESs已被广泛应用于有机催化[4]、电化学[5]、纳米材料[6]和生物转化[7]等领域。
近期,DESs已经被大量用于从植物中提取生物活性化合物[8]。DESs不仅可以通过氢键相互结合,还能够提供电子或接受外部电子及质子形成分子间氢键,后者可以使它们更容易溶解各类物质。最近有文献报道使用DESs对日本扁柏叶中黄酮类化合物[9]、槐米中芦丁[10]和人参中人参皂苷[11]进行提取,目标化合物均得到较高的提取效率和溶解度。Duan等通过评估5种中药材在43种DESs的提取效率,证明DESs是一种有效提取中药活性成分的绿色溶剂[12]。
连翘是山西省道地药材之一,具有抗菌、抗炎和抗氧化作用[13],主要成分包括连翘酯苷和连翘苷等[14-15],而连翘酯苷A是其中主要的有效成分之一。采用传统溶剂如水、甲醇、乙醇等从连翘中提取活性成分已有较多报道[16-19],本课题组评价了青翘60%乙醇(体积分数)提取物的抗氧化等活性[20];用不同比例甲醇水溶液等度洗脱连翘花水提物,研究了所得组分的抑制乙酰胆碱酯酶活性[21];还用体积分数为70%甲醇超声提取青翘、老翘及连翘不同部位的总苯乙醇苷含量[22]。这些方法缺点较为明显,如耗时长,成本高和溶剂污染环境等。因此需要找到一种更简单、快速和经济的方法来提取连翘。许多研究报道将DESs应用于从多种植物中提取生物活性化合物,然而,DESs对连翘的提取效率仍未可知。因此,本研究筛选了对连翘酯苷A提取效率高的DESs,优化了提取条件,并对提取液的抗炎和抗氧化等生物活性进行评估。
1 材料与方法
1.1 主要试剂与仪器
微波辅助加热提取仪:XH-100A,北京祥鹄科技发展有限公司;超声波清洗器:SK2200HP,上海科导超声仪器有限公司;高效液相色谱仪:Agilent 1260,德国;酶标仪:MD Spectra Max 190,美国Molecular devices公司;扫描电子显微镜:JEOL-JSM-6701F,日本电子公司。
1.2 制备DESs
将一定摩尔比混合的ChCl和HBD(乙二醇,1,2-丙二醇,丙三醇和1,4-丁二醇)置于圆底烧瓶中,90℃水浴加热下搅拌6~12 h,直至形成均匀、透明无色的液体,制备得到10个DESs,见表1。

表1 DESs(氢键受体为ChCl)
1.3 制备连翘提取液
将连翘在打粉机中研磨,过80目筛得到粉末,避光密封保存。将一定比例的连翘粉末和DESs混匀,在微波辅助加热提取仪中提取,滤去药渣得到连翘DESs提取液。70%甲醇提取参照药典方法[13]:70%甲醇为溶剂,液固比30 mL·g-1,超声30 min (功率250 W,频率40 kHz),用70%甲醇补重,摇匀,过滤。表2涉及的其他提取方法中,液固比25 mL·g-1,溶剂包括:100%甲醇,70%甲醇,100%乙醇和水。提取方法包括:加热回流,超声和微波辅助方法。加热回流方法:回流提取两次,每次2 h,用相应溶剂补重,摇匀,用纱布过滤,合并两次滤液。超声方法:提取功率250 W,提取频率40 kHz,提取时间30 min,用相应溶剂补重,摇匀,纱布过滤。微波方法:提取温度95℃,提取功率1 000 W,液固比25 mL·g-1,提取时间329.97 s,用相应溶剂补重,摇匀,纱布过滤。
连翘提取液经0.45 μm微孔滤膜过滤后进行HPLC分析,连翘提取液经无菌0.22 μm微孔滤膜过滤后用于细胞实验。
1.4 HPLC分析
用Agilent 1260 高效液相色谱仪进行HPLC分析。分析条件为:Agela Technologies Venusil XBP-C18色谱柱(4.6 mm×250 mm,5 μm),柱温25℃,进样量10 μL,流速0.8 mL·min-1,检测波长280 nm,以色谱甲醇为流动相A,以0.3%醋酸水溶液为流动相B;梯度洗脱条件为:0~8 min,30%~33%(A),70%~67%(B);8~24 min,33%~40%(A),67%~60%(B);24~39 min,40%~48%(A),60%~52%(B);39~55 min,48%~64%(A),52%~36%(B)。
1.5 细胞培养与分组,MTT法检测细胞活性和NO含量的检测
PC12细胞培养在含有10%胎牛血清和1%抗生素的RPMI 1640培养基中,HepG2细胞和RAW 264.7细胞培养在加入10%胎牛血清和1%抗生素的DMEM培养基中。取对数生长期细胞,配制悬液,96孔板每孔中接种100 μL(2×104个细胞)。
检测提取液抗炎实验中将RAW 264.7细胞分为对照组、模型组、提取液组、阳性药组及DESs溶剂组。对照组为正常培养的细胞;模型组用LPS(2 μg·mL-1)孵育24 h细胞;连翘DESs提取液组和连翘水提液组用120、1 200和3 000 mg·L-1的DESs提取液和相同浓度的水提液预处理细胞2 h后,再用LPS(2 μg·mL-1)孵育24 h细胞;在含3 000 mg·L-1DESs溶剂的培养基中培养的细胞为DESs溶剂组;阳性药组用Dex(1 μmol·L-1)预处理细胞2 h后,再用LPS(2 μg·mL-1)处理24 h细胞。
MTT法检测细胞毒性实验中,对照组为正常培养的细胞;DESs溶剂组使用含有不同浓度的DESs溶剂(1 200、12 000、18 000、24 000 mg·L-1)处理24 h的细胞。细胞培养液中加入MTT(终浓度为5 mg·mL-1)。4 h后,每孔中加入111 μL增溶剂(异丙醇∶1 mol·L-1HCl=24∶1, (V∶V))。560 nm处检测吸光度值。
(3)芬顿的备用处理,极好地协调了经济和运行有效性,芬顿不使用时,可充作酸化系统,将酸化与甲烷化过程分开,提高COD降解效率。
用NO试剂盒检测各组的NO含量,收集各组的细胞培养液上清,根据NO试剂盒说明书进行操作,最后在540 nm测定吸光度值,根据说明书的公式计算出相应NO的含量。
1.6 DPPH·抗氧化实验
用无水乙醇配制39.44 μg·mL-1DPPH储备溶液。将100 μL不同浓度的提取物(630、1 260、1 890、2 520、3 150、3 780和4 095 mg·L-1)和等体积的DPPH储备溶液混匀加入96孔板中,25℃避光孵育30 min。520 nm处检测吸光度值。
1.7 统计学分析
数据采用SPSS16.0软件进行统计学分析。使用ANOVA分析和t检验判定两组间的差异性,P<0.05具有统计学意义。
2 结果与讨论
2.1 筛选DESs
氢键供体的结构对DESs的物理化学性质有显著影响[23]。本文使用4种多元醇与ChCl成功制备了10个DESs,其缩写和标号列于表1。0.5 g连翘粉末和15 mL DESs(30%水,V∶V)在80℃、800 W微波辅助提取10 min,得DESs提取液。不同DESs对连翘酯苷A的提取率如图1A所示,DES-4与参考药典方法提取效果(116.68 mg·g-1)最接近,因此,选取DES-4作为后续实验中的提取溶剂。
2.2 筛选DESs中的含水量
DESs含水量决定了其黏度,是影响目标化合物提取率的关键因素之一,溶质的溶解度和提取率随着DESs黏度的降低而增加[9]。考察DES-4中含水量对连翘酯苷A提取率的影响。如图1B所示,DES-4中不含水时连翘酯苷A提取率最低,仅有98.99 mg·g-1;含水量增加至20%时,提取率达到118.28 mg·g-1,含水量继续增加时,提取率反而下降。基于此,选择20%含水量(V∶V)的DES-4作为溶剂来进行后续实验。
2.3 优化微波辅助提取条件
由于提取时间,提取温度,提取功率和液固比是影响化合物提取率的重要因素,本研究中优化了这4个提取因素。使用Design-Expert 8.0.6中Box-Behnken design(BBD,Stat-Ease,美国)优化DES-4提取条件,如表2所示,通过单因素考察得出:提取时间270~330 s,提取温度85~95℃,提取功率800~1 000 W,液固比25~35 mL·g-1。

A:不同DESs中连翘酯苷A提取率(30%水),M代表70%甲醇;B:DES-4中不同含水量对连翘酯苷A提取率的影响。数据表示为平均值±SD n=3图1 筛选DESs和含水量A:The extraction yields for forsythoside A using different DESs (30% water),M:70% Methanol;B:Effects of the different water contents in DES-4 on the extraction yields for forsythoside A.Data are represented as mean±SD n=3Fig.1 Screening of DESs and water content in DESs

表2 Box-Behnken design设计方案
经ANOVA分析(表3),对连翘酯苷A提取率建立的模型P<0.0001,失拟项(Lack of Fit)P>0.05,且R2值为0.989 6,表明模型与实验结果锲合,模型失拟项不显著,拟合程度好,模型建立较好。拟合得到二次回归方程:
Y=296.905+0.968X1-5.969X2-0.362X3+3.274X4-1.484×10-3X1X2+1.795×10-4X1X3+1.859×10-3X1X4+1.090×10-4X2X3-1.553×10-2X2X4-2.195×10-3X3X4-1.741×10-3X12+3.973×10-2X22+2.597×10-4X32-7.017×10-3X42
其中,Y为连翘酯苷A提取率,X1、X2、X3、X4分别代表提取时间、提取温度、提取功率和液固比。
表4为预测不同提取条件下连翘酯苷A提取率。由表中可见:在提取时间329.97 s,提取温度95℃,提取功率1 000 W,液固比25 mL·g-1的提取条件下,连翘酯苷A提取率最大,为139.426 mg·g-1,将这些参数确定为最优提取条件。根据实际操作原因,将提取时间确定为330 s。图2为4种因素两两相互作用对连翘酯苷A含量的响应面图,从图中可以看出,对连翘酯苷A提取率影响较大的因素为提取功率和提取温度:提取功率越大,提取温度越高,提取率越大。随着提取时间的增加,连翘酯苷A提取率先升后降;而随着液固比的逐渐增大,连翘酯苷A提取率逐渐降低。

表3 对BBD实验结果进行ANOVA结果
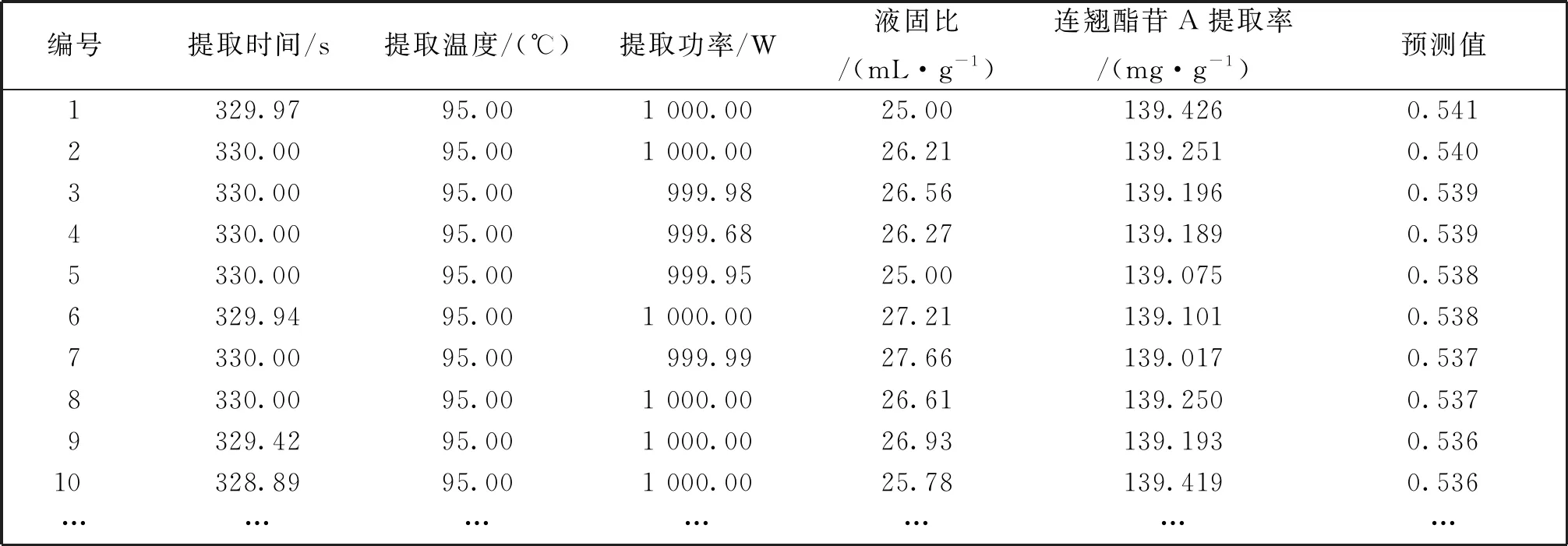
表4 预测不同提取条件下连翘酯苷A提取率
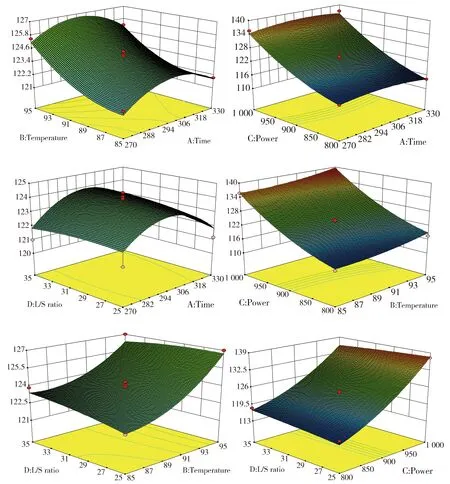
图2 连翘酯苷A提取率的3D响应面图Fig.2 3D response surface plots of the extraction yields of forsythoside A
2.4 方法学考察
进一步对优化的提取方法进行方法学考察。表5列出了标准曲线方程等信息,显示了日内、日间精密度相对标准偏差(RSD)均小于3%,表明此方法精密度良好;平行提取六次显示该方法重复性和稳定性良好。
表6为连翘酯苷A的加样回收率。在低、中、高3个浓度下样品的加样回收率均在96%以上,表明该方法适用于提取连翘中的连翘酯苷A。方法学考察证明本文建立的提取方法是有效、稳定的。
2.5 与传统提取方法比较连翘酯苷A提取率
为了评估在优化的提取条件下连翘酯苷A的提取率,本文选取常用的几种溶剂(水、70%甲醇、100%甲醇、100%乙醇)分别加热回流等方法提取连翘酯苷A,结果如表7所示,本文中优化的提取方法对连翘酯苷A提取率高于其他方法,证明了优化后的提取方法更适用于连翘酯苷A提取。

表5 HPLC测定连翘酯苷A标准曲线方程,线性范围,精密度,重复性和稳定性

表6 连翘酯苷A的加样回收率(n=3)

表7 不同提取方法中连翘酯苷A提取率 (mg·g-1)
为了探索植物细胞破裂程度与植物细胞中化合物释放率之间的相关性,通过扫描电子显微镜观察连翘提取前后的微观结构(图3,×3 000)。从图3中可以看出,提取前连翘细胞表面完整,无任何破坏痕迹;4种常见溶剂加热回流提取对连翘细胞均有一定程度损伤;DESs微波辅助提取后,连翘细胞彻底破裂并塌陷,破损程度最大。总之,连翘微观结构的破损程度与连翘酯苷A提取率呈正相关性,基于DESs微波辅助提取破坏了植物细胞壁,使更多的化合物溢出,得到了更高的提取率。
2.6 连翘DES-4提取液的抗炎和抗氧化生物活性评估
本文用PC12细胞,HepG2细胞和RAW264.7细胞对DES-4提取溶剂的细胞毒性进行评估。如图4所示,与对照组相比,溶剂组的细胞存活率没有明显变化。
LPS诱导的RAW264.7细胞是常用的体外炎症模型。图5A显示了提取液组具有减轻细胞损伤和增加细胞活力的作用,呈剂量依赖性;DESs提取液组比相应浓度的水提取液组有更好的改善作用;高浓度DESs提取液组(3000mg·L-1)与阳性药组(1 μmol·L-1Dex)作用相当。图5B表明与LPS组相比,提取液组呈剂量依赖性降低了炎症因子NO的含量;与水提液组相比,DESs提取液组展现了较好的抗炎效果;但是本文中高浓度DESs提取液组(3 000 mg·L-1)也不及阳性药组(1 μmol·L-1Dex)作用。DES-4提取溶剂本身并没有减轻细胞损伤和抗炎作用。DPPH·是一种监测含有自由基化学反应的物质,广泛用于定量测定生物试样和食品的抗氧化能力,通过DPPH·自由基清除实验对DESs提取液进行抗氧化能力分析。如图5C所示,DESs提取液的DPPH·自由基清除活性呈剂量依赖性增加,IC50值为2 370 mg·L-1,DESs提取液具有一定的抗氧化作用。

A:不同浓度的提取液改善细胞活力;B:提取液降低LPS诱导炎症模型产生的NO含量。数据表示为平均值±SEM(n=6)。C:自由基清除测试。相比于对照组,###P<0.001;相比于LPS组,***P<0.001,**P<0.01。NS为无差异图5 提取液的抗炎和抗氧化生物活性评价A:Extracts at different concentrations enhanced the cell viabilities.B:Extracts decreased LPS-induced NO contents.C:Measurement of free radical scavenging. Data are represented as means ± SEM (n=6).###P<0.001 vs. the control group, ***P<0.001 and **P<0.01 vs. LPS group. NS means no significantFig.5 Evaluation of anti-inflammatory and anti-oxidant activity of extracts
3 结论
本文对DESs微波辅助提取连翘酯苷A的提取工艺进行优化,并与传统提取方法进行比较,结果表明本方法大大缩短了提取时间,提高了提取效率;评价了连翘DES-4提取液的抗炎和抗氧化活性,结果显示连翘DES-4提取液改善了细胞活性,降低了炎性因子含量,并且具有一定的抗氧化能力,且DESs提取溶剂几乎对细胞无损伤作用。因此,本研究初步证明,DESs可用于提取连翘酯苷A。
致谢山西大学大型仪器中心贾金萍博士给予HPLC技术支持。
