分散诱导DNA-金银纳米团簇荧光增强和温度传感
2020-09-14韩鹏宇魏春英
韩鹏宇,魏春英
(山西大学 分子科学研究所,山西 太原 030006)
0 引言
贵金属纳米团簇通常包含几个到几十个金属原子,粒径大小与电子费米波长相当。这些固有的物理属性使得贵金属纳米团簇具有分裂的电子能级结构,同时赋予了贵金属纳米团簇优良的光化学性质[1-3]。以树枝状大分子[4-5],聚合物[6-8],DNA[9-12],蛋白质[13-14]以及多肽[15-16]等为模板合成的贵金属金和银纳米团簇因其荧光发射范围宽(从紫外到近红外区),生物相容性好,毒性低,斯托克斯位移大,稳定性好的特点而被广泛应用于各种重金属离子[17-19]和环境污染物的检测[20-21],生物传感[12,14,22-23]和细胞成像[8,13,16]。
双金属金/银纳米团簇(Au/Ag NCs)由于同时包含金银两种元素,其催化[24]、荧光强度[25]、离子强度耐受力[26]、检测灵敏性[27]等性质因受“协同效应”和“银效应”的影响而得到明显改善。众所周知,探针的荧光强度和稳定性等性质对检测的灵敏性和检出限有着显著的影响,因此,对改善探针荧光性质因素的研究对于提升检测灵敏性和检出限具有重要意义。以DNA为模板合成金属纳米团簇的优势在于可以通过简单改变DNA序列来实现对金属纳米团簇荧光性质的调控[10,28]。到目前,被报道的用于合成Au/Ag NCs的模板DNA是一条富含胞嘧啶(C)的12碱基DNA序列(5’-CCCTTAATCCCC-3’)[26,29-30]。此外,关于乙醇对DNA-Au/Ag NCs荧光性质的影响以及DNA-Au/Ag NCs在温度传感方面的应用也鲜有报道。
本文以C-AGRO100 DNA为模板合成了荧光双金属金银纳米团簇(C-AGRO100-Au/Ag NCs),并进一步研究了溶液中乙醇对C-AGRO100-Au/Ag NCs荧光性质的影响以及C-AGRO100-Au/Ag NCs在温度传感方面的应用。
1 实验部分
1.1 试剂与仪器
试剂(含量均为质量分数):硝酸银(AgNO3,99.8%),氯金酸(HAuCl4·3H2O, 49%基于金),硼氢化钠(NaBH4, 98%),柠檬酸(C6H8O7·H2O,99%),柠檬酸钠(Na3C6H5O7·2H2O, 98%),磷酸二氢钠(NaH2PO4·12H2O, 99%),磷酸氢二钠(Na2HPO4·2H2O, 99%),以上试剂购于上海阿拉丁生物科技有限公司;C-AGRO100 DNA,购于生工生物工程(上海)股份有限公司。
仪器:Cary 50 Bio紫外可见光谱仪(美国瓦里安公司);F-4600荧光分光光度计(日本日立高新技术公司);FL 920瞬态荧光光谱仪(英国爱丁堡仪器公司);Tecnai G2 F20 S-Twin型场发射透射电子显微镜(美国FEI公司);Nano ZS型纳米粒度仪(英国马尔文仪器有限公司);AXIS ULTRA DLD型光电子能谱仪(英国Kratos公司);Chirascan型圆二色光谱仪(英国应用物理公司)。
1.2 合成C-AGRO100-Au/Ag NCs
C-AGRO100-Au/Ag NCs通过文献报道的方法合成[26],具体步骤如下:
将C-AGRO100 DNA(100 μmol/L,50 μL)、AgNO3(1 mmol/L,30 μL)和HAuCl4(1 mmol/L,30 μL)按摩尔比1∶6∶6依次加入200 μL柠檬酸缓冲(100 mmol/L,pH 5.0)溶液中,再加入175 μL去离子水稀释到485 μL,移液枪吹打均匀后在4℃黑暗条件下孵育15 min,然后加入15 μL新鲜配制的NaBH4(1 mmol/L)溶液,剧烈震荡1 min使反应液混合均匀,在4℃黑暗条件下反应3 h完成Au3+和Ag+的还原。将所得溶液通过分子截留量为3 kDa的超滤离心管在13 500 g的条件下超滤离心40 min以纯化C-AGRO100-Au/Ag NC。产物用去离子水洗涤3次,然后分散在1 000 μL PBS(10 mmol/L,pH 5.0)溶液中,放置在4℃黑暗条件下备用。用于合成C-AGRO100-Au/Ag NCs的C-AGRO100 DNA,AgNO3,HAuCl4和NaBH4的终浓度分别为5, 30, 30, 15 μmol/L。
1.3 乙醇对C-AGRO100-Au/Ag NCs荧光性质的影响
在最优条件下合成的C-AGRO100-Au/Ag NCs经超滤离心后分别分散在含乙醇体积分数(0、10%、20%、30%、40%、50%、60%、70%、80%、100%)的PBS(10 mmol/L,pH 6.0)溶液中,在4℃黑暗条件放置2 h后测其荧光和紫外-可见吸收光谱。
1.4 C-AGRO100-Au/Ag NCs荧光强度对温度的响应
将制备好的C-AGRO100-Au/Ag NCs(10 μmol/L,2 mL)转移到石英池中并在设定的恒温下保持5 min,然后记录相应的荧光光谱。温度范围设定为5~70℃,温度梯度为5℃。将C-AGRO100-Au/Ag NCs的温度在5和70℃之间循环10次,然后记录相应的荧光光谱以研究C-AGRO100-Au/Ag NCs在5~70℃的温度检测范围内的荧光可逆性。
2 结果和讨论
2.1 C-AGRO1000-Au/Ag NCs的表征
在柠檬酸缓冲溶液中(pH 5.0)合成C-AGRO100-Au/Ag NC,然后分散在PBS (pH 5.0)中测试的紫外-可见吸收光谱如图1(A)中的a曲线所示,在大约440 nm处有一弱的吸收峰。图1(B)显示了C-AGRO100-Au/Ag NCs在不同激发波长下的荧光光谱,当激发波长为440 nm时,最大发射波长位于600 nm处。由于C-AGRO100-Au/Ag NCs的荧光性质受pH的影响,因此我们分别优化了C-AGRO100-Au/Ag NCs的合成和测试缓冲pH。结果如图2所示,C-AGRO100-Au/Ag NCs的最佳合成和测试缓冲pH均为6.0。此外,我们探究了在最佳pH条件下C-AGRO100 DNA浓度和Au3+/Ag+摩尔比对C-AGRO100-Au/Ag NCs荧光强度的影响。如图3所示,当C-AGRO100 DNA、Au3+和Ag+的浓度分别为15、30和30 μmol/L时,C-AGRO100-Au/Ag NCs的荧光最强。当DNA浓度为10 μmol/L时,荧光强度略低,本着节约的原则,在后续实验中使用的C-AGRO100 DNA浓度均为10 μmol/L。因此,用于制备具有高强度荧光C-AGRO100-Au/Ag NCs的C-AGRO100 DNA,Au3+,Ag+以及NaBH4的摩尔比为2∶6∶6∶3。

图1 (A) 不同条件下制备的C-AGRO100-Au/Ag NCs的紫外-可见吸收光谱。(a) 在pH 5.0柠檬酸缓冲溶液中制备并在pH 5.0的PBS中测量(5 μmol/L);(b) 在pH 6.0柠檬酸缓冲溶液中制备并在pH 6.0的PBS中测量(10 μmol/L)。(B) pH 5.0柠檬酸缓冲溶液中制备并分散在pH 5.0的PBS中的C-AGRO100-Au/Ag NCs(5 μmol/L)在不同激发波长下的荧光光谱Fig.1 (A) UV-visible absorption spectra of C-AGRO100-Au/Ag NCs(a) C-AGRO100-Au/Ag NCs (5 μmol/L) prepared in citrate buffer (pH 5.0) and measured in PBS (pH 5.0) and(b) C-AGRO100-Au/Ag NCs (10 μmol/L) prepared in citrate buffer (pH 6.0) and measured in PBS (pH 6.0).(B) Fluorescence spectra of C-AGRO100-Au/Ag NCs (5 μmol/L) prepared in citrate buffer (pH 5.0) and measured in PBS (pH 5.0) under different excitation wavelengths

图2 C-AGRO100-Au/Ag NCs在不同条件下的荧光光谱(A)pH 5.0柠檬酸缓冲中制备,在不同pH(5.0, 6.0, 7.0和8.0)的PBS中测量;(B)不同pH(4.0, 5.0, 6.0和6.6)柠檬酸缓冲中制备,在pH 6.0的PBS中测量Fig.2 Fluorescence spectra of C-AGRO100-Au/Ag NCs(A) prepared in pH 5.0 citrate buffer and measured in PBS with different pH (5.0, 6.0, 7.0, and 8.0);(B) prepared in citrate buffer with different pH (4.0, 5.0, 6.0, and 6.6) and measured in PBS with pH 6.0

图3 在不同条件下合成的C-AGRO100-Au/Ag NCs的荧光光谱(A)以不同浓度的C-AGRO100 DNA为模板,在30 μmol/L HAuCl4、30 μmol/L AgNO3和15 μmol/L NaBH4存在的条件下合成;(B)以不同的金银摩尔比在10 μmol/L C-AGRO100 DNA 和 15 μmol/L NaBH4存在的条件下合成Fig.3 Fluorescence spectra of the as-prepared C-AGRO100-Au/Ag NCs(A) NCs were prepared using the different concentrations of C-AGRO100 DNAin the presence of 30 μmol/L HAuCl4, 30 μmol/L AgNO3, and 15 μmol/L NaBH4,(B) NCs were prepared using the different molar ratio of Au3+:Ag+ in the presence of 10 μmol/L C-AGRO100 DNA and 15 μmol/L NaBH4
在最佳合成条件下合成的C-AGRO100-Au/Ag NC的紫外-可见吸收光谱如图1(A)中的曲线b所示,与曲线a相比,紫外-可见吸收峰的位置发生蓝移,在430 nm处出现了一个强吸收峰,但最大发射波长仍然位于600 nm(图4)。C-AGRO100-Au/Ag NCs(PBS,pH 6.0)的荧光强度随时间变化如图4所示。发现在0~1 h内,C-AGRO100-Au/Ag NCs的荧光强度逐渐增大。这可能是由于C-AGRO100-Au/Ag NCs经超滤离心后发生了聚集,随着时间延长C-AGRO100-NCs在PBS中逐渐分散,其荧光强度逐渐增强。0.5 h后,C-AGRO100-Au/Ag NCs的荧光强度趋于稳定(图4插图),表明该分散过程大约需要0.5 h。此后荧光强度在48 h内基本没有发生变化,这表明C-AGRO100-Au/Ag NCs在PBS中具有很好的稳定性。C-AGRO100-Au/Ag NCs的XPS谱如图5所示,电子结合能为84.1 eV和87.6 eV的峰分别对应于Au 4f7/2(Au(0))和Au 4f5/2(Au(I))[27];Ag的XPS谱中出现在368.7 eV和374.2 eV的峰分别归属于Ag 3d5/2(Ag(I))和Ag 3d3/2(Ag(0))[27]。结果表明合成的C-AGRO100-Au/Ag NCs同时含有金和银元素。

图4 C-AGRO100-Au/Ag NCs在黑暗条件下pH 6.0的PBS中荧光强度随时间的变化,插图是C-AGRO100-Au/Ag NCs的荧光强度在0~1 h内随时间变化的非线性曲线图Fig.4 Fluorescence intensity of the C-AGRO100-Au/Ag NCs changed with the increasing timein PBS at pH 6.0 in the dark.The inset is a plot of the fluorescence intensityof C-AGRO100-Au/Ag NCs over time in 0~1 h
2.2 溶剂中乙醇体积分数对C-AGRO100-Au/Ag NC荧光的影响
乙醇在溶剂中的体积分数用函数fe=Vethanol/V(ethanol+PBS)表示。如图6(A)所示,C-AGRO100-Au/Ag NCs的荧光强度随fe的增大而逐渐增强,当fe增加到70%时,荧光达到最强;随着fe从80%增加到100%,荧光强度开始下降。C-AGRO100-Au/Ag NCs在不同fe溶剂中的紫外-可见吸收光谱如图6(B)所示,吸收峰的位置未发生移动但强度发生了改变,特别是在fe=80%和100%溶液中吸光度明显增加,这应该归因于C-AGRO100-Au/Ag NCs发生聚集而产生的散射[31]。由于受表面配体DNA的保护,C-AGRO100-Au/Ag NCs不发生聚集并稳定地分散在PBS中[32]。PBS中大量乙醇的存在不仅改变了溶剂的极性,而且引起模板C-AGRO100 DNA的构象变化,进而影响C-AGRO100-Au/Ag NCs的聚集程度和分散性,导致C-AGRO100-Au/Ag NCs的荧光强度发生改变。

图5 C-AGRO100-Au/Ag NCs的XPS谱图。(A) Au的4f能级,(B) Ag的3d能级Fig.5 XPS spectra of Au 4f (A) and Ag 3d (B) for the C-AGRO100-Au/Ag NCs

图A中的插图显示了C-AGRO100-Au/Ag NCs荧光强度随fe的变化图6 C-AGRO100-Au/Ag NCs在乙醇体积分数不同的PBS溶剂中的(A)荧光光谱(B)紫外-可见吸收光谱Fig.6 (A) Fluorescence spectra and (B) UV-vis absorption spectra of theC-AGRO100-Au/Ag NCs in mixed solvents of ethanol and PBS with different volume fractions;The inset showed the fluorescence intensity of the C-AGRO100-Au/Ag NCs changed with the increasing fe
进一步,我们测试了在PBS,含70%乙醇的PBS以及乙醇溶剂中C-AGRO100-Au/Ag NCs的圆二色光谱(CD)。如图7所示,在PBS溶剂中,C-AGRO100-Au/Ag NCs有位于285 nm和255 nm的两个特征吸收峰,与DNA的i-motif特征峰(288 nm和255 nm[33])相近。这表明在PBS溶剂中,C-AGRO100-Au/Ag NCs的模板C-AGRO100 DNA以一种类似于i-motif的构象存在。然而,在含有70%乙醇的PBS中,位于255 nm处的峰红移至260 nm,285 nm处的吸收峰显著下降;在乙醇溶剂中,两个特征吸收峰几乎消失。显然,不同溶剂中DNA二级结构的变化导致C-AGRO100-Au/Ag NCs的聚集和分散程度改变。对于前者,C-AGRO100 DNA的构象更能有效抑制Au/Ag NCs的聚集,从而改善了C-AGRO100-Au/Ag NCs在溶剂中的分散性;而后者,C-AGRO100 DNA-Au/Ag NCs可能在乙醇中沉淀,从而导致荧光强度大幅下降。
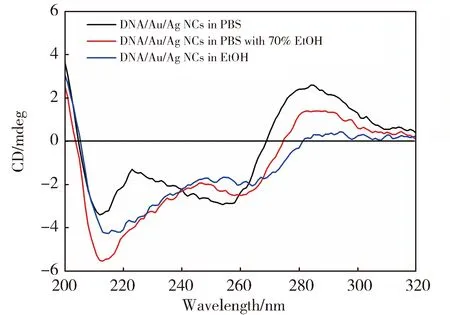
图7 C-AGRO100-Au/Ag NCs在不同溶剂中的CD谱Fig.7 CD spectra of C-AGRO100-Au/Ag NCsin the different solvents
为了进一步证实以上猜测,我们测试了C-AGRO100-Au/Ag NCs在PBS、含70%乙醇的PBS以及乙醇溶剂中的透射电镜(TEM)和动态光散射。如图8(A,B,C)所示,NCs在不含和含有70%乙醇的PBS溶剂中具有均匀的粒径分布,平均粒径分别大约是3.3 nm和2.0 nm;而在乙醇溶剂中, 观察到NCs发生明显聚集,平均粒径约为4.5 nm。C-AGRO100-Au/Ag NCs在上述3种溶剂中的动态光散射谱图更好地反映了NCs在溶液中的粒径大小,如图8(D)所示,分散在PBS,含有70%乙醇以及乙醇溶剂中的C-AGRO100-Au/Ag NCs的平均粒径为分别约为(11.7±1.4) nm、(7.5±0.4) nm和(91.3±33.3) nm。因此,我们可以得出结论,溶剂中低浓度的乙醇可以通过促进C-AGRO100-Au/Ag NCs的分散来增强其荧光发射,而当乙醇含量超过阈值(fe=70%)时,C-AGRO100-Au/Ag NC因发生聚集而使荧光猝灭。
2.3 温度对C-AGRO100-Au/Ag NC荧光的影响
制备的C-AGRO100-Au/Ag NCs表现出显著的荧光温度依赖性特点。如图9(A)所示,在5~70℃的温度范围内,C-AGRO100-Au/Ag NCs的荧光强度随温度升高而逐渐降低,并且分别在5~30℃和30~70℃温度范围内荧光强度(F)和温度(T)之间存在良好的线性关系(图9(B)),线性拟合方程分别为F=1630.38-26.52T(R2=0.992)和F=1224.18-11.98T(R2=0.993)。此外,C-AGRO100-Au/Ag NCs的荧光强度在5℃和70℃之间连续循环10次后没有发生明显的变化(图9(C)),这表明C-AGRO100-Au/Ag NCs的荧光在5~70℃温度响应区间具有良好的可逆性。

图8 C-AGRO100-Au/Ag NC在不同溶剂中的透射电镜图(A)PBS,(B)含有70%乙醇的PBS,和(C)乙醇溶剂,(D)C-AGRO100-Au/Ag NC在三种不同溶剂中的动态光散射谱图Fig.8 TEM images of C-AGRO100-Au/Ag NC in PBS (A) andwith 70% ethanol (B) and ethanol (C), and their dynamic light scattering spectra in the three solvents (D)

图9 (A)C-AGRO100-Au/Ag NCs在5~70℃温度区间的温度依赖性荧光光谱;(B)发射波长在600 nm的荧光强度与温度的线性关系图;(C)C-AGRO100-Au/Ag NCs 在5℃和70℃之间循环10次的荧光响应Fig.9 (A) Temperature-dependent fluorescence spectra of C-AGRO100-Au/Ag NCs in the range from 5℃ to 70℃;(B) The corresponding linear calibration curve at 600 nm;(C) The fluorescence responses of C-AGRO100-Au/Ag NCs upon cycling between 5℃ and 70℃ for ten cycles
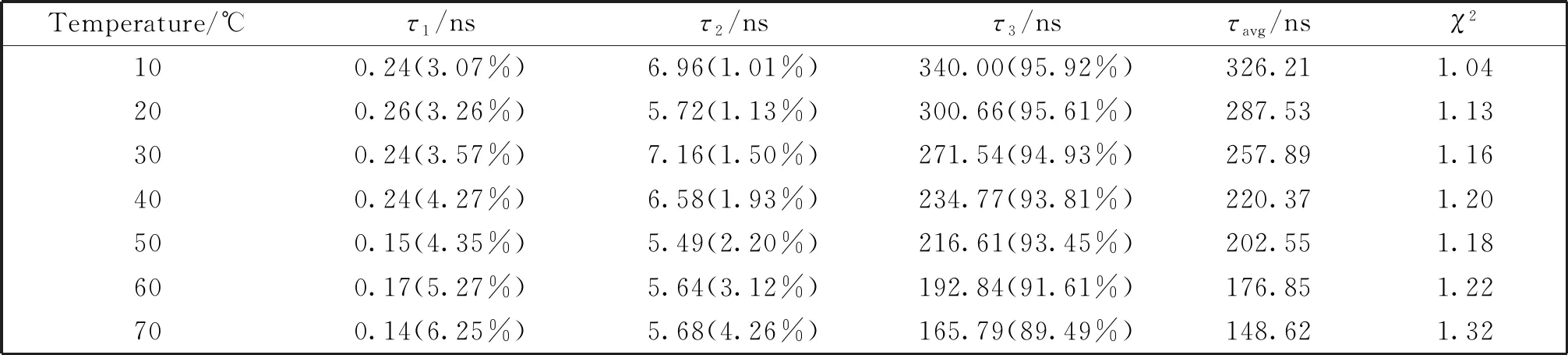
表1 C-AGRO100-Au/Ag NCs在不同温度下的荧光寿命
升温诱导荧光猝灭的机理归因于高温下非辐射衰减的增强。具体而言,温度升高导致分子碰撞频率和其他非辐射能量转移速率增加,而产生荧光的辐射能量转移速率保持不变,这导致C-AGRO100-Au/Ag NCs荧光猝灭[34]。为了验证该假设,分别测量了C-AGRO100-Au/Ag NCs在不同温度下的荧光寿命。CAGRO100-Au/Ag NCs在不同温度下的平均荧光寿命列于表1,荧光衰减曲线如图10所示。C-AGRO100-Au/Ag NCs的平均荧光寿命从326.21 ns(10℃)下降到的148.62 ns(70℃),表明高温加速了C-AGRO100-Au/Ag NCs的荧光衰减[35]。当然,温度升高也会导致模板DNA构象发生变化,从而导致荧光强度的改变。
激发波长为405 nm,发射波长为600 nm图10 C-AGRO100-Au/Ag NCs在不同温度下的荧光衰减曲线Fig.10 Fluorescence decay curves of C-AGRO100-Au/Ag NCs at different temperatures.The excitation wavelength was 405 nm and emission wavelength was 600 nm
3 结论
本文以一条富含胞嘧啶(C)的C-AGRO100 DNA序列为模板成功制备了一种稳定的具有橙色荧光发射的双金属金/银纳米团簇(C-AGRO100-Au/Ag NC)。适量的乙醇可以改善所制备的C-AGRO100-Au/Ag NCs在PBS溶剂中的分散性从而增强其荧光发射。C-AGRO100-Au/Ag NCs的荧光信号分别在5~30℃和30~70℃的温度区间对温度表现出良好的线性响应,并且在5~70℃的温度测量区间具有良好的可逆性,为C-AGRO100-Au/Ag NCs作为荧光纳米温度计在温度测量方面的应用提供了潜在的可能性。
