石膏中二氧化硅的测定
2020-09-13李静静李筠乐
顿 磊 李静静 李筠乐 顾 蕾
1 河南省科学院质量检验与分析测试研究中心(450002) 2 郑州科技学院(450064)
0 前言
目前在建筑行业对于石膏的利用越来越普遍。在使用一种新型石膏时要对其进行相关的化学检测,包括一些重大比对试验,如全国化学分析大对比、标准样品定值等。在石膏样品化学分析检测中,一般会选择GB/T 5484—2012《石膏化学分析方法》中氟硅酸钾容量法完成二氧化硅的测定。该方法与传统的容量法不同,是采用单独称样方式,以KOH为熔剂、镍坩埚为熔器制备的溶液测定石膏中的二氧化硅。 之所以称取的试样全部用来测定二氧化硅,主要是基于它在石膏中的含量较低,为提高准确度减少误差,避免带入钠离子的干扰。 因为石膏中二氧化硅含量较低,分析检测中常被忽略,所以在重大比对试验时的合格率还有待提高。如参照铝酸盐水泥中硅的测定方法: 加入大体积的乙醇溶液,使用甲基红及酚酞指示剂使滴定终点判定更为准确。文章中对该检测方法的重点环节作了深入地探讨[1]。
1 二氧化硅测定方法的步骤
称取约0.3 g 试样 (m16),精确至0.0001 g,置于50 mL 镍坩埚中,加入4~5 g 氢氧化钾,盖上坩埚盖并留有缝隙。 在600 ℃~700 ℃的马弗炉中熔融20~30 min 取下冷却,用温水(约 20 mL 体积水)将熔块提取到塑料杯中,加入20 mL 浓硝酸,用硝酸及温水洗净坩埚和坩埚盖, 冷却至26 ℃以下。 加10 mL 氟化钾溶液 (150 g/L), 保持杯中溶液体积70~80 mL,根据室温加入适量研细的氯化钾,仔细搅拌5 min 至氯化钾充分饱和,并有少量氯化钾(约2 g)析出,在 26 ℃以下放置 15 min,期间搅拌 1~2次。 用中速滤纸过滤,先过滤清液,然后用氯化钾溶液(50 g/L)洗涤塑料杯及沉淀3 次,使固体氯化钾溶解,洗涤液总量不超过25 mL。将滤纸连同沉淀一起取出,置于原塑料杯中,沿杯壁加入20~30 mL 氯化钾、乙醇溶液(50 g/L)及2 滴甲基红指示剂溶液(2 g/L),用氢氧化钠标准滴定溶液中和至溶液由红刚刚变黄。向杯中加入约200 mL 已中和至使酚酞指示剂微红的沸水及1 mL 酚酞指示剂溶液(10 g/L),用氢氧化钠标准滴定溶液(0.15 mol/L)滴定到溶液由红变黄,再至微红色(V11)。
2 二氧化硅测定方法基本的原理
氟硅酸钾容量法测定二氧化硅的原理是硅酸在有过量氟离子和钾离子的酸性溶液中能生成氟硅酸钾沉淀:
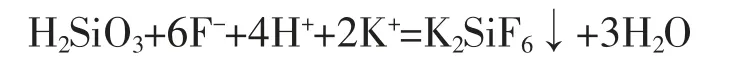
把过量的钾离子和氟离子大部分洗掉,中和完残余的氢离子后, 氟硅酸在水中溶解生成进而水解生成氢氟酸:
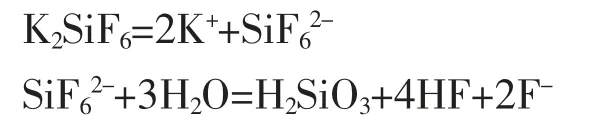
根据氢氧化钠标准滴定溶液滴定生成的氢氟酸,可计算出二氧化硅的含量。
HF+NaOH=NaF+H2O
准确测定二氧化硅的前提首先应使试液中的硅酸全部生成氟硅酸钾沉淀,其次在沉淀的洗涤过程和中和残余酸的过程中,控制沉淀完全不溶解和水解。
3 中和残余酸和滴定水解时的滴定曲线及指示剂的选择
容量法测定二氧化硅的两个决定性环节是中和残余酸及氟硅酸钾沉淀的水解。 可以把这两个过程用图表呈现出来(如图1、图2 所示)。
由图1、图2 中的滴定曲线可以看出:两条滴定曲线是有显著差异的。 中和残余酸时,曲线的突跃范围为pH5~pH9,等当点为pH7,属强碱滴定强酸型。 滴定水解HF 时,曲线突跃范围很不明显,等当点约为pH7.5,属强碱滴定弱酸型。
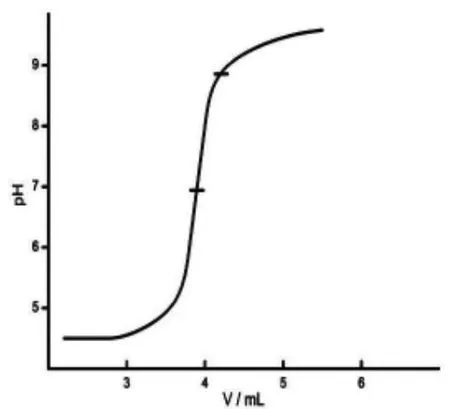
图1 中和残余酸滴定曲线
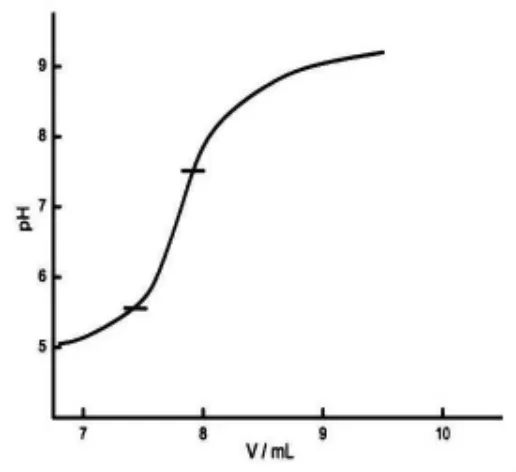
图2 滴定水解HF 滴定曲线
在铝酸盐水泥检测方法中采用的两种指示剂变色点pH 值见表1。
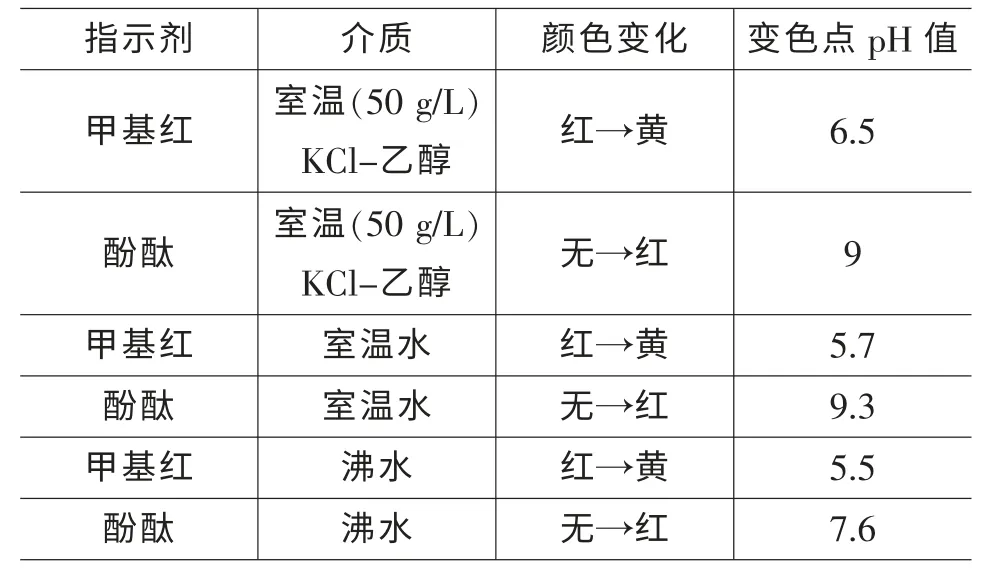
表1 两种指示剂的变色点pH 值
根据表1 各指示剂变色点数据,可以很好地理解选择甲基红作滴定残余酸的指示剂,选择酚酞作滴定水解HF 的指示剂的原因了。 中和残余酸的过程实际上是用氢氧化钠标准溶液滴定少量与氟离子共存的硝酸。 其等当点为强碱滴定氢氟酸的等当点,与共存氟离子的浓度有关。 在中和完残余酸的沉淀中,加入沸水,沉淀会完全溶解,并水解产生氢氟酸,因此,此时的滴定仍然是强碱对氢氟酸的滴定。 但其等当点不同于对单纯氢氟酸的滴定,因为此时氢离子的浓度不仅受氢氟酸解离常数的限制,而且还要受水解常数的影响。 总的解离常数为水解常数与氢氟酸解离常数之积, 即此时的滴定体系等价于强碱对一种较HF 弱的酸的滴定,因而其滴定曲线突跃减小,等当点pH 增高。 因此中和残余酸和滴定水解生成的HF, 虽然都是用氢氧化钠滴定氢氟酸,但由于滴定体系中共存物质的不同及介质与介质温度的不同,其滴定曲线及等当点是不同的,指示其终点的最佳指示剂也不尽相同[2]。
在一定酸度下,增加钾离子的浓度和适量增加氟离子的浓度有利于氟硅酸钾沉淀的完全生成。 在对沉淀的洗涤过程中,由于氟离子浓度降低,沉淀的水解和溶解是不可避免的。 水解平衡时,沉淀的水解量可达到21%,因而缩短洗涤时间,使水解反应来不及进行,是减小沉淀水解的有效方法。 在中和残余酸的过程中, 由于氢离子浓度的减小,使水解的速度更快,也是中和液中加入相比传统的容量法更多的氯化钾、乙醇溶液(20~30 mL)的原因和目的。
可以以下从三个方面抑制沉淀的溶解:①乙醇溶液可以降低氟硅酸钾沉淀的溶解度;②乙醇溶液能使有效水浓度降低,随而使的水解常数减小;③乙醇溶液能降低水解速度,使得氟硅酸钾沉淀在乙醇溶液中既能逐渐水解, 但速度又比在水中慢得多。
4 结果计算
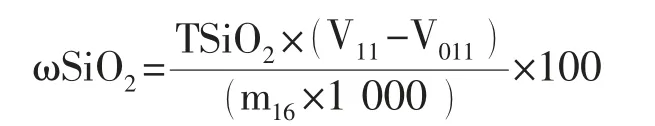
式中:ωSiO2——二氧化硅的质量分数,%;TSiO2——氢氧化钠标准滴定溶液对二氧化硅的定度,单位为毫克每毫升(mg/mL);V11——滴定时消耗氢氧化钠标准溶液的体积,单位为毫升(mL);m16——试料的质量,单位为克(g)。
在掌握了具体操作步骤后,如何使石膏中二氧化硅检测结果更准将是文章讨论的重点。 使用氟硅酸钾容量法测定二氧化硅的检测人员一定要注意以下测定中的关键步骤,严格控制好室温,室温超过26 ℃时就会出现检测结果不稳定的情况。
5 氟硅酸钾容量法测定结果偏高的原因
1)过滤时直接将固体KCl 颗粒倒入漏斗中,KCl颗粒中包裹着少量残余酸,易使结果偏高并且不稳定。 中和残余酸时必须将滤纸展开,不断挤压搅拌,捣成滤纸浆状。 中和到最后时用塑料搅棒和滤纸将塑料烧杯杯口和杯壁擦拭干净后再中和至微红色。如果中和残余酸不完全则结果偏高。
2)一般K2SiF6容量法的空白值不应超过浓度为0.15 mol/L 的 NaOH 标准溶液 0.1 mL。 如果超过0.1 mL 应检查其原因,设法减小或消除空白。 不进行空白试验和结果没扣除空白值均易导致结果偏高。
3)溶液的酸度应保持在3 mol/L 左右(50 mL试验溶液中的浓硝酸应为15 mL),酸度过低易形成其他金属的氟化物沉淀(K3AlF6)干扰测定,导致SiO2结果偏高。 酸度过高会给其后的沉淀洗涤与中和残余酸的操作带来难度, 使洗涤过程中部分K2SiF6沉淀水解,导致SiO2结果偏低。
4)试验中要用塑料量杯和塑料漏斗,否则会因玻璃腐蚀将杂质带入空白样中。
5)氟硅酸钾沉淀反应是一个放热反应过程,所以要尽量冷却使其沉淀完全。 放置时间从氯化钾加入后至真正饱和时起15 min 为宜。 若放置时间过长,Al3+会产生干扰。
6)NaOH 标准溶液的浓度偏高。

6 氟硅酸钾容量法测定结果偏低的原因
1)加入固体KCl 时,将KCl 颗粒研细再加入,以便溶解。 一定要不断地仔细搅拌直至不再溶解为止。 KCl 的溶解度随温度变化较大。 往溶液中加入浓硝酸后,溶液温度升高。 应先冷却至26 ℃以下,再加入KCl 至真正饱和。
2)中和残余酸时要特别注意快速、准确,以防K2SiF6提前水解。
3)K2SiF6沉淀时的温度以不超过26 ℃为宜,否则会因温度过高K2SiF6沉淀不完全。 夏季房间若无空调降温设备,建议沉淀放置时将塑料烧杯放置在冷水中冷却,否则会使检测结果严重偏低。
4)石膏及石灰石等二氧化硅含量较低的样品,K2SiF6沉淀放置时间在15 min 较为适宜,但不能低于15 min。 否则K2SiF6沉淀不完全。
5)NaOH 标准溶液的浓度偏低。
7 结语
通过大量比对试验,选择了大体积的乙醇溶液及甲基红、 酚酞指示剂与石膏标准中的不同之处,主要基于如下考虑:采用较大的氯化钾、乙醇中和液体积,提高了中和残余酸终点时中和液中乙醇的有效浓度,从而减小了沉淀的溶解与水解;采用甲基红为指示中和残余酸滴定终点的指示剂,使终点与等当点更相近。 同时, 终点pH 小于等当点的pH值,有利于减小氟硅酸钾对滴定终点的影响,使终点变色更敏锐;在滴定氢氟酸的过程中,由于甲基红的存在,可以预指示终点的到达,使分析者观察终点时精力集中,有利于减小滴定误差。
由于K2SiF6沉淀的水解反应为吸热反应,水解时水的温度越高体积越大,越有利于水解反应进行。故实际操作中应用沸水并使总体积保持在200 mL以上。 水解反应并不是在加沸水之后就立即完成,而是随着NaOH 标准滴定溶液的加入,K2SiF6不断水解,直至达到滴定终点时水解反应才趋于完全。因此,应保证溶液的终点温度不低于70 ℃为宜。
