丁苯酞对阿尔茨海默病模型大鼠海马CA1 区Wnt3a及β-连环蛋白表达的影响
2020-09-13邓春颖李海滨毛文静李世英刘斌
邓春颖,李海滨,毛文静,李世英,刘斌
作者单位:1华北理工大学附属医院神经内科,河北 唐山063000;2遵化市人民医院心内科,河北 遵化064200
阿尔茨海默病(Alzheimer disease,AD)目前被认为是导致老年痴呆的主要原因,其发病率不断上升,不仅严重影响病人的生活质量,对社会经济亦造成不良影响。目前关于该病发病机制尚不明确[1],亦没有特效治疗方法及药物。丁苯酞(dl-3-nbutylphthalidle)是从芹菜籽中提取出来的小分子物质,是我国自主研发的治疗缺血性脑血管病的新药。丁苯酞通过拮抗炎症反应、抑制神经元凋亡等起到保护脑细胞作用[2]。而体内细胞增殖、分化、凋亡等多种程序受Wnt 信号通路控制[3]。研究表明,异常磷酸化的β-连环蛋白(β-catenin)在Wnt信号通路未启动时明显升高,导致β淀粉样蛋白(Aβ)对脑神经元毒性作用加大,而Aβ 大量沉积即可诱发AD[4-5]。Wnt 通路发挥抗凋亡作用的主要效应因子是 β-catenin[6]。而 Wnt3a 是 Wnt 信号通路的启动因子,观察其浓度变化,可了解Wnt 信号通路激活情况。本研究于2017 年12 月至2018 年12 月通过观察丁苯酞对Wnt3a 和β-catenin 蛋白表达的影响,为AD治疗寻找一个新靶点。
1 材料与方法
1.1实验动物2~3 月龄健康清洁级雄性SD 大鼠72 只,体质量范围为250~280 g,实验动物购于北京华阜康生物科技有限公司提供,生产许可证号SCXK[京]2014-0010。将实验动物自由进食喂养于华北理工大学屏障环境动物实验室,室温控制在24~26 ℃,相对湿度45%~55%,12 h 明暗交替光照,实验前适应喂养1周
1.2药物与试剂丁苯酞软胶囊(购于石药集团恩必普药业有限公司,国药准字H20050299,批号121101,规格0.1 克/粒);兔抗大鼠Wnt3a 多克隆抗体、兔抗大鼠β-catenin 多克隆抗体(均购于北京博奥森生物公司);兔二步法免疫组织化学试剂盒、DAB显色液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)低分子质量标准蛋白(均购于北京中杉生物有限公司)。
1.3主要仪器德国LEICA 公司的石蜡组织切片机;日本HITACHI 公司的透射电子镜;安徽淮北正华生物仪器设备有限公司的脑立体定位仪;淮北正华生物仪器设备有限公司的Morris 水迷宫;张家港市航天医疗电器有限公司的电凝仪。
1.4方法
1.4.1 动物分组 采用随机数字表法将实验大鼠分为假手术组(Sham 组)、AD 模型组(AD 组)、丁苯酞治疗组(丁苯酞组),造模成功后,在各组内采用随机数字表法分为造模后1、2、4和8周4个亚组。
1.4.2 模型制备 提前制备浓度为1 μg/μL的β-淀粉样蛋白1-42(beta-amyloid people 1-42,Aβ1-42)溶液,并制成凝聚状态。采用Morris水迷宫筛选大鼠,保留合格实验动物。采用腹腔注射方式麻醉大鼠(10%水合氯醛,350 mg/kg),麻醉后将大鼠固定于脑立体定位仪上,选择双侧海马CA1 区为注射区,以前囟为基准点,向后4.5 mm,中线旁开2 mm 处,开颅,暴露大鼠硬脑膜,将微量注射器与脑表面垂直,缓慢进针,深度2 mm,AD 组及丁苯酞组均缓慢注入5 μL 提前制备好的Aβ 溶液,留针10 min 后撤出针头,用骨蜡封闭骨质创口,缝合并消毒切口。Sham组注射5 μL 0.9%氯化钠溶液。
1.4.3 给药方法 造模4周时进行Morris 水迷宫实验检测各组大鼠学习记忆能力,造模前后比较差异有统计学意义视为模型成功。丁苯酞组给予丁苯酞混合溶液(丁苯酞与食用油混合,浓度8 mg/mL,剂量1 mL/100 g)进行灌胃,每日2次;Sham组、AD组给予同等剂量的食用油灌胃,每日2次,连续给药1、2、4、8周。
1.4.4 免疫组织化学检测 将大鼠喂养至各个时相点,腹腔注射麻醉(10%水合氯醛,350 mg/kg)大鼠,麻醉后暴露心脏,由心尖插入灌注针并固定至升主动脉处,剪开右心耳快速灌注0.9%氯化钠溶液,冲洗血管内血渍,至肝脏变白后,用4%多聚甲醛滴注至大鼠僵硬后,断头取脑,分离脑组织,脑组织浸泡于4%多聚甲醛-磷酸缓冲盐溶液(PBS)固定过夜,次日用石蜡包埋含海马的脑组织,制备切片备用。取已经制备好的脑组织切片标本,加封闭液后分别滴加一抗,抗Wnt3a 抗体(1∶400)、抗β-catenin 蛋白(1∶300),4 ℃过夜,滴加二抗孵育后进行DAB 显色。参照试剂说明书进行操作。免疫组织化学阳性标准为镜下可见细胞质、细胞核呈棕褐色。采集操作后的组织切片图像(OLYMPUS摄像显微镜,400×),采用随机数字表法观察不重叠的各组大鼠海马CA1 区6 个视野,导入Motic Med 6.0数码医学图像分析系统进行分析。
1.4.5 蛋白质印迹法检测 大鼠喂养至各个时相点后,采用腹腔注射麻醉(10%水合氯醛,350 mg/kg)大鼠,于冰台上直接断头,迅速取出脑组织,用冷的PBS 漂洗后,分离出海马组织。将取出的组织放入15 mL离心管中,加组织裂解液,充分研磨后于浆器中裂解40 min,裂解后离心取上清液,储存于-80 ℃超低温冰箱备用。实验前定量分装蛋白,将其浓度调至800 μg/mL,加等体积上样缓冲液后沸水中煮5 min。冷却至室温,放入4 ℃冰箱备用。实验检测步骤:分别取各组蛋白样品(50 μg),置于10% SDS-PAGE,以湿转法电转移至聚偏二氟乙烯(PVDF)膜上,室温封闭2 h。分别加入一抗,抗Wnt3a抗体(1∶500)、抗β-catenin蛋白(1∶500),置于4 ℃冰箱孵育过夜,次日漂洗后加入羊抗兔二抗(1∶2 000),置于37 ℃反应2 h,PBS洗膜3次加5-溴-4-氯-3-吲哚-磷酸盐/四唑淡蓝(BCIP/NBT)显色数分钟,双蒸馏水终止显色,Image J软件进行灰度值分析。
1.5统计学方法应用SPSS 17.0统计软件进行数据分析。结果以xˉ±s表示,多组间均数比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠海马CA1区Wnt3a、β-catenin免疫组织化学检测结果在Sham组中,Wnt3a、β-catenin蛋白在实验大鼠各时间点海马CA1区可有少量表达。在AD 组中,实验大鼠各时间点表达增多,1 周时表达量增多,2周时表达继续增多,4周时最高,8周时稍有下降但仍有较多表达。与Sham组相比,Wnt3a蛋白在AD 组实验大鼠各时间点表达均增多(P<0.05);β-catenin蛋白在AD组大鼠各时间点表达差异无统计学意义(P>0.05);与AD 组比较,Wnt3a、βcatenin 蛋白在丁苯酞组实验大鼠各时间点表达均明显增加(P<0.01)。见表1,2 和图1,2。
表1 各组大鼠海马CA1区Wnt3a免疫组织化学检测结果比较/(个/高倍视野,)
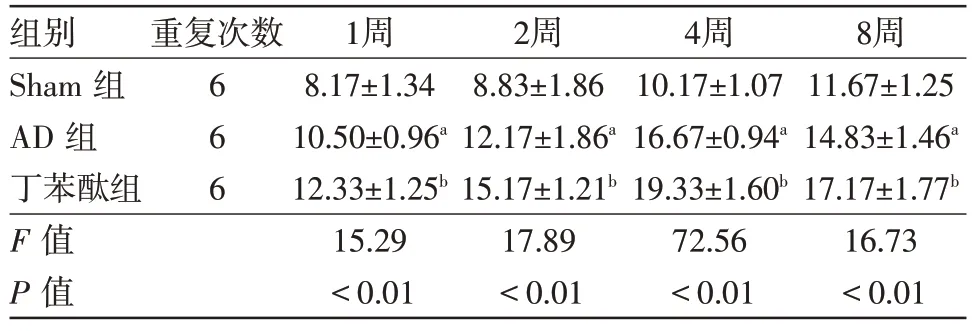
表1 各组大鼠海马CA1区Wnt3a免疫组织化学检测结果比较/(个/高倍视野,)
注:与Sham 组比较,aP<0.01;与阿尔茨海默病(AD)组比较,bP<0.01
images/BZ_14_1285_464_2240_514.png11.67±1.25 14.83±1.46a 17.17±1.77b 16.73<0.01 Sham 组AD 组丁苯酞组F 值P 值666 8.17±1.34 10.50±0.96a 12.33±1.25b 15.29<0.01 8.83±1.86 12.17±1.86a 15.17±1.21b 17.89<0.01 10.17±1.07 16.67±0.94a 19.33±1.60b 72.56<0.01
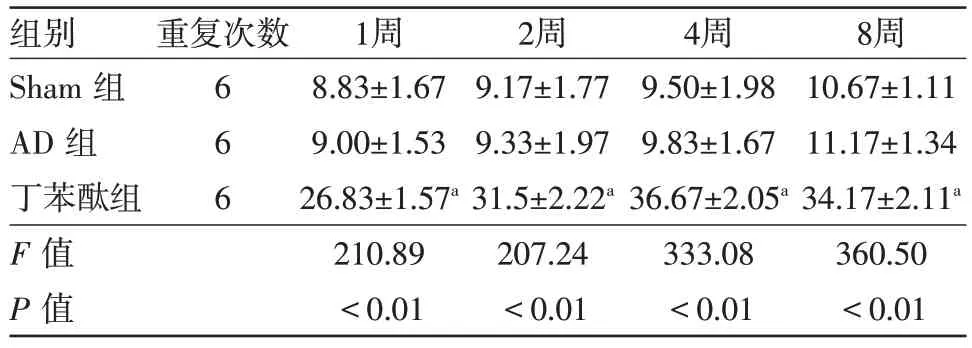
表2 各组大鼠海马CA1 区β-连环蛋白(β-catenin)免疫组织化学检测结果比较/(个/高倍视野,xˉ±s)
2.2各组大鼠海马CA1区Wnt3a、β-catenin蛋白质印迹法检测结果各组大鼠海马CA1 区Wnt3a、β-catenin 蛋白质印迹法检测结果同免疫组织化学检测结果,见表3,4和图3。
3 讨论
AD 是老年性痴呆中的代表疾病,其发生发展缓慢,且与年龄相关。AD 主要临床表现是记忆力减退、进行性认知功能障碍、理解力及判断力衰退等,甚至出现精神行为异常。老年斑形成是AD 的主要病理改变,其主要成分为Aβ 聚集、Tau 蛋白相关的神经元纤维缠结(NFTs)、神经元减少等。Aβ学说认为AD 病人脑中堆积的过量Aβ,会对神经元产生毒性作用,并能引起脑部炎症及细胞凋亡[7]。发现AD发病机制,并对其进行干预,可能达到改善病情的作用。Wnt/β-catenin信号通路被公认为与中枢神经系统发生、发展关系密切。Wnt/β-catenin 信号通路对神经干细胞的增殖、分化、对神经元轴突生长及突触发育起调节作用,亦参与凋亡等过程,对中枢神经系统变性起到保护作用[8-10]。Wnt3a 是Wnt 信号通路启动因子,其表达量增加能促进细胞分裂、分化、增殖[11]。Wnt3a对海马的增殖及分化也很重要,敲除Wnt3a基因的小鼠,海马前体细胞增殖受限,致海马功能受损[12]。β-catenin是位于Wnt信号通路下游中的关键因子,主要位于细胞膜,少量游离于细胞质中,抑制β-catenin磷酸化,胞质中其含量增加,对细胞核内靶基因表达起调节作用[13],参与细胞生长、发育、分化和凋亡等过程。多项研究发现Wnt3a、β-catenin在AD发病过程中减少,表明此机制参与发病过程。本实验免疫组织化学和蛋白质印迹法结果显示,AD 模型组各时间点大鼠海马CA1 区Wnt3a、β-catenin蛋白表达增多,1周时表达增多,2周时表达继续增多,4周时表达量最高,8周时稍有下降但仍处于较高水平,说明Wnt/β-catenin 信号通路在AD的演变过程中起着重要作用。
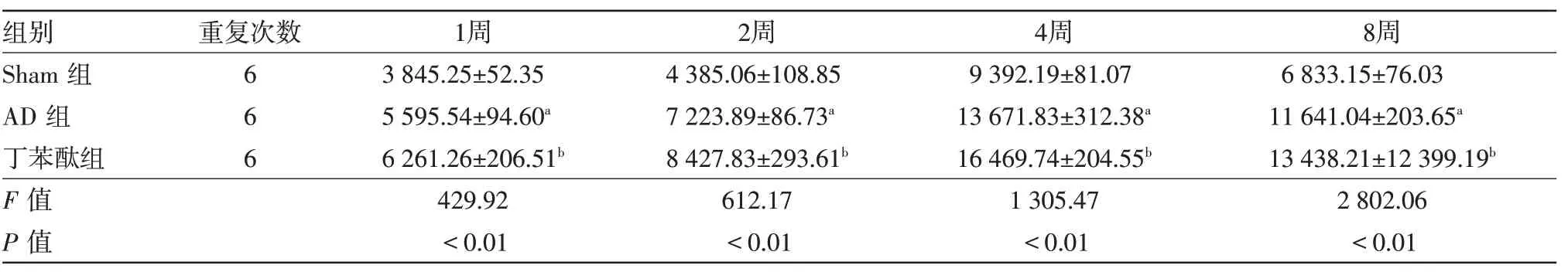
表3 各组大鼠海马CA1区Wnt3a相对表达量蛋白质印迹法结果比较/xˉ±s

表4 各组大鼠海马CA1区β-连环蛋白(β-catenin)相对表达量蛋白质印迹法结果比较/xˉ±s
丁苯酞是我国自主研发的新药,广泛应用于临床,用于治疗缺血性脑血管。而丁苯酞除了具有改善循环、抗自由基等作用外,还具有抗氧化、抑制炎症、抗凋亡等作用[14-16]。丁苯酞在应用于急性缺血性脑卒中研究中发现丁苯酞能够改善病人认知功能[17-19]。王伟等[20]研究发现丁苯酞对海马神经元的保护作用可能是通过降低5-羟色胺的表达来实现的。但国内外关于通过干预Wnt/β-catenin 从而达到脑保护作用的研究较少。本研究免疫组织化学和蛋白质印迹法检测结果均表明,丁苯酞治疗组大鼠海马CA1 区Wnt3a 和β-catenin 蛋白表达明显增加,说明丁苯酞可通过上调Wnt/β-catenin 途径中启动因子Wnt3a 和下游因子β-catenin 的表达,发挥对AD 的脑保护作用,在给药4 周时作用达到高峰,这为AD的治疗提供了新的思路。
综上,丁苯酞通过上调Wnt3a 及β-catenin 的表达,发挥对AD的治疗作用,其与用药时间有关。本研究为AD的治疗提供新线索。
(本文图1~3见插图9-1)
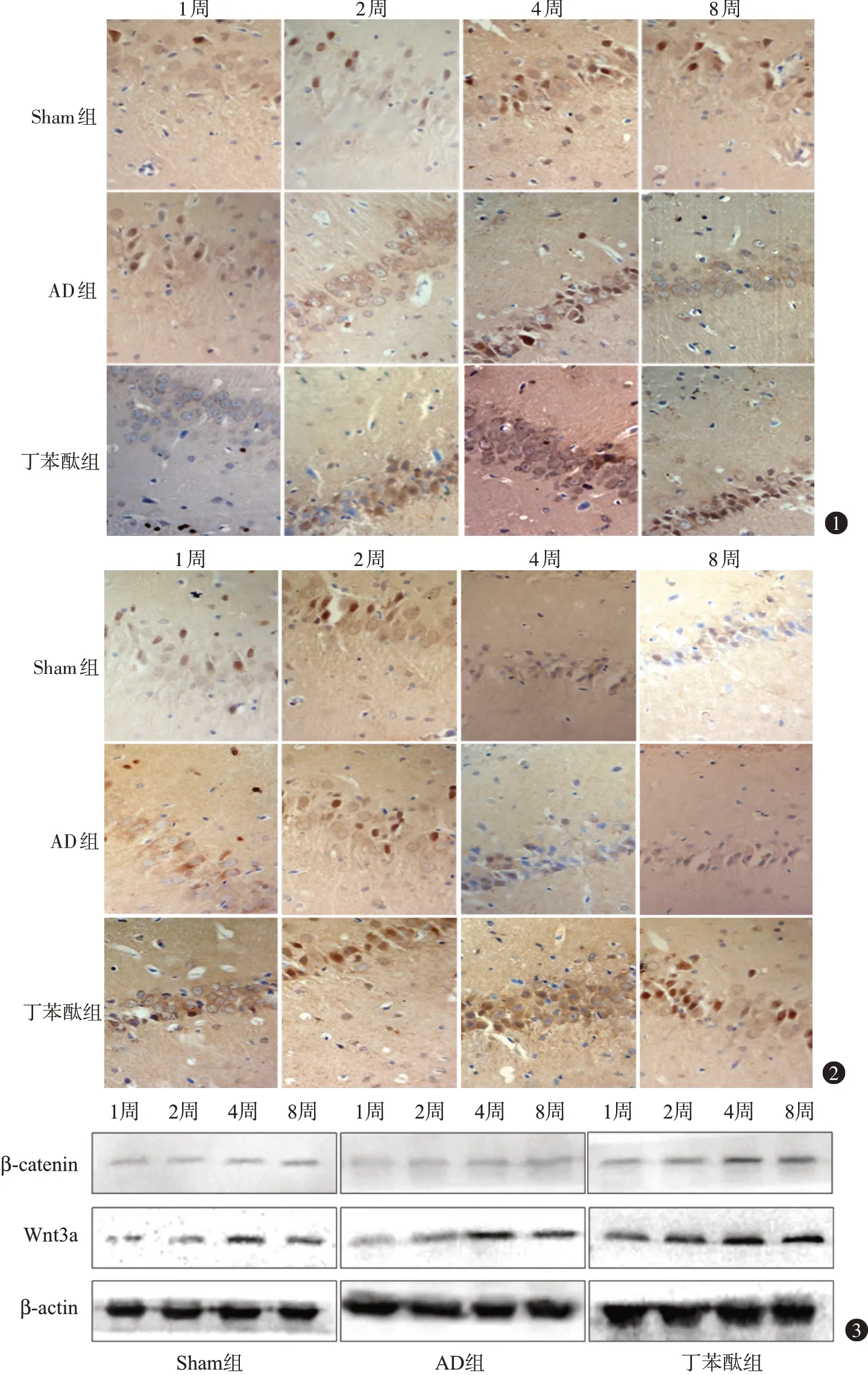
图1 各组大鼠海马CA1区Wnt3a免疫组织化学检测结果(免疫组织化学染色×400) 图2 各组大鼠海马CA1区β-连环蛋白(β-catenin)免疫组织化学结果(免疫组织化学染色×400) 图3 各组不同时间点大鼠海马CA1区Wnt3a、β-连环蛋白(β-catenin)蛋白电泳图(蛋白质印迹法)
