抗敏颗粒质量标准提升研究
2020-09-12王璐黄鲁汪玥
王璐 黄鲁 汪玥
摘要 目的:提升抗敏颗粒制剂的质量标准。方法:利用薄层色谱法(TLC)对抗敏颗粒中苦参、地肤子、甘草、赤芍4种组分进行定性鉴别,运用高效液相色谱法(HPLC)测定制剂中苦参碱的含量。色谱条件:Agilent NH2色谱柱(4.6 mm×250 mm,5 μm),流动相条件:乙腈-无水乙醇-3%磷酸(80∶ 10∶ 10),利用220 nm波长进行检测,流速1.0 mL/min,柱温25 ℃,进样量为10 μL。结果:建立的苦参、地肤子、甘草、赤芍的TLC鉴别中,成分斑点清晰,分离度好,且阴性对照样品无干扰。苦参碱质量浓度在11.31~180.96 μg/mL范围内,与峰面积线性关系良好,R2=1;平均加样回收率为100.88%,RSD为2.31%(n=9)。结论:该方法准确易行,精密度、稳定、重复性均较好,可用作抗敏颗粒制剂的质量标准。
关键词 抗敏颗粒;质量标准;薄层色谱;高效液相色谱;苦参碱;苦参;地肤子;甘草;赤芍
Abstract Objective:To improve the quality standard of Kangmin Granules.Methods:Sophora flavescens,Fructus Kochiae Scoparuae,Radix Grycyrrhizae and Radix Paeoniae Rubra were identified by thin-layer chromatography(TLC).The content of matrine in the preparation was determined by high performance liquid chromatography(HPLC).Chromatographic conditions:Agilent NH2 column(4.6 mm×250 mm,5 μm),mobile phase conditions:acetonitrile-anhydrous ethanol-3% phosphoric acid(80∶ 10∶ 10),detection at 220 nm wavelength,flow rate 1.0 mL/ min,column temperature 25 ℃,injection volume 10 L.Results:In the established TLC identification of Sophora flavescens,Radix Rhizoma,Radix Glycyrrhizae,and Radix Paeoniae Alba,the component spots were clear,the separation was good,and the negative control sample had no interference.The concentration of Sophora flavescens was in the range of 11.31~180.96 μg/mL,which has a good linear relationship with the peak area,R2=1; the average sample recovery rate was 100.88%,and the RSD was 2.31%(n=9).Conclusion:The method is accurate and easy to perform,with good precision,stability and repeatability,and can be used as a quality standard for Kangmin Granules.
Keywords Kangmin Granules; Quality standard; TLC; HPLC; Matrine; Sophora Flavescens; Fructus kochiae scoparuae; Radix grycyrrhizae; Radix paeoniae rubra
中图分类号:R284 文献标识码:A doi:10.3969/j.issn.1673-7202.2020.16.002
抗敏颗粒为东部战区总医院的特色制剂之一,由苦参、牡丹皮、地肤子、蛇床子、僵蚕等11味中药制成,具有祛风除湿,清热凉血的功效。临床上主要用于皮肤过敏性疾病的治疗。原质量标准中仅对君药苦参、佐使药地肤子与甘草运用薄层色谱法(TLC)进行定性鉴别,却没有主要成分的含量测定。因此,为了进一步加强对抗敏颗粒的质量控制,提升其质量标准,保证该制剂临床用药的安全有效性[1],本研究对地肤子的鉴别方法进行了修订,并增加了佐药赤芍的薄层鉴别项。该制剂中的君药为苦参,具有清热燥湿、杀虫利尿的功效,临床多用于湿疹、皮肤瘙痒等症[2]。其中苦参碱是苦参中的主要药效成分,具有抗炎、抗肿瘤、免疫抑制等多种药理作用[3-4]。因此,本研究将苦参碱作为指标成分并建立高效液相色谱法(HPLC)对其含量进行测定,完善抗敏颗粒的质量标准。
1 仪器与试药
1.1 仪器 高效液相色谱仪(VWD检测器,安捷伦科技有限公司,型号:Agilent1100),电子天平(METTLER TOLEDO仪器有限公司,型号:AE240),电子天平(上海精密科学仪器有限公司,型号:FA1604S),恒温水浴锅(常州国华电器有限公司,型号:HH6),台式数控超声波清洗仪(昆山市超声仪器有限公司,型号:KQ-100DE)。
1.2 试剂 地肤子对照药材(中国药品生物制品检定所,批号:121148-200803);甘草对照药材(中国药品生物制品检定所,批号:120904-201418);赤芍对照药材(中国药品生物制品检定所,批号:121093-201403)以及苦参碱对照品(中国药品生物制品检定所,批号:110805-200706);乙腈(色譜纯,TEDIA),薄层层析硅胶板G型(青岛海洋化工),中性氧化铝柱(Sepax Extraction Columns,5 g,25 mL,20 kg)
1.3 分析样品 抗敏颗粒样品(东部战区总医院药剂科制剂室生产,批号:160329,161109,170227,170728,171013,180413)。
2 方法与结果
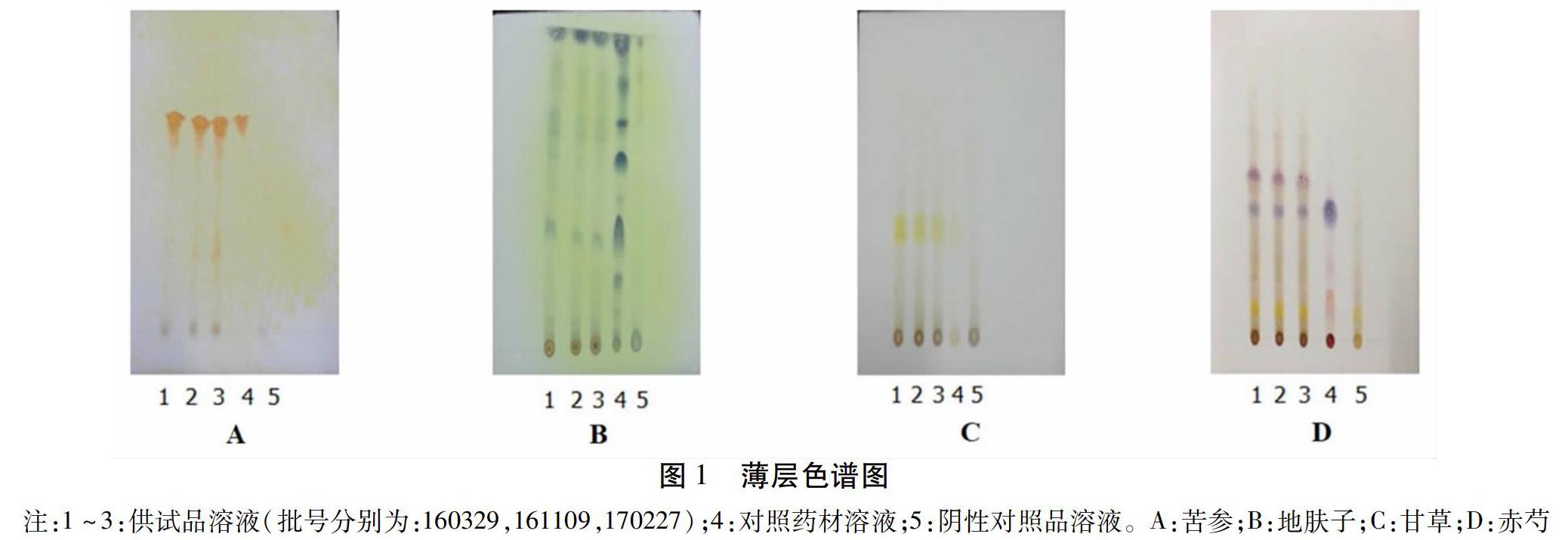
2.1 TLC鉴别 苦参:取本品20 g,研碎,加浓氨水适量湿润,放置1 h,加入二氯甲烷100 mL,经过超声提取处理30 min,滤过,蒸干滤液,残渣中加入1 mL甲醇,取上清,用作供试品溶液。向苦参碱对照品中加入甲醇,制成苦参碱含量为0.52 mg/mL的溶液,用作对照品溶液。另外,根据处方比例称取除苦参外的其他药材,制成阴性对照溶液。将上述3种溶液各吸取20 μL,点在同一硅胶G板上,用二氯甲烷-甲醇-浓氨水(5∶ 0.6∶ 0.2)作为展开剂,展开,取出,晾干,然后喷以改良的碘化铋钾试液。供试品在和对照品相应位置的色谱显现出同样颜色的斑点,同时,阴性对照色谱没有斑点,说明该方法可行。结果见图1A。
地肤子:取本品30 g,研碎,加入70 mL乙醇,盐酸1.5 mL,加热回流2 h,滤过,滤液浓缩到约5 mL,加水10 mL于分液漏斗,加入石油醚(60~90 ℃)萃取2次,20 mL/次,与石油醚液合并后蒸干,向残渣中加入1 mL乙醇作为供试品溶液。另外,取地肤子药材0.5 g对照,加50 mL乙醇,1 mL盐酸,同上述制备方法制成对照药材溶液。另按处方比例称取地肤子、车前草以外的药材,制成阴性对照药材溶液[5]。将供试品溶液和阴性对照溶液各取20 μL,对照品溶液取10 μL,点在同一硅胶G薄层板上,用二氯甲烷-甲醇(20∶ 1)作为展开剂,展开,取出,晾干,然后喷5%的磷钼酸试液,105 ℃烘数分钟。供试品在和对照品相应位置的色谱显现出同样颜色的斑点,同时,阴性对照溶谱无斑点,说明该方法可行。结果见图1B。
甘草:取本品30 g,研碎,加入乙醇70 mL,加热回流提取2次,1 h/次,滤过,滤液水浴蒸干,殘渣加水30 mL,盐酸1 mL,1,2-二氯乙烷30 mL,继续加热回流2 h,分出1,2-二氯乙烷层。酸水层再用1,2-二氯乙烷振摇提取2次,15 mL/次,酸水层留用。将两次提取液混合,水浴蒸干,将剩余残渣加入1 mL甲醇,作为供试品溶液。另取甘草药材0.5 g,研碎,依次加水50 mL、盐酸0.5 mL、1,2-二氯乙烷15 mL,加热回流2 h,滤过,分取1,2-二氯乙烷层,水浴蒸干,将残渣加入1 mL甲醇溶解,作为对照药材溶液。另称取甘草以外的药材,制成阴性对照溶液。上述溶液各吸取20 μL,点在同一硅胶G薄层板上,用正己烷-丙酮-乙酸乙酯(5∶ 2∶ 1)作为展开剂,展开,取出,晾干,喷10%的硫酸乙醇溶液,然后在105 ℃条件下烘约5 min至斑点显色清晰。供试品在和对照品相应位置的色谱显现出同样颜色的斑点,同时,阴性对照色谱无斑点,说明该方法可行。结果见图1C。
赤芍:取本品30 g,研碎,加乙醇100 mL回流提取2 h,滤过,滤液水浴蒸干,将残渣加入30 mL水溶解,进行2次乙醚振摇提取,15 mL/次,再用正丁醇振摇提取水层2次,20 mL/次,将提取液混合后用水洗涤2次,20 mL/次,收集正丁醇提取液,水浴蒸干,加入1 mL甲醇作为供试品溶液。取赤芍对照药材0.5 g,加入乙醇50 mL,制成对照药材溶液。另按处方比例称取赤芍和牡丹皮以外的药材,研细,按照抗敏颗粒的生产工艺以及上述制备方法制成阴性对照溶液。将上述3种溶液各吸取5 μL,点在同一硅胶G薄层板上,三氯甲烷-乙酸乙酯-甲醇-氨水(8∶ 1∶ 4∶ 2)的下层溶液作为展开剂,展开,取出,晾干,喷5%香草醛硫酸溶液,然后在105 ℃条件下烘至斑点显色清晰。供试品在和对照品相应位置的色谱显现出同样颜色的斑点,同时,阴性对照色谱无斑点,说明该方法可行。结果见图1D。
2.2 苦参碱含量测定
2.2.1 色谱条件 色谱柱:氨基键合硅胶柱;流动相:乙腈-无水乙醇-3%磷酸(80∶ 10∶ 10)[6];柱温:25 ℃;流速:1.0 mL/min;进样量:10 μL;检测波长:220 nm;理论塔板数不小于2 000[7]。
2.2.2 对照品溶液的制备 向适量苦参碱对照品加入乙腈-无水乙醇(80∶ 20)制成每1 mL对照品溶液约含苦参碱0.050 mg。
2.2.3 供试品溶液的制备 取适量本品,研细,精密称取约2.0 g,置于50 mL平底烧瓶中,精密加入氨水2 mL[8]、三氯甲烷20 mL,称定重量,65 ℃水浴回流2 h,放冷,然后加入三氯甲烷补足减重,并摇匀,过滤,精密吸取续滤液5 mL,过中性氧化铝柱(Sepax Extraction Columns,5 g,25 mL,20 kg),依次用三氯甲烷50 mL,三氯甲烷-甲醇(7∶ 3)50 mL冲洗,收集洗液,水浴蒸干,用无水乙醇溶解并定容至5 mL,用作供试品。
2.2.4 阴性样品溶液的制备 制备不含苦参的阴性对照样品,然后制成阴性对照样品溶液[9]。
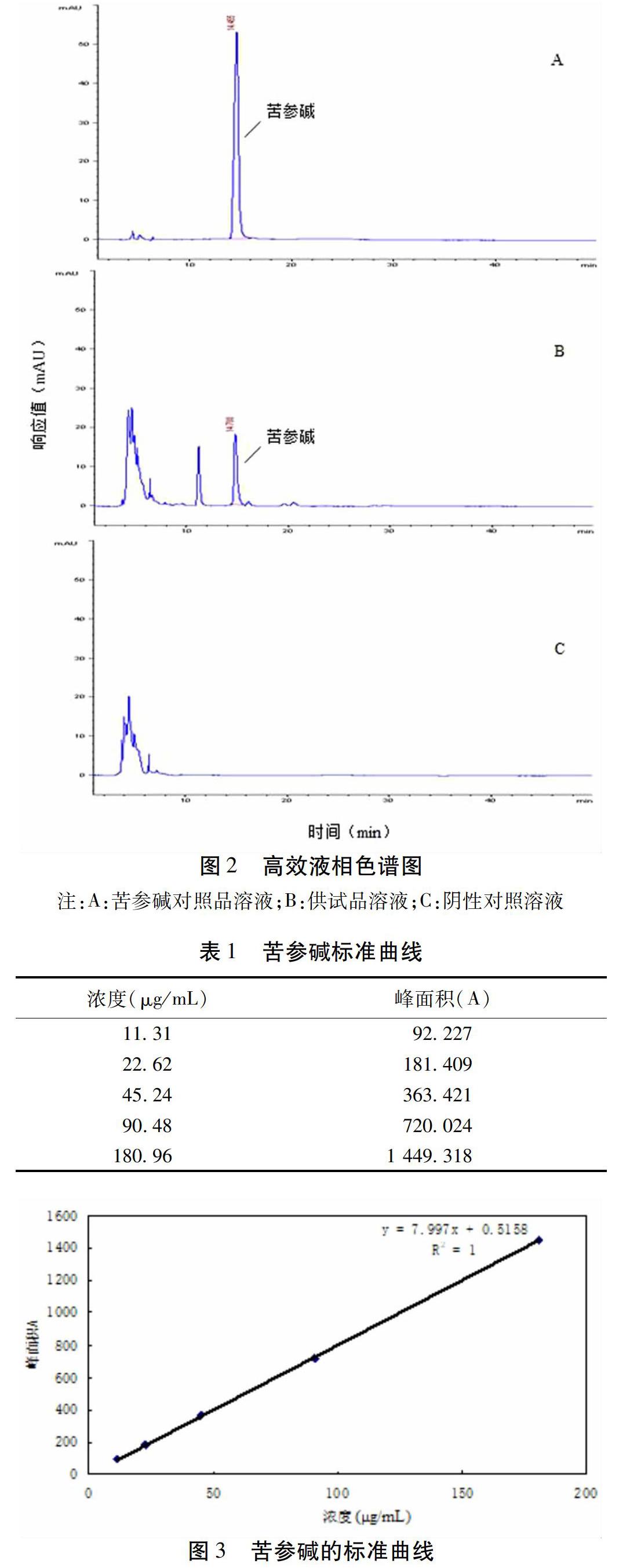
2.2.5 专属性试验 将供试品溶液、对照品溶液和阴性对照样品溶液各取10 μL,按“2.2.1”中的条件进样,结果表明,阴性对照溶液色谱图中相应位置无色谱峰,说明除了苦参的其他药材对苦参碱的测定无干扰。结果见图2。
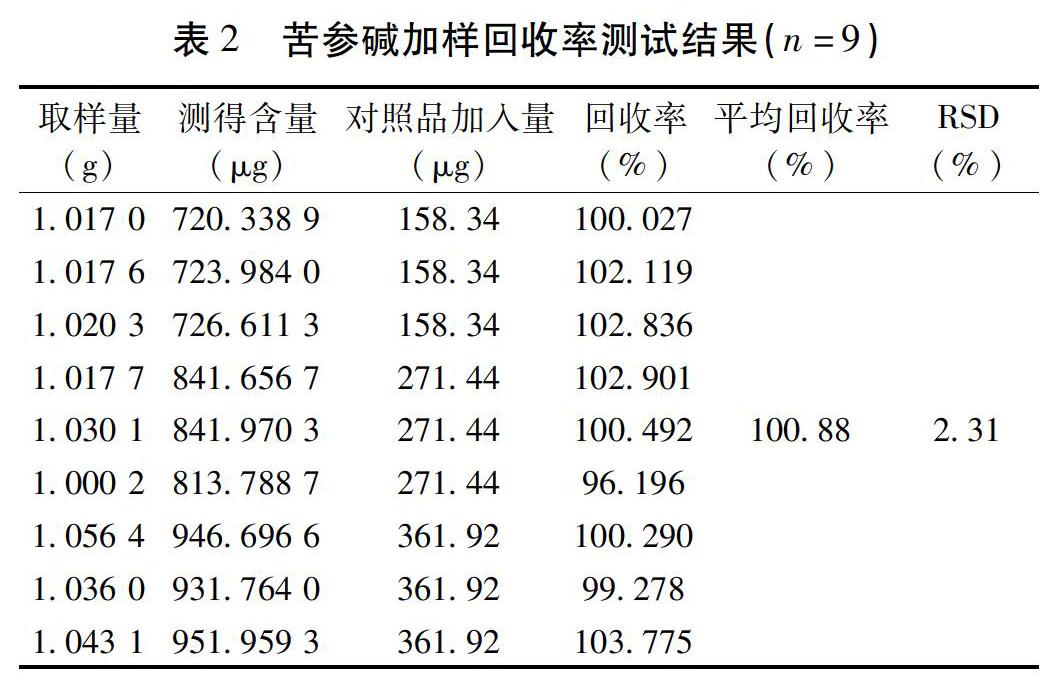
2.2.6 线性关系考察 精密称取苦参碱对照品11.31 mg,置于50 mL量瓶中,加乙腈-无水乙醇(80∶ 20)溶解,稀释,摇匀,作储备液。分别吸取对照品苦参碱储备液0.5,1.0,2.0,4.0,8.0 mL至10 mL容量瓶中,用乙腈-无水乙醇(80∶ 20)稀释至刻度,按“2.2.1”项下的色谱条件进样,得线性回归得方程为:Y=7.997X+0.515 8,R2=1(n=5),其中,X为苦参碱对照品溶液浓度,Y为峰面积。结果表明苦参碱的浓度在11.31~180.96 μg/mL之间,与峰面积呈良好的线性相关。见表1,图3。
2.2.7 精密度试验 取苦参碱对照品溶液,连续进样5次,记录峰面积。计算峰面积RSD为0.75%,结果证明该方法精密性较好。
2.2.8 稳定性试验 取同一供试品溶液(批号:170227),常温下分别于0、1、2、4、8 h,按“2.2.1”项下的色谱条件进样,并记录峰面积。经计算,峰面积RSD为1.62%,结果证明供试品在8 h内稳定。
2.2.9 重复性试验 取同一批号下(批号:170227)的抗敏颗粒,制备5份供试品溶液,测得苦参碱的平均含量为552.563 μg/g,RSD为4.71%,结果证明此方法的重复性较好。
2.2.10 加样回收率试验 称取9份已知含量的样品(批号:170227),约1.0 g/份,分别置于圆底烧瓶中,按低、中、高3个浓度分别精密加入苦参碱储备液0.7 mL、1.2 mL、1.6 mL,制备供试品溶液。进样结果见表2。
2.2.11 样品测定结果 取3个批次(170728,171013,180413)抗敏颗粒,按照拟定色谱条件进样,对每个批次的抗敏颗粒进行3次平行测定,根据记录的苦参碱峰面积计算其含量。结果见表3。
3 讨论
地肤子鑒别项中,在对原质量标准中地肤子鉴别项进行验证时发现,有明显阴性干扰,可能是在1,2-二氯乙烷萃取时,一些大极性的、与齐墩果酸结构相似的成分也被萃取出来导致的。现对其提取方法做了改进,将1,2-二氯乙烷萃取改为石油醚萃取,排除了原有大极性成分的干扰。另地肤子与车前草均含有齐墩果酸成分,故在提取阴性对照溶液时采用“双阴性”法同时去除地肤子和车前草药材,以保证试验有效性[10]。
赤芍鉴别项中,赤芍、牡丹皮共同含有以下化学成分:芍药苷、牡丹酚苷、氧化芍药苷、苯甲酰芍药苷及牡丹酚,且二者同为毛茛科植物[11-12],故在提取阴性对照溶液时采用“双阴性”法同时除去赤芍和牡丹皮药材,确保试验有效。
苦参碱含量测定项中,在样品中加入足量的氨水(2 mL)碱化,可以增强生物碱的脂溶性,利于生物碱游离出来,便于分离提纯[13]。在制剂的提取过程中,曾尝试萃取[14-15]、超声、回流3种方法。结果显示,用三氯甲烷(20、15、10 mL)萃取3次后,仍有许多与三氯甲烷极性相近的杂质无法去除,导致进样后苦参碱峰峰形差,而回流的提取效率明显高于超声,且峰形较好,故最终选择回流2 h作为提取方法。
在分离提纯过程中,笔者曾采用中性氧化铝(上海陆都化学试剂厂)装柱(10 g,内径1.5 cm)后用三氯甲烷、三氯甲烷-甲醇(7∶ 3)50 mL冲洗,但分离效果较差。后外购装填好的中性氧化铝预柱(Sepax Extraction Columns,5 g,25 mL,20 kg),相同提取方法下分离效果较好。这可能是由于手工装柱时,中性氧化铝装填松散,间隙较大,所需成分部分残留在中性氧化铝间隙中无法被洗脱。而外购针管式预柱装填紧密且配有隔板保护样品,因此分离效果较好[16]。
在确定冲洗中性氧化铝柱的溶液体积时,课题组曾尝试依次使用三氯甲烷、三氯甲烷-甲醇(7∶ 3)20 mL结果冲洗不完全,导致苦参碱含量测定的重复性较差。之后分别使用25 mL、50 mL、100 mL冲洗,发现50 mL即能冲洗完全。最终确定冲洗液体积为50 mL。
原药典方法中,苦参药材的含量测定需同时测定苦参碱及氧化苦参碱,但由于氧化苦参碱耐高温性较差[17-18],在制剂生产的高温干燥过程中损失较大,考虑到正文方法的检测限,最终只选用了苦参碱作为含量检测指标。
综上所述,本研究对抗敏颗粒原质量标准中TLC鉴别项进行了修订和完善,建立了新的苦参碱含量的测定方法。该研究中建立的方法专属性强,重复性、精密度、稳定性均较好,且操作简便,可用于抗敏颗粒的质量控制。
参考文献
[1]孟硕,彭勍,张鹏,等.麻荆颗粒质量标准研究[J].世界中医药,2020,15(5):732-737.
[2]王悦,姜雪,丁菲,等.中药苦参药理作用及应用研究进展[J].山东化工,2017,46(15):66-67,69.
[3]Silva DP,Florentino IF,Oliveira LP,et al.Anti-nociceptive and anti-inflammatory activities of 4-[(1-phenyl-1H-pyrazol-4-yl)methyl] 1-piperazine carboxylic acid ethyl ester:A new piperazine derivative[J].Pharmacol Biochem Behav,2015,137:86-92.
[4]Liu JY,Hu JH,Zhu QG,et al.Effect of matrine on the expression of substance P receptor and inflammatory cytokines production in human skin keratinocytes and fibroblasts[J].Int Immunopharmacol,2007,7(6):816-823.
[5]常新全,丁丽霞.中药活性成分分析手册[S].北京:学苑出版社,2002:826.
[6]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:202-203.
[7]李清芳,梁艳,张峰,等.高效液相色谱法测定消银胶囊中苦参碱和牛蒡苷的含量[J].世界中医药,2018,13(4):984-987.
[8]夏学励.HPLC法测定癣净颗粒中苦参碱、氧化苦参碱的含量[J].中国药房,2009,20(18):1420-1421.
[9]吕玲玲,郑岚,谢松.葛芪颗粒的质量标准研究[J].世界中医药,2017,12(10):2478-2481.
[10]胡辉,翟红伟,刘源才.地肤子配方颗粒的质量标准[J].医药导报,2019,38(5):626-631.
[11]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:158,172.
[12]张欢,何丽丽.牡丹皮、赤芍配伍对活血化瘀疗效及有效成分的影响[J].中国现代医学杂志,2019,29(7):13-17.
[13]陈黎,王永惠,黄良永.HPLC法测定妇安消疹洗液中苦参碱与氧化苦参碱的含量[J].中国药师,2012,15(2):217-219.
[14]陆国寿,叶勇,卢文杰,等.多叶越南槐中苦参碱与氧化苦参碱的分离鉴定及含量测定研究[J].广西医学,2014,36(8):1109-1112.
[15]何超然,李哲,李任,等.HPLC法同时测定山豆根中4种生物碱及其含量[J].中国药物应用与监测,2018,15(2):77-81.
[16]杨霞,郭宝林,胡红宇,等.氧化铝固相萃取小柱在苦参生物碱含量测定中的应用[J].中国中药杂志,2013,38(17):2844-2847.
[17]梅明,伍振峰,韩丽,等.苦参中生物碱类成分的稳定性及减压提取工艺研究[J].现代中药研究与实践,2015,29(1):48-51.
[18]岑叶,干红女,王向娟,等.匀浆法提取狼牙刺中氧化苦参碱的工艺研究[J].中国中医药科技,2018,25(1):54-56.
(2019-05-30收稿 责任编辑:杨觉雄)
