长链非编码RNA FOXD2-AS1对胃癌细胞增殖、侵袭和转移的影响及其机制
2020-09-11
0 引言
胃癌是世界上最常见的恶性肿瘤之一,Bray等[1]对全球185个国家36种癌症进行统计分析显示:胃癌每年新发病例约100多万,约占癌症新发病例6%,居恶性肿瘤中第六位。中国是胃癌高发国家,每年新发病例数约40万,占全世界40%左右[2]。目前胃癌在全球范围内呈高发趋势,主要集中于中国、日本、韩国等东亚国家,已经严重威胁到了人类的健康[3],探究促进胃癌发生发展的新机制,探索胃癌治疗的新方法意义重大。
长链非编码RNA(long-chain non-coding RNA,lncRNA)是长度在200~100 000 nt之间的RNA分子,近年来越来越多的研究发现其在染色体沉默、染色质表观遗传学修饰、基因转录、蛋白翻译及定位等各方面发挥了重要的作用[4]。据文献报道:lncRNA FOXD2-AS1在结直肠癌[5]、食管癌[6]、肺癌[7]、肝癌[8]等多种癌症中高表达,并参与肿瘤的发生、增殖、迁移、侵袭及化疗抵抗等生物学过程。本研究通过临床组织标本验证lncRNA FOXD2-AS1的表达情况与患者临床病理资料的关系,并在体外实验中研究其在促进胃癌发展的作用及可能的机制。
1 材料与方法
1.1 实验材料
人正常胃癌上皮细胞系GES-1、人胃癌细胞系BGC-823、AGS、MGC-803、MKN45、MKN-74由湖南省中医药大学基础医学院实验室馈赠,E-Cadherin(Cat:10204-MM08)及N-cadherin(Cat:11039-R020)抗体购自义翘神州有限公司、Vimentin抗体购自美国CST公司(#5741)、β-catenin(ab32572)及Cyclin-D1(ab16663)抗体购自美国Abcam公司,GAPDH(Cat:10494-1-AP)一抗购自美国Proteintech公司,鼠二抗及兔二抗均购自上海优宁维生物公司,RPMI1640及胎牛血清(FBS)均购自于以色列BI公司,RNA提取试剂盒、反转录试剂盒及qRT-PCR试剂盒均购自北京全式金生物技术有限公司,RNA保护液及转染试剂Lipofectamine3000 Transfection Reagent购自美国赛默飞公司,lncRNA FOXD2-AS1小干扰RNA序列及对照序列均由苏州吉玛基因股份有限公司合成,GAPDH及lncRNA FOXD2-AS1引物由湖南擎科生物技术有限公司合成。
1.2 实验方法
1.2.1 大数据应用 在GEPIA在线数据库中(http://gepia.cancer-pku.cn)分析LncRNA FOXD2-AS1在胃癌中的表达情况;从TCGA数据库中下载胃癌患者资料,分析lncRNA FOXD2-AS1的表达情况、在K-M在线分析数据库(http://kmplot.com)分析lncRNA FOXD2-AS1的表达情况及与患者肿瘤分期关系。
1.2.2 胃癌组织RNA提取 选取2018年9月—2019年3月30例在湖南中医药大学第一附属医院行胃癌根治术患者新鲜标本,患者均知情同意,并获得医学伦理委员会批准。在标本离体30 min内将标本收取并剪成1 mm3小块置于RNA保护液中,放入液氮保存,提取RNA前将组织从液氮中取出,放入液氮预冷的研钵中研碎,参照RNA提取试剂盒说明书提取组织RNA,并测定浓度,选取OD260/OD280值在1.9~2.1之间的RNA进行后续实验,保证RNA的完整性,参照反转录试剂盒将RNA合成cDNA,细胞样本RNA提取方法同上。
1.2.3 细胞培养及分组 人胃癌细胞系BGC-823培养于含10%的胎牛血清、1% 100 μg/ml青霉素及100 μg/ml链霉素的RPMI 1640完全培养基中,置于37℃、5%CO2培养箱中培养。将人胃癌细胞系BGC-823分别转染siRNA-A、siRNA-B以及siRNANC,分为siRNA-A组、siRNA-B组及siRNA-NC组。lncRNA FOXD2-AS1 siRNA-A序列正义链:5'-GCGAAGAGUACGUUGCUAUTT-3';反义链:5'-AUAGCAACGUACUCUUCGCTT-3';lncRNA FOXD2-AS1 siRNA-B序列正义链:5'-GUUCGAG AGUGAAUUUACATT-3';反义链:5'-UGUAAA UUCACUCCUCGAACTT-3';阴性对照序列正义链:5'-UUCUCCGAACGUGUCACGUTT-3';反义链:5'-ACGUGACACGUUCGGAGAATT-3'。转染方法参照Lipofectamine3000 Transfection Reagent说明书及干扰序列说明书进行。
1.2.4 qRT-PCR实验 提取组织及细胞样本RNA,将RNA反转录成cDNA,参照qRT-PCR试剂盒说明书采用qPCR三步法进行实验,实验条件:在94℃预变性30 s,94℃ 5 s,60℃ 15 s,72℃ 10 s,进行40个循环扩增,利用GAPDH作为内参,定量采用2-ΔΔCt法,计算胃癌各细胞系、癌组织与癌旁组织以及siRNA-A组、siRNA-B组及阴性对照组中lncRNA FOXD2-AS1相对表达量。GAPDH引物序列:上游引物:5'-GAGTCAACGGATTTGGTCGT-3';下游引物:5'-GACAAGCTTCCCGTTCTCAG-3';lncRNA FOXD2-AS1引物序列:上游引物:5'-CCG CGTAAGCCTCATAGAAG-3';下游引物:5'-GGG AGTAGGGTGAGGAAAGG-3'。
1.2.5 细胞增殖能力检测 采用CCK8比色法测定lncRNA FOXD2-AS1 siRNA-A组、siRNA-B组及阴性对照组细胞增殖能力。将三组细胞以3 000个/孔种植于96孔板中,分别于培养0、24、48、72和96 h后,吸尽培养基,每孔加入含10%CCK8试剂的RPMI 1640溶液100 μl,2 h后在450 nm波长下,利用酶标仪测定吸光度,实验重复三次,取平均值并绘制增殖曲线。采用平板克隆形成实验检测细胞增殖及克隆形成能力。胰酶消化,充分打匀并计数,6孔板中加入2 ml完全培养基,每孔加入400个细胞,当培养皿中出现肉眼可见的克隆时终止培养,甲醇固定15 min,0.1%结晶紫溶液染色30 min后肉眼计数克隆数,克隆形成率=克隆数/接种细胞数×100%,实验重复三次,取平均值。
1.2.6 细胞迁移能力测定 预先用记号笔在6孔板背后每隔0.5 cm划一道线。培养人胃癌BGC-823细胞株至对数期,并按5×105个/孔接种于6孔板,37℃细胞培养箱内培养过夜,第二天待细胞长满,用200 μl枪头垂直于画线进行划痕,并用PBS洗两次,分别加入含无血清培养基,并于显微镜下拍照,记录0 h划痕位置及宽度,培养箱内继续培养24 h后与0 h同一位置进行拍照,并计算划痕愈合率,愈合率=(0 h划痕宽度-24 h划痕宽度)/(0 h划痕宽度),实验重复3次,取平均值。
1.2.7 细胞侵袭能力测定 采用Transwell实验检测细胞侵袭能力,将三组细胞消化吹打匀,并用不含血清的RPMI 1640培养基重悬,将细胞密度调整到1.5×104个/毫升,取200 μl细胞悬液接种于Transwell小室上室,下室加入含10%FBS的完全培养基,培养24 h后,PBS轻洗两遍,用甲醇固定细胞,用棉签擦拭掉上室细胞,将下室细胞采用0.1%结晶紫溶液染色,染色30 min后显微镜200倍视野下,分别取左上、左下、右上、右下以及中间五个视野,计算穿膜细胞数,实验重复三次,取平均值。
1.2.8 蛋白印迹(Western blot)实验 提取lncRNA FOXD2-AS1 siRNA-A组、siRNA-B组及阴性对照组细胞总蛋白,裂解并变性,电泳条件:浓缩胶80 V至蛋白Marker分离后,加大电压至溴酚蓝跑至胶底;转膜条件:300 mA转80 min,脱脂奶粉室温封闭1 h,加入相应一抗,4℃过夜,二抗室温孵育1 h,ECL液显影,并计算灰度值,实验重复三次。
1.3 统计学方法
数据用SPSS21.0统计分析软件处理,计量资料用均数±标准差()表示,组间两两比较经单因素方差分析,若符合方差齐性正态性分布采用t检验,若不符合则用秩和检验,组间重复测量数据分析采用重复测量设计的方差分析,率的比较或构成比比较采用四格表卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA FOXD2-AS1在胃癌组织中的表达及与临床病理因素的关系
GEPIA 数据库在线分析显示lncRNA FOXD2-AS1在胃癌组织中较癌旁组织中高表达(P=0.000),见图1A;K-M(Kaplan-Meier Plotter(http://kmplot.com))数据库在线分析显示:lncRNA FOXD2-AS1的表达与患者的不良预后密切相关(P=0.000),见图1B;取30例胃癌根治术患者标本提取RNA行qRT-PCR结果显示:lncRNA FOXD2-AS1在癌组织中表达较癌旁组织显著增高,差异具有统计学意义(P=0.000),见图1C。
我们以l ncRNA FOXD2-AS1中位表达量(2.883)为界,将患者分为lncRNA FOXD2-AS1高表达组及低表达组(每组各15例),并与患者临床一般资料及病理资料比较,结果显示lncRNA FOXD2-AS1的表达与肿瘤分期相关(P=0.025),与患者年龄、性别、肿瘤大小及浸润深度无关(均P>0.05),见表1。
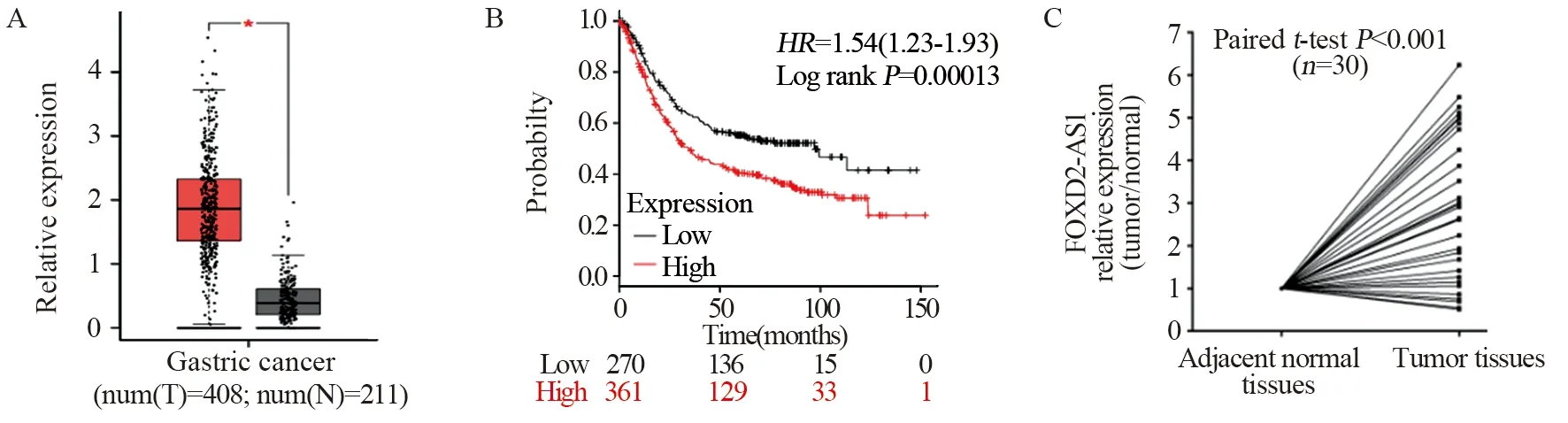
图1 lncRNA FOXD2-AS1在胃癌组织中的表达及与患者预后的关系Figure 1 lncRNA FOXD2-AS1 expression in gastric cancer tissues and its relation with patients’ prognosis
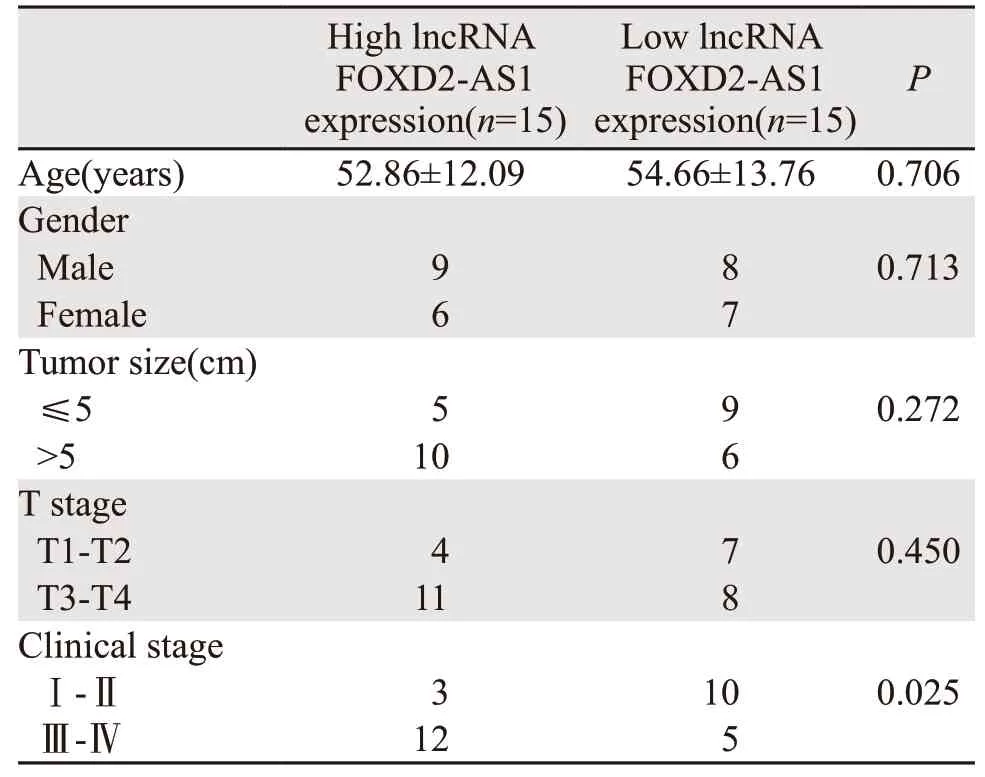
表1 lncRNA FOXD2-AS1表达与胃癌患者临床病理分期相关性Table 1 Correlation between lncRNA FOXD2-AS1 expression and clinicopathological stage of gastric cancer patients
2.2 lncRNA FOXD2-AS1在不同胃癌细胞系中的表达
qRT-PCR检测lncRNA FOXD2-AS1在各细胞系中表达情况,将GES-1细胞系相对表达量设为1,计算各胃癌细胞系较GES-1细胞系lncRNA FOXD2-AS1相对表达量,实验重复3次。qRT-PCR结果显示:胃癌细胞系AGS、BGC-823、MGC-803、MKN-45、MKN-74细胞系相对表达量分别为2.43±0.14(P=0.000)、4.38±0.18(P=0.000)、1.73±0.08(P=0.001)、1.87±0.11(P=0.0002)、2.07±0.14(P=0.0002),各胃癌细胞系中lncRNA FOXD2-AS1相对表达量均明显高于胃正常上皮细胞系GES-1(均P<0.05),其中BGC-823细胞系lncRNA FOXD2-AS1相对表达量最高,见图2。
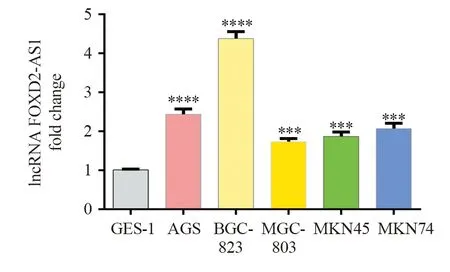
图2 lncRNA FOXD2-AS1在不同胃癌细胞系中的表达Figure 2 lncRNA FOXD2-AS1 expression in different gastric cancer cell lines
2.3 lncRNA FOXD2-AS1基因沉默对胃癌细胞系BGC-823的增殖及克隆形成能力的影响
2.3.1 沉默效率验证 BGC-823细胞转染lncRNA FOXD2-AS1的小干扰RNA(siRNA-A、siRNA-B)及阴性对照序列(siRNA-NC)后,qRT-PCR验证lncRNA FOXD2-AS1表达情况,结果显示:将阴性对照组lncRNA FOXD2-AS1相对表达量设为1,与阴性对照组相比,FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组lncRNA FOXD2-AS1相对表达量为0.37±0.05(P=0.000)、0.30±0.02(P=0.000),说明两组lncRNA FOXD2-AS1的沉默效率均大于60%,与阴性对照组相比显著下降(均P<0.05),两组siRNA均可为后续实验所用,见图3A。
2.3.2 CCK8结果 单因素方差分析显示,转染24 h内各组OD值差异无统计学意义(P=0.379),转染48、72和96 h后,各组细胞OD值差异具有统计学意义(均P=0.000),且siRNA-NC组增殖速度较FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组明显增快,见图3B。
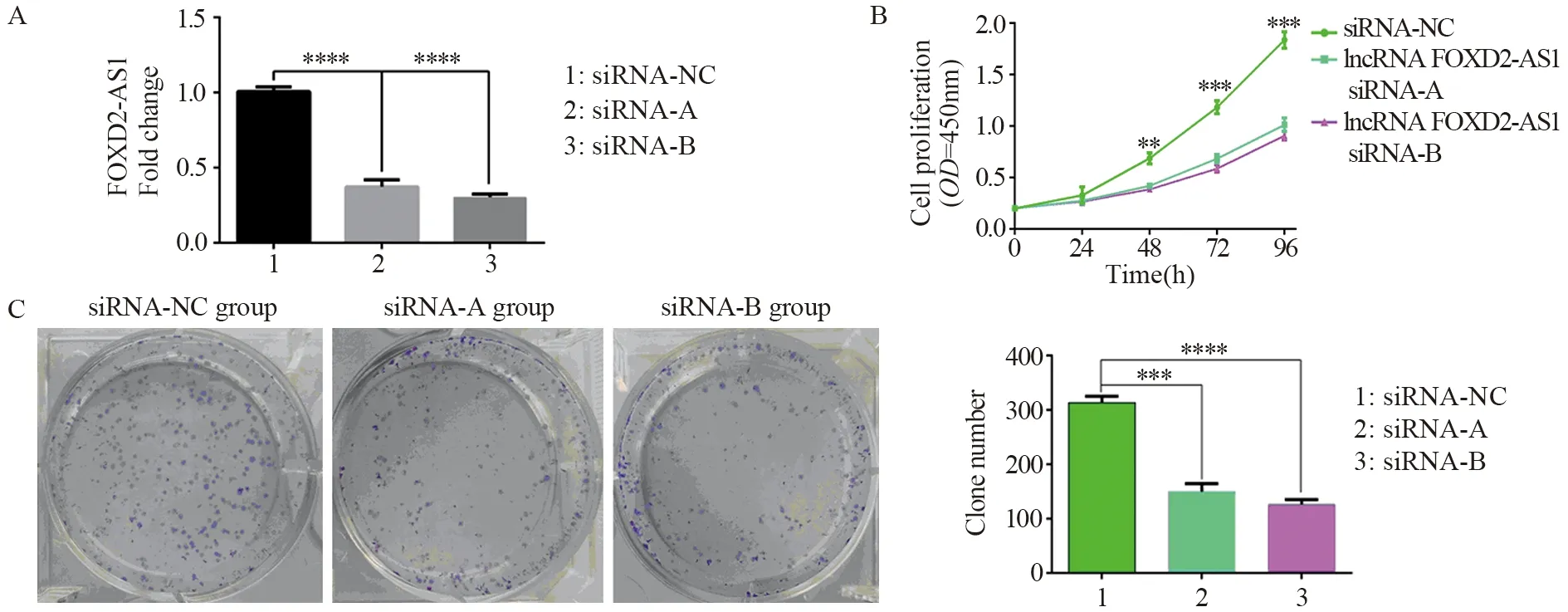
图3 lncRNA FOXD2-AS1沉默效率验证(A)、CCK8增殖实验(B)及细胞平板克隆形成实验(C)结果Figure 3 Results of lncRNA FOXD2-AS1 silencing efficiency verification(A),CCK8 proliferation experiment (B) and cell plate clone formation experiment(C)
2.3.3 平板克隆形成实验结果 siRNA-NC组、FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组克隆形成数目分别为313.3±12.01、149.6±14.7、126.3±8.7个,克隆形成率分别约78.2%、37.5%和31.5%,经单因素方差分析,差异具有统计学意义(P=0.000),且siRNA-NC组克隆形成率明显高于FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组,见图3C。
2.4 lncRNA FOXD2-AS1基因沉默对胃癌细胞系BGC-823的迁移和侵袭能力的影响
2.4.1 划痕实验结果 siRNA-NC组、FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组24 h划痕愈合率分别为(74.7±1.7)%、(49.7±2.2)%、(39.6±1.4)%,经单因素方差分析,差异具有统计学意义(P=0.000)。且FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组划痕愈合率明显低于阴性对照组,见图4A。
2.4.2 Transwell小室侵袭实验结果 siRNA-NC组、FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组穿透基质胶到达下室的细胞数分别为423.0±19.5、279.7±15.6、229.0±10.8,经单因素方差分析,差异具有统计学意义(P=0.000),FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组侵袭细胞数明显少于阴性对照组,见图4B。
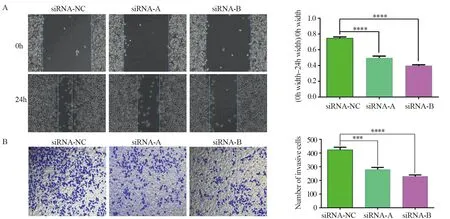
图4 划痕实验(A)和Transwell小室侵袭实验(B)结果Figure 4 Results of wound healing assay(A) and Transwell test(B)
2.5 lncRNA FOXD2-AS1基因沉默对Wnt/β-catenin通路关键蛋白及下游蛋白的影响以及对EMT相关蛋白的影响
qRT-PCR及Western blot实验结果显示:FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组中E-cadherin的表达较阴性对照siRNA-NC组显著增高,差异具有统计学意义(P=0.000),而N-cadherin、Vimentin、β-catenin与Cyclin D1的表达量较阴性对照siRNA-NC组均显著降低,差异具有统计学意义(均P=0.000),见图5 。
3 讨论
研究报道多种lncRNA与胃癌的发生发展密切相关。Xu等[9]报道lncRNAPVT1与FOXM1的正反馈调节调控胃癌的增殖及侵袭转移。Yan等[10]发现lncRNA SNHG6通过沉默P27蛋白的表达以及吸附miR-101-3p来调节ZEB1表达从而促进胃癌细胞的增殖及EMT,影响胃癌患者的临床预后。Zhang等[11]发现HNRNPKP2通过调控CXCR4的表达从而促进胃癌的肝转移;影响胃癌发生发展的lncRNA还包括lncRNA ZFPM2-AS1[12]、lncRNA ELIT-1[13]、lncRNA LINC00346[14]等,lncRNA在胃癌增殖、细胞周期调控、侵袭、转移及血管生成等方面都发挥了重要的调控作用。
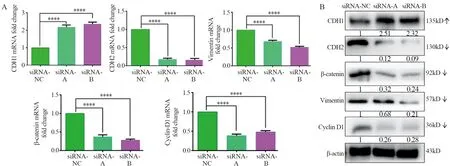
图5 沉默lncRNA FOXD2-AS1对Wnt/β-catenin通路相关蛋白及EMT相关蛋白qRT-PCR实验(A)和Western blot实验(B)验证结果Figure 5 Effect of lncRNA FOXD2-AS1 silencing on expression of Wnt/β-catenin pathway related proteins and EMT-related proteins detected by qRT-PCR(A) and Western blot(B)
lncRNA FOXD2-AS1在多种肿瘤中高表达,并与患者的病理分期及临床预后密切相关。在肝癌中,lncRNA FOXD2-AS1可以通过招募EZH2到p27基因的启动子上,调控p27基因表达,从而促进肝癌发展[15]。在神经胶质瘤中,lncRNA FOXD2-AS1可以吸附miRNA-185-5p,并通过PI3K/AKT通路促进肿瘤的增殖及侵袭转移[16]。lncRNA FOXD2-AS1作为一个重要的癌基因,在不同的癌症中其作用也不尽相同。本研究发现lncRNA FOXD2-AS1在胃癌组织中较癌旁组织中明显升高,数据挖掘结果显示其高表达与胃癌的预后相关,同样在我们的样本中发现其表达与胃癌的病理分期相关,这表明lncRNA FOXD2-AS1可能促进了胃癌的进展。进一步体外实验研究发现:在胃癌BGC-823细胞系中抑制lncRNA FOXD2-AS1的表达可显著抑制BGC-823细胞的增殖、克隆形成、迁移及侵袭能力。在进一步机制探索中我们发现,抑制lncRNA FOXD2-AS1的表达可以抑制N-cadherin与Vimentin的表达,促进E-cadherin的表达,同时抑制Wnt/β-catenin通路关键蛋白β-catenin以及下游蛋白Cyclin D1的表达,结果提示抑制lncRNA FOXD2-AS1可能通过抑制Wnt/β-catenin通路的激活,从而抑制胃癌细胞EMT的发生降低胃癌细胞的侵袭和转移能力,研究结果与Huang等研究发现EphA2通过Wnt/β-catenin通路促进胃癌侵袭转移相符[17]。
本实验尚存在一些不足之处:(1)在验证胃癌组织及癌旁组织表达情况与患者病理分期时只收集了30例患者的标本及信息,样本量较小,这也可能是导致lncRNA FOXD2-AS1的表达仅与临床分期相关,而与肿瘤大小及浸润深度无明显差异的原因之一,后续实验需进一步扩大样本量;(2)lncRNA FOXD2-AS1调控Wnt/β-catenin通路的确切机制仍不清楚,还需进一步机制研究。
综上所述,lncRNA FOXD2-AS1在胃癌组织及胃癌细胞系中高表达,与患者肿瘤临床分期和预后相关,抑制其表达可通过抑制Wnt/β-catenin通路的激活,抑制胃癌细胞EMT的发生,降低胃癌细胞的增殖及迁移侵袭能力,lncRNA FOXD2-AS1可作为胃癌潜在的治疗靶点及临床预后标志物。
