基于纳米材料的骨靶向光热治疗技术在转移性骨肿瘤治疗中的应用及预见性护理
2020-09-11徐巧巧
徐巧巧,许 洪
(湖北文理学院附属医院 襄阳市中心医院,湖北441021)
骨肿瘤分为恶性和良性肿瘤两种,骨肿瘤是发生在骨骼或附属组织的肿瘤,恶性骨肿瘤有着较高的死亡率和致残率,而良性骨肿瘤预后较好,容易根治[1]。恶性骨肿瘤可以细分为原发性骨肿瘤和转移继发性骨肿瘤,其中较为常见的是转移性骨肿瘤,对病人所产生的危害更为严重。因为红骨髓内的血流十分丰富,因而成了最为常见的恶性肿瘤转移部位之一。据统计,有高达80%的前列腺癌和乳腺癌会出现骨转移,其他肿瘤同样可能会出现骨转移,只是发生概率相较于前列腺癌和乳腺癌则显著偏低,为5%~42%。当发生骨肿瘤或肿瘤转移时,会促使细胞因子分泌,细胞因子的分泌会增强破骨细胞活性,促使骨溶解的发生,而骨溶解又会促进生长因子的分泌,二者相互促进,加速了骨溶解的发生。根据临床表现情况,病人一般会出现脊髓压迫、持续性疼痛等情况,导致骨肿瘤病人的生存质量一般较差,生存时间也会受到极大的影响。面对骨肿瘤治疗时,必须要合理进行骨肿瘤的控制和治疗,目前最为常规的治疗方式是化疗、手术和放疗等,然而这些治疗方法在实际临床应用中被发现存在诸多的不足[2]。传统的手术治疗虽然能够切除肿瘤,但是许多恶性肿瘤都存在着边界不清的情况,特别是对多发病灶的肿瘤更是难以切除干净。采用传统的切除手术,风险高、创伤大,由于许多不可控的因素,直接导致了术后并发症多发,给病人带来了巨大的痛苦。癌细胞在骨髓中很容易生长,这是由于骨髓微环境为癌细胞的生长提供了十分有利的环境,当进行化疗和放疗时,生长于骨髓中的癌细胞还会受到一定的保护,这使得传统的化疗和放疗效果会极大地降低[3]。近年来,热消融治疗越来越多地应用于肿瘤治疗中,由于该治疗具有微创、副作用小等特点,因而受到越来越多的重视。传统的热消融技术在进行肿瘤组织的杀伤方面缺乏特异性,因而在杀伤肿瘤细胞的同时也会对正常细胞组织造成很大的损伤。为了改进这种治疗方案,许多学者提出了利用超小纳米光热材料来进行肿瘤治疗,这种治疗方案更是在动物身上证实了其可靠性和有效性[4]。光热治疗是利用700~1 100 nm 波长的近红外光照射实现光热性能的转化,纳米材料在近红外光的照射下快速升温,产生高热量来杀死肿瘤细胞。这种光热治疗方案对肿瘤细胞的杀伤具有显著的特异性,对正常组织副作用很低,目前正逐渐发展成为一种治疗肿瘤的新型治疗方案,为肿瘤的临床治疗提供了新思路[5]。当前,经过多年的发展,可以应用于光热治疗中的纳米材料较多,合成的纳米材料主要有金纳米壳、石墨烯、金纳米棒等多种纳米材料,这些纳米材料已经在动物实验和细胞水平取得了较好的治疗效果,但是距离临床应用还存在着相当大的差距[6]。当前纳米材料在光热治疗方案中的应用上存在的问题主要是纳米尺寸太大,很难实现各种材料的多功能用途。因而,需要设计出尺寸非常小的光热纳米材料,才能够真正实现光热纳米材料的临床应用,同时也可以预见性地分析基于新型纳米材料光热治疗的临床护理措施。
1 实验材料及方法
1.1 超小光热纳米材料的合成 ①光热纳米材料末端为羧基PAMAM 树形高分子——铂光热纳米材料(简称G4.5‐COOH‐Pt)的合成:在0.5 mL 双蒸水中加入50 μL 的G4.5‐COOH PAMAM 树形高分子,利用氯化氢(HCl)将溶液pH 值调至2,加0.476 mL K2PtCl6,室温条件下磁力搅拌后充分反应24 h。使用氢氧化钠(NaOH)将溶液pH 值调至9.16 后加入0.476 mL 的硼氢化钠(NaHB4),充分反应2 h。将溶液转移到双蒸水中透析10 次,1 h 换水1 次,收集的最终产物保存在4 ℃的环境中。②光热纳米材料末端为氨基PAMAM树形高分子——铂光热纳米材料(简称G5‐NH2‐Pt)的合成:在0.5 mL 双蒸水中加入50 μL 的G5‐NH2PAMAM树形高分子,利用HCl 将溶液pH 值调至3,加0.393 mL K2PtCl6,室温条件下磁力搅拌后充分反应24 h。加入0.393 mL 的NaHB4,充分反应2 h。将溶液转移到双蒸水中透析10 次,1 h 换水1 次,收集的最终产物保存在4 ℃的环境中。③光热纳米材料末端为乙酰化氨基的PAMAM 树 形 高 分 子 纳 米 材 料(简 称G5‐NH2‐AC)的合成:在3 mL 无水甲醇中加入200 mg 的G5‐NH2PAMAM树形高分子,加入69 μL 乙酸酐,封口后在室温条件下磁力搅拌充分反应48 h 后转移至透析袋,在磷酸盐缓冲液(PBS)溶液中透析3次后在双蒸水中透析10次后收集反应产物。④光热纳米材料末端为乙酰化氨基的PAMAM树形高分子——铂光热纳米材料(G5‐NH2‐AC‐Pt)的合成:在0.5 mL 双 蒸 水 中 加 入50 μL 的G5‐NH2‐AC PAMAM 树形高分子,加入0.369 mL K2PtCl6,室温条件下磁力搅拌后充分反应24 h。在该溶液体系中加入0.369 mL NaHB4,充分反应2 h。将溶液转移到双蒸水中透析10 次,每1 h 换水1 次,收集的最终产物保存在4 ℃的环境中。
1.2 光热纳米材料体内外靶向性能研究 称重扁圆柱体的人工纳米骨片,骨片的主要成分是羟基磷灰石,骨片的直径10 mm、高2.5 mm。分别配制3 种浓度均为100 μmol/L 的G5‐NH2‐AC‐Pt、G4.5‐COOH‐Pt、G5‐NH2‐Pt 溶液,将纳米人工骨片浸泡其中24 h 后,取出骨片,浸泡于离子水中30 min,随后在室温环境中自然蒸干。取等量王水,将蒸干的骨片溶于王水中,利用电感耦合等离子体质谱(ICP‐MS)进行铂含量的测定。取20 μL 的MDA‐MB‐231‐Luv 细胞悬液和平均体重为20 g 的4 周龄雌性裸鼠,将悬液注入裸鼠后肢胫骨骨髓腔中。注射3 周后,通过生物活体荧光成像仪验证裸鼠胫骨的肿瘤模型建立情况,将肿瘤模型建立成功的裸鼠选取18 只,分为3 组,每组6 只。分别向3 组小鼠注射50 μL 的G5‐NH2‐AC‐Pt、G4.5‐COOH‐Pt、G5‐NH2‐Pt 溶液,并在12 h 后各处死3 只,24 h 后再处死3 只。从处死后的裸鼠中取下心、肝、脾、肺以及胫骨等进行称重,将器官组织研磨后溶解于2 mL 的王水中,溶解后稀释100 倍,并利用ICP‐MS 来测量组织中的铂含量。
1.3 纳米材料的骨靶向光热治疗技术的裸鼠转移性骨肿瘤治疗实验 在培养基中添加10%的青霉素、链霉素、胎牛血清(FBS),培养出MDA‐MB‐231‐Luc 的乳腺癌细胞,根据细胞的生长需要提供一个良好的生长环境,并定期进行液体的更换,在48 h 内进行传代培养。当乳腺癌细胞数量能够满足此次实验所需后,就将细胞进行消化和离心,从而将上清液分离出来,随后用PBS 洗涤两次,后得到PBS 的悬重溶液,对溶液进行定容,确保20 μL 有细胞2×105。接下来构建裸鼠胫骨肿瘤模型,选取前面培养的4 周龄裸鼠,经过气体麻醉之后,将后肢胫骨和股骨弯曲成为90°,注射入20 μL MDA‐MB‐231‐Luc 细胞PBS 悬液。注射完成后,利用乙醇再次进行局部消毒,放置在37 ℃的控温台上,加快裸鼠的苏醒时间,裸鼠苏醒后给予正常喂养,观察各组裸鼠的生存状况和生理变化情况。经过3 周时间的喂养后,利用活体荧光成像了解各组的胫骨肿瘤正常情况。
选取25 只荧光量接近相似的裸鼠进行实验,共5组,每组5 只裸鼠。治疗实验开始后,针对不同分组的裸鼠进行不同的处理。①G4.5‐COOH 组:进行尾静脉注射,不进行光照治疗。②G4.5‐COOH+NIR 组:尾静脉注射后12 h 和24 h 分别进行红外光照射治疗,每次照射10 min,功率密度为5.6 W/cm2。③G5‐COOH+NIR组:尾静脉注射后进行红外光照射治疗,治疗方案同②。④G5‐NH2‐AC+NIR 组:尾静脉注射后进行红外光照射治疗,方案同②。⑤PBS+NIR 组:尾静脉注射PBS 溶液后,接受和②同样的光照治疗方案。根据既有的研究经验,确定治疗疗程为3 个,上次疗程治疗结束后进行下个疗程的尾静脉注射。
1.4 相关性能指标
1.4.1 光热纳米材料的表征指标 在加速电压为100 kV 的条件下,利用透射电镜(TEM)对制备出来的3 种光热纳米材料进行表征观察,包括纳米材料的形貌、尺寸、纳米颗粒大小、计数等。利用电感耦合等离子体质谱进行3 种材料中Pt 浓度的测定和校准,并利用动态光散射仪测定材料的电势和水合半径。
1.4.2 裸鼠疗效及统计分析 在治疗过程中,要实时密切关注所有裸鼠的生存情况,每天需要记录的参数包括体重、肿瘤对应部位周长和肿瘤生长情况等。治疗结束后,利用生物活体荧光显示仪进行裸鼠胫骨肿瘤荧光量的测量、统计和治疗效果的对比。将所有裸鼠处死后离断其肿瘤侧后肢,并进行Micro‐CT 成像。通过三维重建技术分析骨结构的各项参数,包括骨表面积、骨体积、骨小梁数等,最后完整剥离后肢肿瘤,拍照、称量。
1.5 数据统计 统计裸鼠肿瘤前后治疗的荧光量、肿瘤重量、胫骨肿瘤周长、体重、结构参数等数据,利用Student's‐t进行统计学分析。
2 结果
2.1 超小光热纳米材料的表征 将PAMAM 作为树形高分子单分散模板以及稳定剂,加入适量的K2PtCl6后使其充分反应,随后加入10 倍过量NaHB4进行Pt离子的还原反应后收集产物,从而得到铂纳米光热材料。为了能够验证所得产物材料的骨靶向性能,不断调整PAMAM树形高分子的最外层基团,以获取得到3种不同的光热纳米材料,合成G5‐NH2‐AC‐Pt、G4.5‐COOH‐Pt、G5‐NH2‐Pt。3 种不同的纳米光热材料都有着相似的形貌和均一尺寸。见图1。3 种光热纳米材料的直径都在1~2 nm,水合直径在10 nm 左右。见图2。
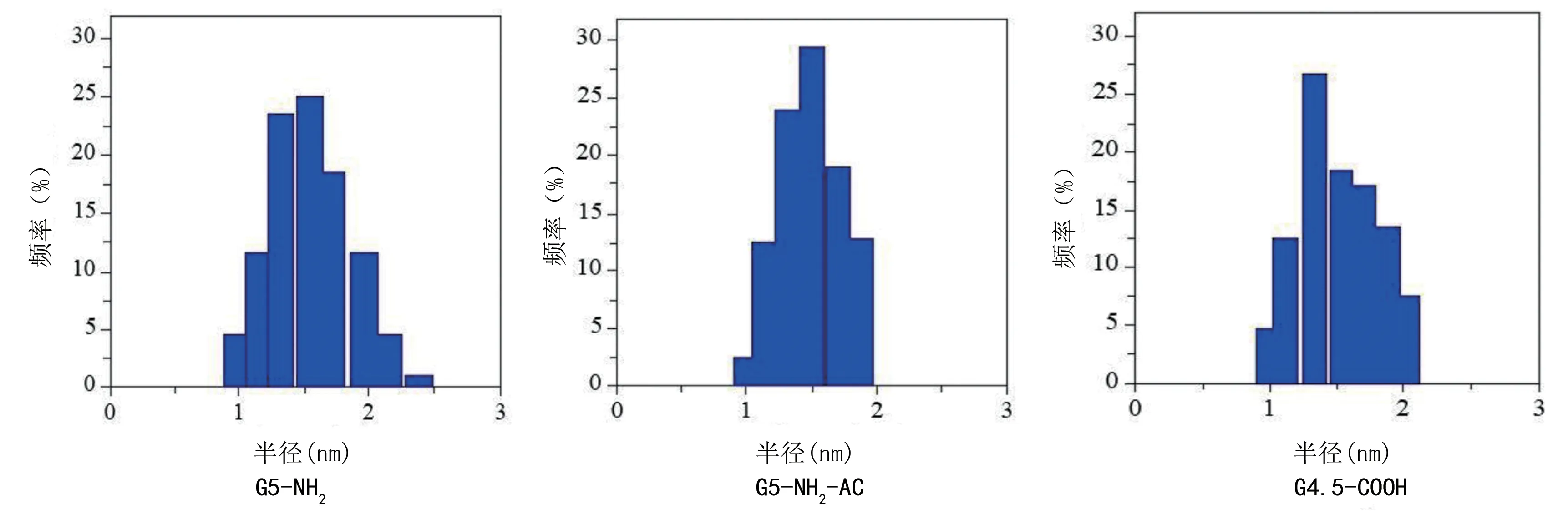
图1 3 种超细光热纳米材料的尺寸

图2 3 种超细光热纳米材料的水合直径
G5‐NH2、G5‐NH2‐AC、G4.5‐COOH 的电势分别为(-38.3±2.8)mV、(12.9±1.2)mV、(-42.4±1.5)mV。见图3。
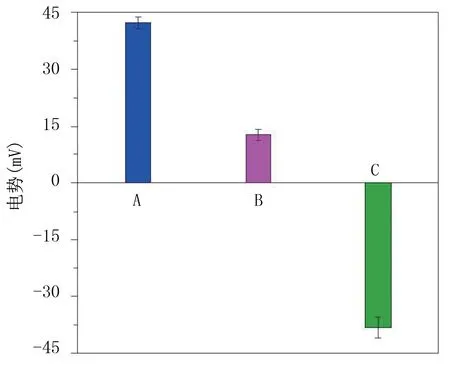
图3 3 种超细光热纳米材料的电势
2.2 纳米材料的骨靶向性能、光热性能研究 将人工骨浸泡在不同的材料溶液之中,可以显著看出,浸泡在G4.5‐COOH‐Pt中的骨颜色显著加深了,证明其吸附纳米人工骨材料的含量是最高的。将人工骨进行研磨,发现浸泡在G4.5‐COOH‐Pt 中的纳米人工骨中铂的含量是最高的,大概是其他材料的4.3 倍,差异具有统计学意义(P<0.05)。具体见图4。在体内分布实验中,分别测量裸鼠体内12 h和24 h的铂含量,具体见图5、图6。
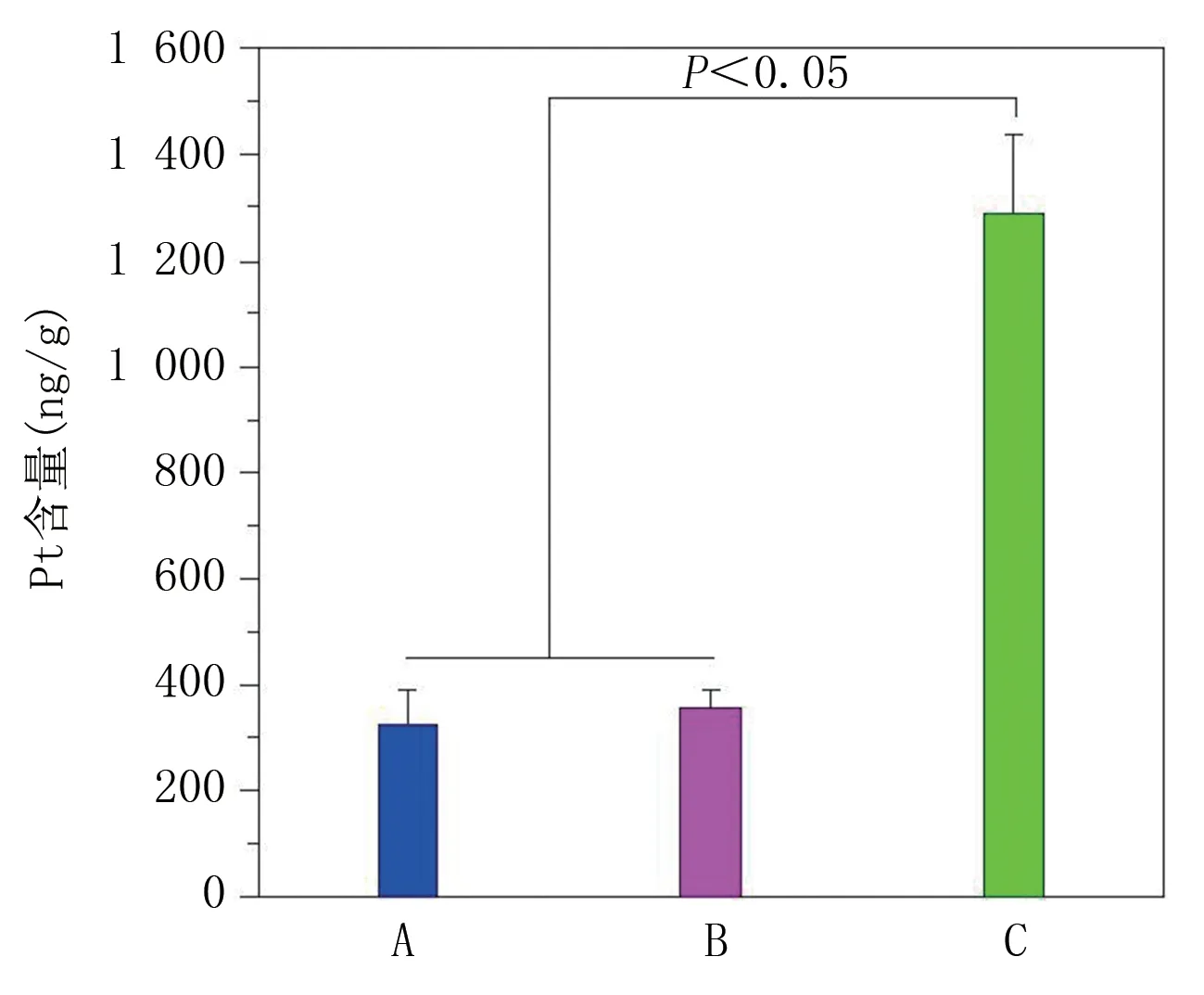
图4 浸泡于不同光热纳米材料溶液中人工骨的Pt 含量
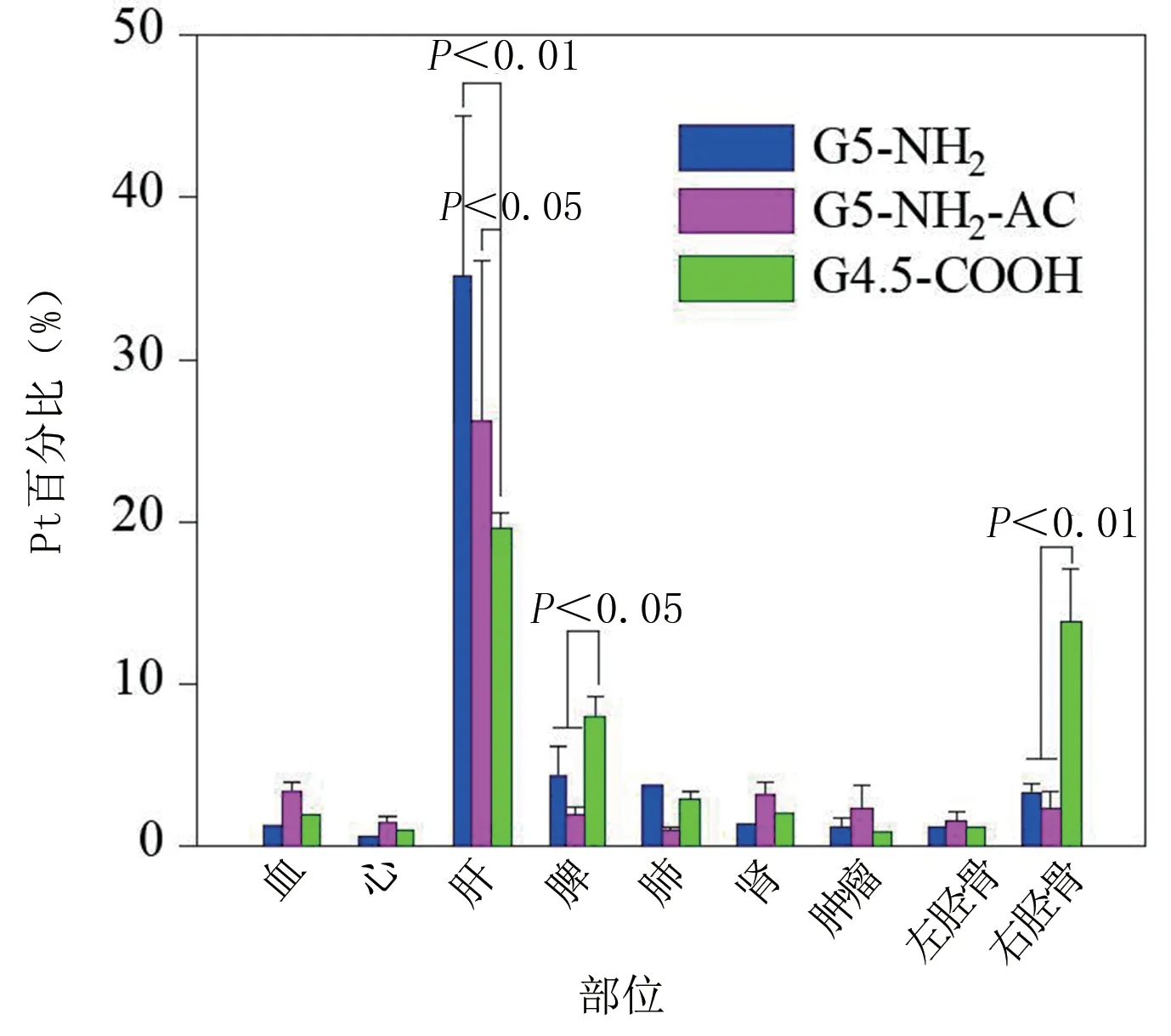
图5 体内分布实验12 h 后Pt 含量对比图
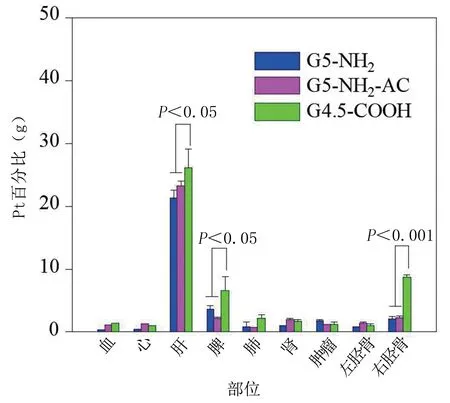
图6 体内分布实验24 h 后Pt 含量对比图
从图中可以看出,不同的脏器中,含量最高的是肝脏,这是由于大部分材料都聚积在肝脏中。在12 h 时,肝脏内的G5‐NH2‐Pt 含量是最高的;24 h 时,肝脏内G4.5‐COOH‐Pt 的含量最高。在近红外光照射作用下,3 种光热材料都有效升温,且升温曲线几近重合,见图7。从图中可以看出,G4.5‐COOH‐Pt 材料吸附的骨片升温是最快的,在照射后的1 min 内就上升到45 ℃,最高温度在70 ℃左右,远超过其他材料。对光热纳米材料的细胞毒性试验结果显示,MDA‐MB‐231 细胞在孵育48 h 后,材料浓度为300 μmol/L 培养环境中,G4.5‐COOH‐Pt 和G5‐NH2‐AC‐Pt的细胞存活率在90%以上,但是G5‐NH2‐Pt 的存活率只有80%。
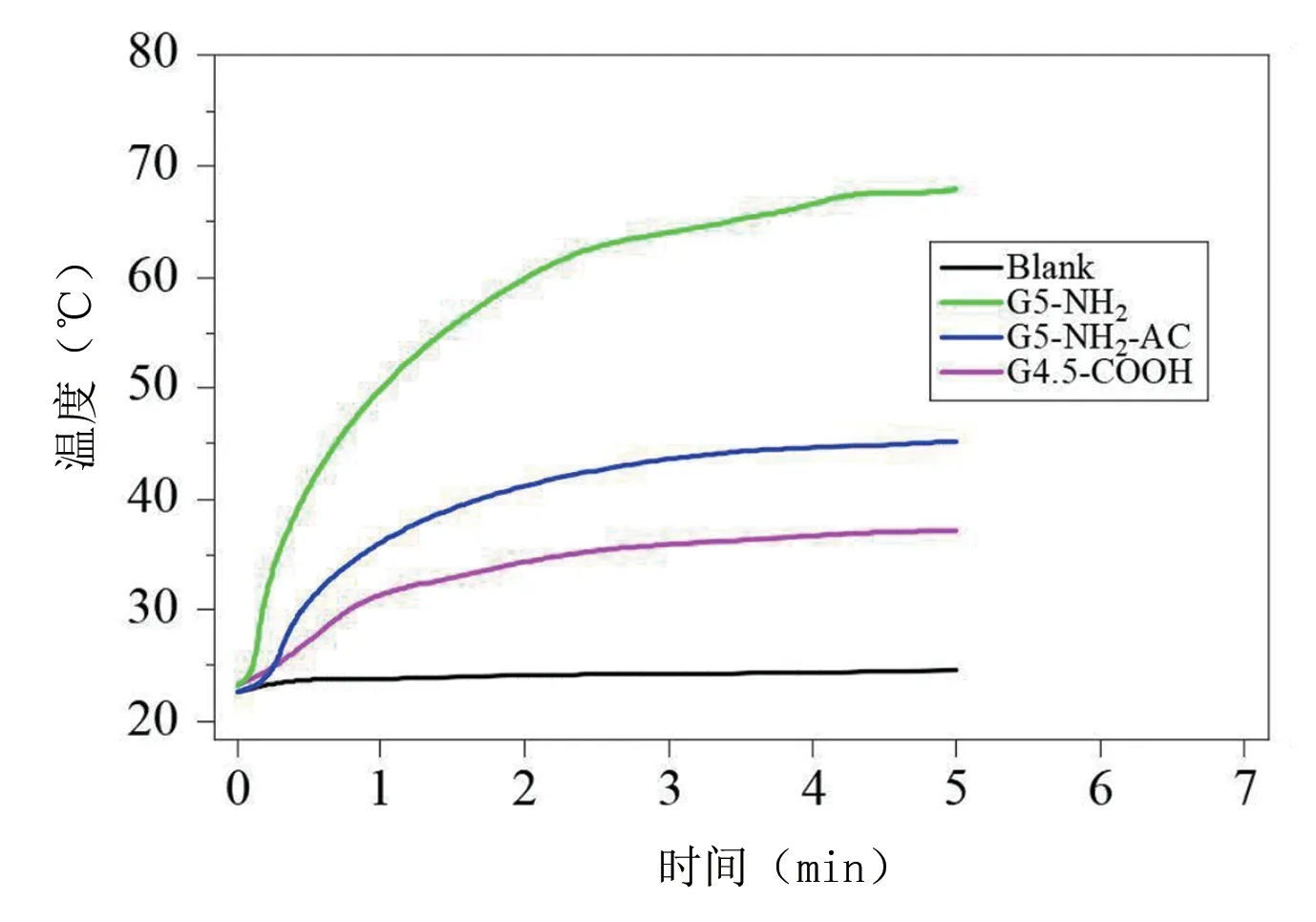
图7 不同材料的体外光照实验的升温曲线图
2.3 纳米材料裸鼠体内光热治疗胫骨肿瘤G 4.5‐C O O H+N IR 组、G 5‐N H2‐A C+N IR 组、G5‐NH2+NIR 组、PBS+NIR 组、G4.5‐COOH 组治疗后荧光量相较于治疗前的荧光量约是2.5 倍、12.5 倍以及15.0 倍。进一步分析可以看出,G4.5‐COOH+NIR组治疗效果显著,差异具有统计学意义,其余各组差异无统计学意义。见图8。

图8 各组肿瘤在治疗前后的荧光量对比情况
在治疗过程中,要持续观察裸鼠的生存情况,同步记录肿瘤的发展情况,详细记录裸鼠胫骨肿瘤的最大周长和体重,具体结果见图9 和图10。从图9 可以看出,G4.5‐COOH+NIR 组相较于其他4 个组的肿瘤周长最小,增长程度也低于其他4 个组,且差异有统计学意义,其余各组差异无统计学意义。各个组的裸鼠体重变化不大,且组间差异无统计学意义,见图10。
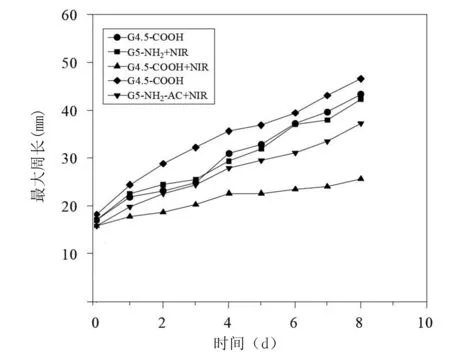
图9 裸鼠胫骨肿瘤的最大周长变化趋势图
图10 裸鼠体重的变化趋势图
从裸鼠治疗前后的肿瘤平均重量结果可以看出,肿瘤平均重量最轻的是C4.5‐COOH+NIR 组,该组肿瘤的平均追踪量在0.2 g 左右,均小于其他各组的平均肿瘤重量,差异具有统计学意义(P<0.05)。见图11。
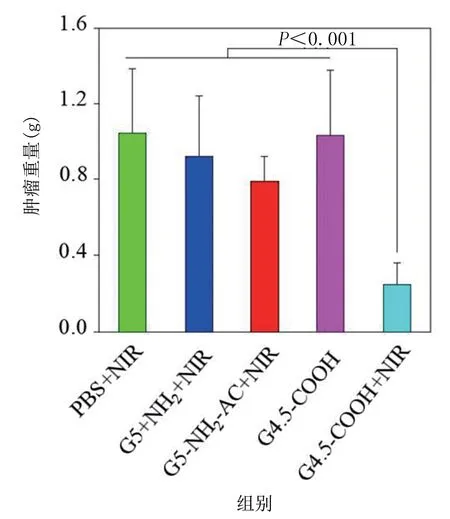
图11 裸鼠胫骨肿瘤的重量对比情况
利用Micro‐CT 进行骨参数的定量分析,得到各组裸鼠的平均胫骨体积、表面积、骨小梁数量和间隔。通过分析可以看出,G4.5‐COOH+NIR 组胫骨体积、表面积和骨小梁数量都要显著大于其他4 个组,且差异具有统计学意义(P<0.05);而平均骨小梁间隔则要显著低于其他4 个组,差异具有统计学意义(P<0.05)。在治疗过程中,所有裸鼠组均未出现死亡的情况。见图12~图15。
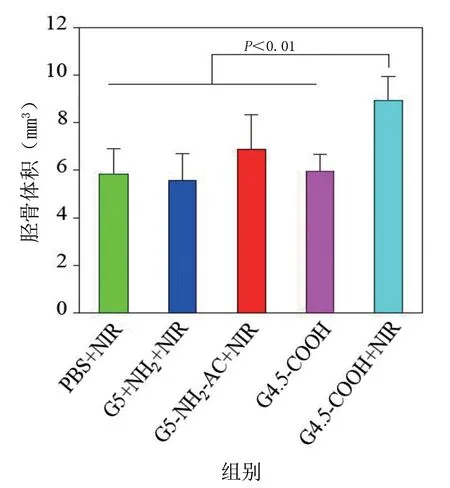
图12 治疗后各组裸鼠的胫骨体积
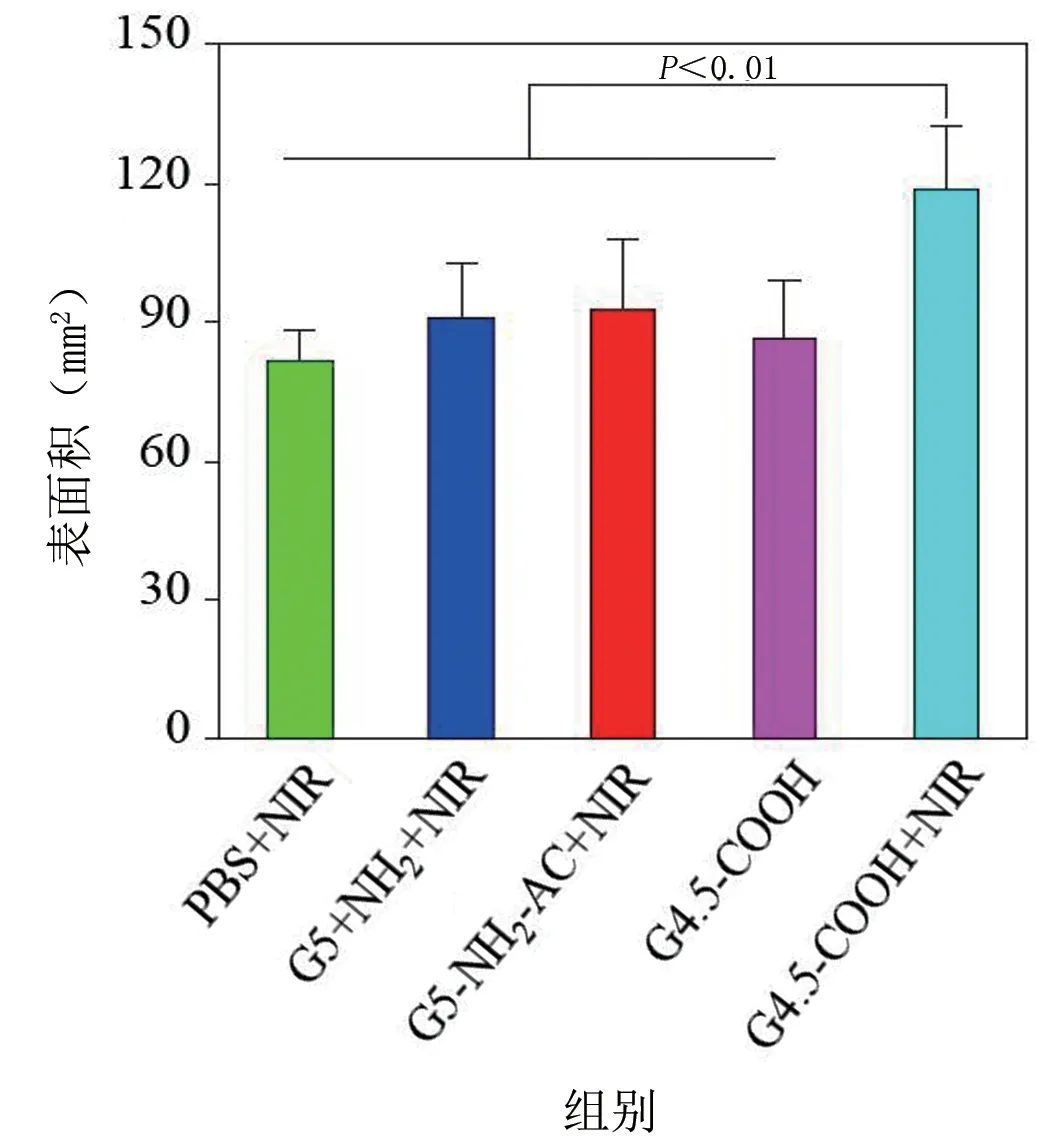
图13 治疗前后各组裸鼠的胫骨表面积
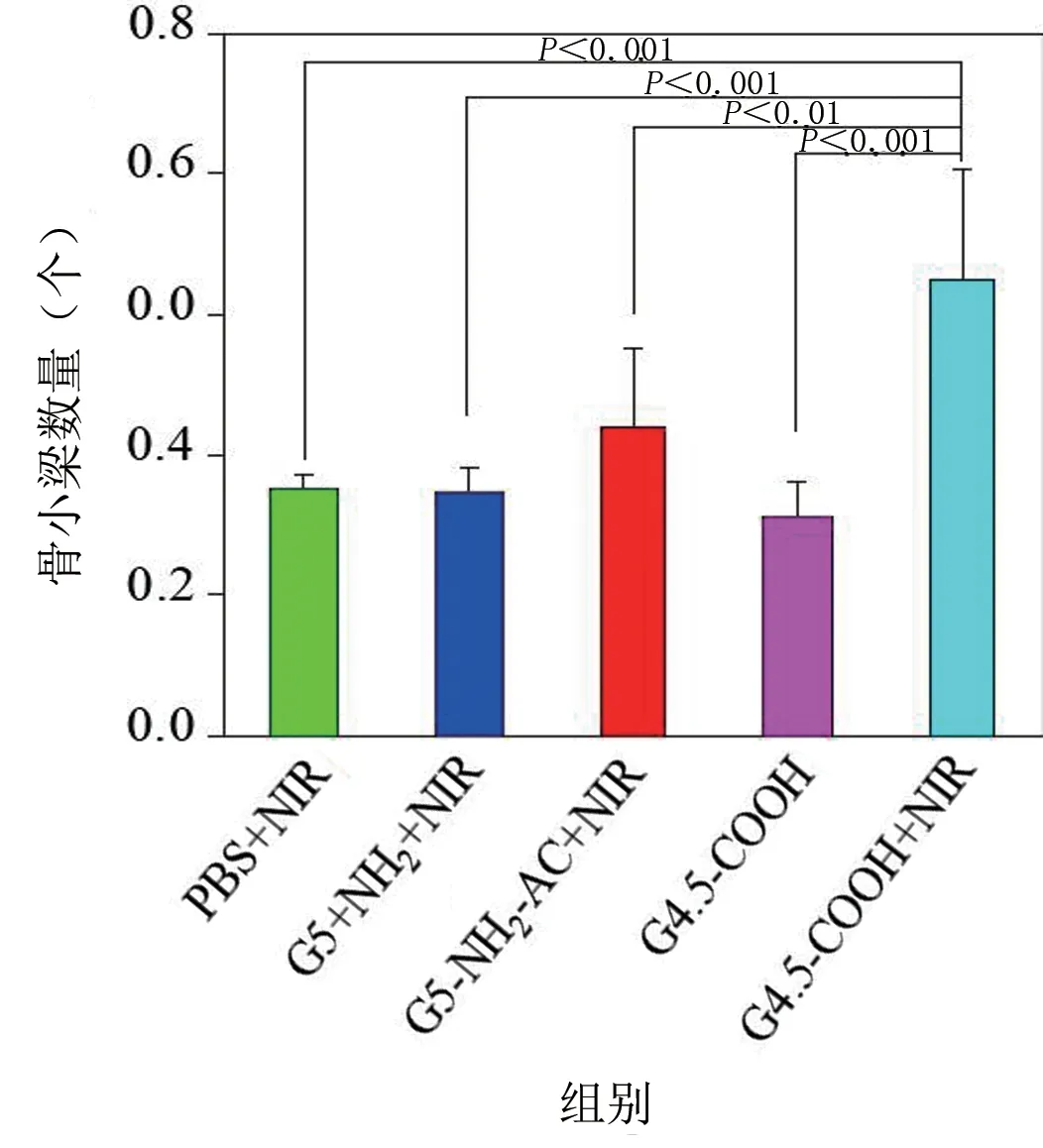
图14 治疗后各组裸鼠的骨小梁数量

图15 治疗前后各组裸鼠的骨小梁间隔
3 讨论
3.1 超小光热纳米材料的表征 PAMAM 树形高分子具有十分规则的球形外观,是一种具有树的拓扑结构的大分子,有着大量的表面功能基团,单分散性良好。由于其独特的结构特点,这种高分子纳米材料已经广泛应用于电化学、污染治疗、光化学、催化剂、传感器等各个方面,特别是在高分子材料中的应用,已经成为生物医学领域的明星高分子材料[7]。PAMAM 树形高分子材料是一种三维球形结构,内部是空腔,该材料的增长过程就是单元重复后不断进行几何增长的过程,每次增长和新一代的生成说明其有更多1 层的树状结构,对应的分子尺寸也会快速增长,包括分子表面功能基团与分子空腔都会相应增长[6]。人们可以利用PAMAM 这一特点连接叶酸、生物素等靶向分子。在内部空腔中为了能够连接药物分子,不同的树形高分子有着不同的末端功能团,常规情况下,整代树形高分子都是羟基或羧基,而半代属性高分子如G4.5 则可以是羧基。本研究就是利用PAMAM 材料的特点制备超小纳米材料,基于其内部空腔和表面功能基团实现高分子人工合成纳米材料的多功能潜能,制备带有不同电荷的纳米材料,以进一步研究材料的骨靶向性能[8]。
作为一种常见的氧化还原反应催化剂,铂纳米颗粒在食品添加剂和化妆品中广泛应用,也可以用作肿瘤细胞清除中的活性氧。在肿瘤的光热治疗之中,铂纳米颗粒有着很高的光热转化效率,毒副作用也非常低,因而适用于制作生物相容性更好的铂纳米颗粒光热元件[9]。一般情况下,金属纳米粒子会利用浓缩法和乳液挥发法进行合成,在表面活性剂、高分子等稳定剂辅助作用下,可以进行金属离子的电化学还原反应,通过添加稳定剂,可以阻止颗粒的团聚,以控制纳米颗粒尺寸[10]。但是,这同样会钝化纳米簇表面,影响到纳米颗粒的自身功能。选择反交束方法或多孔模板时,在模板不移除情况下,进行纳米颗粒的合成制备,这会导致纳米材料的大部分表面出现钝化,不但会导致纳米颗粒裸露,还会出现缓慢的团聚反应[11]。在此次的研究中,利用PAMAM 树形高分子进行铂纳米颗粒的合成,在合成过程中,PAMAM 树形高分子是稳定剂及单分散模版,合成的铂纳米颗粒尺寸可控且稳定分散,最终合成制备了具有自身骨靶向能力的多功能超小铂光热纳米材料。
3.2 纳米材料的骨靶向性能、光热性能 在进行骨肿瘤的光热治疗中,骨靶向性是确保疗效且降低毒副作用的关键保障所在。只有材料具有显著的特异性,才能够实现组织的局部药物聚积,既有的研究中,为了实现纳米颗粒的骨靶向性,许多研究都利用双磷酸盐中阿仑膦酸钠与骨重构界面的特性[12]。在本研究中,选择4.5 代末端基团PAMAM 树形高分子,使得纳米高分子材料带有负电荷(G4.5‐COOH‐Pt)。在癌细胞的作用下,骨组织会出现一定程度的缺损,在缺损部位的周围会发生羟基磷灰石的水解作用,这时阴阳离子扩散系数会产生一定的差异,这种差异进一步体现在离子浓度的差异上,形成局部的电场,在电场作用下,纳米材料会向骨缺损处移动并结合[13]。在进行纳米材料的骨靶向性能研究时,一般都会同时进行体内及体外两方面的实验,以了解纳米材料的骨靶向性能。动物骨组织主要由羟基磷灰石组成,利用含有大量羟基磷灰石的纳米人工骨能够更好地反映真实的生物体内骨组织,来验证体外骨吸附能力。通过肉眼对骨片颜色深度的判断可以看出不同材料的吸附作用,而定量检测分析结果也显示,骨片中吸附量最多的是G4.5‐COOH‐Pt,进一步与其他两种材料的吸附量对比分析可以看出,G4.5‐COOH‐Pt 的吸附量是其他的4 倍以上,可以看出该种材料所具有的良好骨结合能力[14]。在临床病症中,骨肿瘤会不断破坏正常的骨及周围组织,有着很强的溶骨性,当这种破坏达到了相当的程度后,病人就会出现显著的骨缺损。骨缺损靶向材料可以实现高分子与骨缺损病灶处进行有效结合,从而实现光热治疗的高疗效,减轻毒副作用。
在近红外光照作用下,此次合成的3 种纳米材料都展现了相似的光热性能,这是由于它们的光热成分都是铂纳米颗粒,说明了铂纳米颗粒具有良好的光热效能。通过对比升温实验可以看出,G4.5‐COOH‐Pt表现出更为优异的光热转换性能,其升温的速度和所能够达到的最高温度都要远高于其他两种材料。这是由于经过材料浸泡后,G4.5‐COOH‐Pt 浸泡过的骨片含有更多铂纳米颗粒,可以实现更快的升温从而达到更高的温度,可以推断出利用光热进行骨肿瘤的治疗时,G4.5‐COOH‐Pt 能够取得较好的治疗效果。综合分析可以看出,此次合成的3 种人工纳米光热纳米材料都有一定的光热性能和生物相容性,但是差异性显著,其中G4.5‐COOH‐Pt 具有很好的骨缺损靶向能力。3.3 基于纳米材料的骨靶向光热治疗技术及预见性临床护理 利用动物实验进行骨肿瘤治疗效果的研究是当前研究的一个重点,其难点之一就是要成功构建胫骨肿瘤的动物模型。当前,一般采用局部注射法、血流散播法和原位移植法来构建骨转移动物模型。局部注射法具有成瘤部位固定和创伤小的特点,因而在此次的实验中选取该种方法进行研究,实验的过程和结果也证明了这种方法的有效性和实用性[15]。血流散播法是直接利用静脉注射将肿瘤细胞注入动物体内,并由血液流动进行播散,但是这种方式形成骨转移瘤的概率较低,而且容易转移到别处的脏器。相较于血流散播法,原位种植法的成功概率高得多,但是当进行小动物实验的时候,就面临着操作繁琐的困难,无法开展大规模小动物的肿瘤模型构建[16]。
通过裸鼠骨肿瘤种植及治疗实验可以看出,通过G4.5‐COOH+NIR 组和G4.5‐COOH 组的对照可以看出G4.5‐COOH‐Pt材料的光热性能,通过G5‐NH2‐AC+NIR 组 和G5‐NH2‐AC 组验证了G4.5‐COOH‐Pt 材料的骨靶向性能。在采用光热治疗后,裸鼠的骨肿瘤部位荧光量有着显著的变化,通过对比肿瘤最大周长的变化、体积变化、称量等来客观进行治疗效果的评价。通过对裸鼠组治疗前后各项参数的变化可以看出,G4.5‐COOH+NIR 组在肿瘤的重量、最大周长以及荧光量上都显示有更好的治疗效果,差异具有统计学意义。此次的实验验证了G4.5‐COOH 所具有的良好靶向能力,在光热作用下,与裸鼠胫骨缺损部位结合的铂纳米颗粒会大量集聚,利用光热转换效能实现升温,升温速度更快,光热治疗的效果更为显著。一般情况下,当皮肤的局部温度达到46 ℃及以上时,就会出现灼伤的情况,因此此次将光照功率控制在5.6 W/cm2进行照射,从而在保证治疗效果的前提下避免对皮肤造成灼伤,减轻副作用。在相同的环境之下,其他各组材料虽然也具有一定的骨靶向性,但是其性能较低,这就使得骨缺损部位的铂含量不足,温度难以突破42 ℃,肿瘤的治疗效果非常有限。综合分析可以看出,G4.5‐COOH+NIR 组的治疗效果最好,在消灭肿瘤细胞的同时,能够避免骨破坏的发生,证明了G4.5‐COOH+NIR 材料是一种具有骨靶向能力的超小光热纳米材料,可以应用于骨肿瘤治疗中。
相较于传统的手术治疗,光热治疗具有无创伤的优点,在临床护理中也有着非常显著的优点。传统手术治疗需要进行术前和术后的持续跟踪护理,护理难度大、护理范围广、涉及的护理专业知识也多。若开展光热治疗,进行预见性护理仅需要进行病人日常的临床护理及心理干预即可[17]。由于无创伤,仅需要利用光热治疗即可达到显著的治疗效果,病人的心理状态易于调整,在临床护理中可及时了解病人的心理状态,开导病人可能出现的心理困惑。传统的手术治疗要进行术前的健康教育和预处理等,术后需要进行生命体征观察、出血预防护理、饮食管理等。基于纳米材料的骨肿瘤光热治疗的临床护理,更有利于护理人员开展护理工作,但需要真正临床实践才可以得到验证。
