麝香酮对大鼠脊髓损伤的保护研究
2020-09-10郭亮桂菲李睿夫于超罗远盟
郭亮 桂菲 李睿夫 于超 罗远盟








【摘要】目的:研究麝香酮对大鼠脊髓损伤有无保护作用。方法:将大鼠随机均分为5组:生理盐水组、甲基强的松龙组、MO1、MO2、MO3组。采用改良艾伦法建立大鼠脊髓损伤模型。大鼠给予麝香酮(MO1:2.5mg/kg,MO2:5mg/kg,MO3:10mg/kg)或甲基强的松龙(MP:30mg/kg)或等量的生理盐水。连续观察4周,ELISA法检测SOD、MDA、IL-1β,HE、nissl染色进行病理学观察。结果:不同浓度的麝香酮对免疫炎症反应、神经元坏死和凋亡均有抑制作用,MOX组下肢功能恢复优于NS组和MP组。MO2比其他组更显著。结论:麝香酮具有抗炎、抗凋亡作用,可减轻脊髓损伤后继发性损伤,为大鼠神经再生提供有利条件。
【关键词】抗炎药;星形胶质细胞;胶质纤维酸性蛋白;脊髓损伤
【中图分类号】R 【文献标识码】A 【文章编号】2026-5328(2020)11-027-04
创伤性脊髓损伤(SCI)的发病率有逐渐升高的趋势[1]。SCI及其继发性损伤可直接导致神经功能损伤,出现不同程度的功能障碍,并且脊髓损伤治疗困难[2],因此致残率与致死率非常高,不僅患者带来不便和痛苦,也给社会和家庭带来了沉重的负担[3]。目前SCI的治疗仍是医学的一大难题,SCI的实验研究也是医学研究的热点。
本实验中观察麝香酮对急性脊髓损伤大鼠脂质过氧化产物MDA、SOD、炎症因子IL-1B及病理学及行为学进行观察统计分探讨麝香酮对神经元及星形胶质细胞在抗炎方面的作用。
1实验动物
清洁级SD(Sprague-Dawley)雌性大鼠120只 (由重庆医科大学实验动物中心提供)。随机分成五组,生理盐水组(NS组)、甲基强的松龙组(MP组)、麝香酮注射液尾静脉注入组(MO组分3小组:MO1-3组)。MO1组、MO2组、M03组为脊髓损伤后立即分别从尾根静脉注入2.5mg/kg 、5mg/kg、10mg/kg的麝香酮,持续7天;MP组术后立即注入30mg/kg的甲基强的松龙;NS组则注入等量生理盐水。
2建立大鼠急性脊髓背侧损伤模型(Allen's法[1])
用4%水全氯醛,以0.35ml/kg行腹腔注射麻醉。其俯卧位固定,腰背部脱毛,典伏消毒铺巾,以T9棘突为中心作长约2.5cm切口,显露棘突及椎板,咬除T8-9棘突及全椎板,显露脊髓,采用Allen氏重物坠落装置撞击脊髓背侧,即将质量为10g的重锤从距脊髓2.5cm高度垂直沿中空钢管垂直自由落下撞击硬脊膜密切接触,直接传递给脊髓。(图1)
3取材
在相应时间点(术后3h、8h、1d、3d、1w、2w),每组随机取3只动物,麻醉动物后在大鼠的外眦取血约1ml。孵化、离心后吸取于PV管内立即放于-20度的冰箱在检测时取出。采用酶联免疫吸附剂测定对脂质过氧化产物丙二醛(MDA) 、超氧化物歧化酶(SOD)及白介素1β (IL-1β)。
4统计
采用SARS9.0统计软件包进行分析,所有数据以表示,组间比较采用单因素方差分析,P值<0.05为有统计学意义。
5 结果
5.1成功了急性脊髓损伤模型
采用Allen’S法成功建立了急性脊髓损伤模型(打击脊髓后鼠尾痉挛性摆动数次,双下肢及躯体回缩样扑动,后双下肢呈弛缓性瘫痪,大鼠麻醉苏醒后双下肢无活动,均需每天人工挤尿两次)(图1a/b)。
5.2 酶联免疫吸附剂测定(ELISA)
5.2.1 SOD检测
从建模后3小时至1周,NS组SOD出现下降趋势,从180.87ng/L 降到152.85ng/L,在2周时出现上升达175.93ng/L。MP组与麝香酮处理的3个组,明显高于NS组,都从3小时逐渐上升,在术后3天达顶峰,以MO3组最为明显达289.45ng/L。后出现下降在2周时最明显,以MO1组最达184.38ng/L,MP组次之。(图2)
5.2.2 MDA检测
从建模后3小时至1周,NS组MDA缓慢上升趋势,从3.6ng/L 升到4.37ng/L,在2周时出现下降达4.18ng/L。MO1和MO2在从术后3小时至3天出现了上升趋势,较其它3组低,以MO2最低,从2.35 ng/L升至3.13 ng/L,后出现了缓慢下降,以MO2下降最低,达2.28 ng/L。(图3)
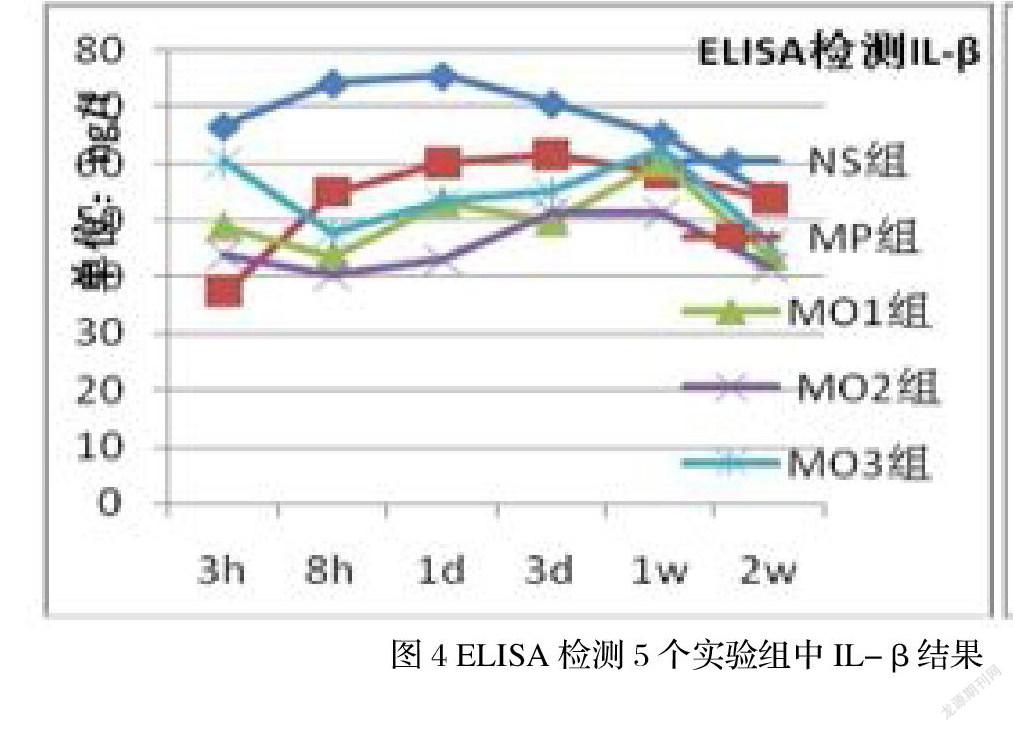
5.2.3 IL-1β检测
从术后3小时至1天,NS组IL-β出现缓慢上升趋势,从66.59ng/L 升到75.55ng/L,在2周时缓慢下降53.75ng/L。其余四组在同一时间点较NS组低,3小时MP组最低为37.34 ng/L;2周时MO2组最低,1周时达顶峰,以MO3组相对最高,达62.49 ng/L(图4)。
5.3病理学检查
5.3.1 HE染色法
在建模后8小时400倍光镜下能见以生理盐水组红细胞最明显,甲强龙组次之,在麝香酮5mg组出血较少。1天时组织溶解明显,从重到轻的顺序为生理盐水组,甲强龙组,麝香酮2.5mg组,组10mg组,麝香酮5mg组。3天时,生理盐水组脊髓组织溶解,形成空洞;麝香酮2.5mg组出现了空洞,并增生出现,但较生理盐水组好。一周、二周时脊髓组织广泛胶质细胞增生,同一天的顺序。四周时脊髓组织胶质细胞增生甲强龙组仍见散在的小的空洞存,在3个剂量麝香酮所处理的脊髓空洞基本消失,为胶质细胞所充填(图5-6)。
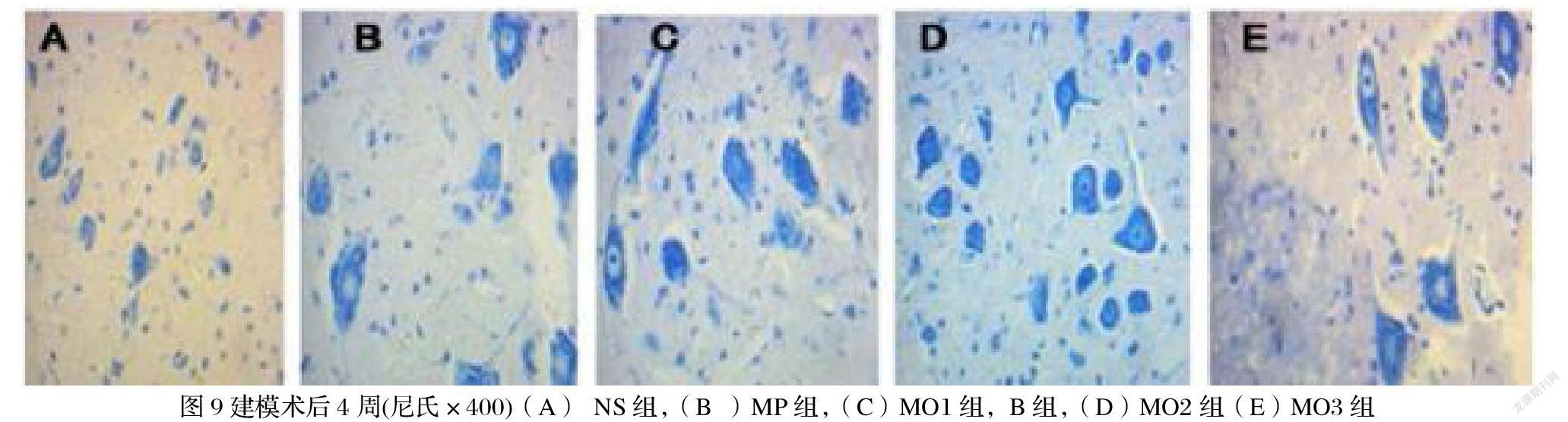
5.3.2尼氏染色(Nissl染色法)
在400倍光镜下8小时五个实验组不同程度的出现的胶质细胞增生,生理盐水组较多,较小的神经元。1天时胶质细胞出现增生,生理盐水组明显,甲强龙组次之,麝香酮以5mg组增生较少,多个较小的神经元。3天时麝香酮处理的3组胶质细胞增生较前两组少,在这三组中以5mg组较少。一周时胶质细胞明显增生,生理盐水组最多,麝香酮处理的3组胶质细胞增生较前两组少,5mg组较少,各组可见多个较小的神经元。两周时生理盐水组胶质细胞显著最多,以2.5mg组增生明显。四周胶质细胞增生5mg组较少,各组可见多个较小的神经元(图6-7)。
5.4行为学评分
由两名医师同时在建模后1d,3d,1w,2w,4w时观察,采用BBB评分方法进行独立评分,最后取平均值作为评分值。术后第1天,双下肢功多处0级,随后双下肢功能逐渐改善,NS组在4周时达8.2,MP组达13.6,麝香酮处理后三组改善明显优于甲强龙组与生理盐水组,MO2组恢复最明显,在2周时达10.0,4周时达18.6(图8)。
6 讨论
6.1 脊髓损伤后继发性损伤的病理生理
自Allen[1]提出SCI 理论以来,人们对其损伤病理机制治疗进行了大量深入的研究,脊髓损伤是由原发性损伤机制和继发性损伤机制介导[2-3]。脊髓损伤中心区出现坏死,神经细胞损伤后,其轮廓能保持约6-8小时,至24小时左右基本崩解,在损伤中心区边缘出现细胞的凋亡[4]。从数小时到数周内,启动一系列细胞和分子水平的生化级联反应,导致组织缺血、细胞死亡、轴突脱髓鞘以及胶质细胞丧增生、胶质瘢痕形成等继发损伤。脊髓组织微循环障碍,细胞膜及细胞器损伤,离子通道失控,出现钙内流,引起自由基反应及其介导脂质过氧化反应,并引起溶酶体及线粒体的破裂,释放SOD、MDA等[5-7] ,細胞功能障碍并最终死亡[8-9]。脊髓损伤也起发免疫炎症反应,诱导释放大量炎症因子如IL-1β等,使免疫、炎症反应进一步的加重[10];后期特别是大量活化胶质细胞聚集,形成胶质纤维及疤痕时阻止了神经的生长,导致脊髓功能的障碍[11]。
麝香酮抗炎作用非常确切,并通过血脑屏障[12-13]。它使单核细胞CD54分子表达及可溶性血管细胞黏附分子水平有明显的降低,脑梗死炎症反应得到明显的抑制,提高了疗效[14]。麝香酮对谷氨酸所致PC12细胞还原能力提高,抑制该细胞LDH的释放,提高细胞存活率;抑制钙内流;降低PC12细胞的凋亡[15]。中、低剂量的麝香酮能减少对氯胺酮麻醉后乳鼠海马神经元凋亡[16]。麝香酮有类皮质激素的抗炎作用,同时无激素的副作用,安全可靠,以及能够通过血脑屏障,并对神经细胞有保护作用[17]。
6.2 观察指标的分析
在生理盐水组建模后SOD处较低的水平,并逐渐下降,MDA出现了上升,在一周时达顶峰,2周有所下降;麝香酮能明显降低MDA,提高SOD的产量,并优于甲强龙,在剂量上以5mg效果最明显。脊髓损伤引发免疫、炎症反应,并释放大量炎症因子。IL-1β在生理盐水组出现缓慢上升,1天时达顶峰,在2周时出现下降。麝香酮处理的3个组在两周时以MO2组最低。这说明麝香酮与甲强龙有类皮质激素的作用,表现出较强的抗炎作用[18]。
6.3病理学及免疫组织化学
损伤后脊髓组织出血、消肿、固缩及坏死溶解相继发生,并在炎症因子及免疫反应下出现单核、巨噬细胞的浸润、聚集,打击区下方与中央管间出现了空洞,HE染色证实了上述的病理改变。尼氏染色提示:神经元尼氏小体都出现了不同程度肿大明显、碎裂或分布不均,及卫星现象。HE、尼氏染色都提示胶质细胞的增生。以生理盐水组是改变最明显,坏死明显,空洞的扩大、神经元结构消失大,及增生的胶质细胞,甲强龙组次之。3个剂量麝香酮所处理的脊髓病理改变较轻,以麝香酮5mg/kg损伤最小,提示麝香酮处理的3组后炎症反应被抑制,神经元的坏死及凋亡也被抑制,胶质细胞增生被得到控制。抑制了胶质细胞的增生和肥大[19]。而甲强龙对细胞凋亡作用不明显,对改判神经功能无明显的作用[20]。
综上所述,不同浓度的麝香酮对大鼠急性脊髓损伤通过抑制免疫炎症反应,减轻了神经细胞的坏死和凋亡,抑制了星形胶质细胞的过度增生,改判了急性脊髓损伤后双下肢的功能,以5mg/kg剂量效果显著,并优于甲强龙,值得进一步的深入研究。
【参考文献】
[1]Matthew J. Eckert,Matthew J. Martin. Trauma:Spinal Cord Injury. Surg Clin N AM. 97(2017)1031-1045.
[2]Christopher S. Ahuja,Satoshi Nori,Lindsay Tetreault,et al. Traumatic Spinal Cord Injury-Repair and Regeneration. Neurosurgery. 80:S9-S22,2017.
[3]Mourelo Fariña M,Salvador de la Barrera S,Montoto Marqués A,et al. Update on traumatic acute spinal cord injury. Part 2. Med Intensiva. 2017 Jun-Jul;41(5):306-315.
[4]McDonald JW,Sadowsky C. Spinal-cord injury. Lancet. 2002;359(9304):417-425.
[5]Keane RW,Kraydieh S,Lotocki G,Bethea JR,Krajewski S,Reed JC,Dietrich WD. Apoptotic and anti-apoptotic mechanisms following spinal cord injury. J Neuropathol Exp Neurol. (2001)60:422-429.
[6]Christopher Witiw;Michael Fehlings. Acute Spinal Cord Injury. Journal of Spinal Disorders and Techniques. 28(6):202-210,July 2015.
[7]Nakamura M,Houghtling RA,MacArthur L,et al. Differences in cytokine gene expression profile between acute and secondary injury in adult rat spinal cord. Exp Neurol. 2003;184(1):313-325.
[8]Alejandro Rabinstein. Traumatic Spinal Cord Injury. Lifelong Learning in Neurology. 24(2):551-566,April 2018.
[9]Meng Y,Xiao Q,Bai JY,et al. Resolution and chiral recognition of muscone as well as actions on neural system. J Asian Nat Prod Res. 2014 Dec;16:1166-70.
[10]Wang N,Chang GJ,Jin QZ,et al. Analysis of mucone from serum and cerebrospinal fluid of rabbits after intragastric administration of tongqiao huoxue granules. Zhong Yao Cai. 2012 35:1291-4.
[11]Zhenzhen Chen,Xin Gong,Yang Lu,et al. Enhancing Effect of Borneol and Muscone on Geniposide Transport across the Human Nasal Epithelial Cell Monolayer. PLOS ONE. 9(7):e101414,July 2014.
[12]Tevfik Yilmaz,Erkan kaptanoglu. Current and future medical therapeutic strategies for the functional repair of spinal cord injury. World J Orthop
[13]Wang GY,Wang N,Liao HN. Effects of Muscone on the Expression of P-gp,MMP-9 on Blood-Brain Barrier Model In Vitro. Cell Mol Neurobiol. 2015 Nov;35(8):1105-15.
[14]Seiji Okada,Masamitsu Hara,Kazu Kobayakawa,et al. Astrocyte reactivity and Astrogliosis after spinal cord injury. Neuroscience Research. 126(2018)39-43.
[15]Basso DM,Beattie MS,Bresnahan JC,et al. ASCIMS evaluation of open field locomotor scores:effects of experience and teamwork on reliability,Multicenter Animal Spinal Cord Injury Study[J]. J Neurotrauma. 1996;13(7):343-59.
[16]José E,Pereira a,et al. Methylprednisolone fails to improve functional and histological outcome following spinal cord injury in rats[J]. Experimental Neurology. 2009;220(1):71-81.
[17]石永勇,李向宇,秦凱. 麝香酮对氯胺酮麻醉后乳鼠海马神经元凋亡的影响术[J].广东医学.2013,34(11):1645-1645.
[18]Jiang B,Cai F,Gao SH.Induction of cytochrome P450 3A by Shexiang Baoxin Pill and its main components [J]. Chemico-Biological Interactions,2012(195)105–113
[19]Chen ZZn,Yang L,Ying DS,et al.Influence of borneol and muscone on geniposide transport throughMDCK and MDCK-MDR1 cells as blood–brain barrier in vitro model[J].International Journal of Pharmaceutics.2013,456(1):73-79.
[20]Qian-Qian Liang,Min Zhang,Quan ZHou,et al. Muscone protects Vertebral End-plate Degeneration by Antiinflammatory Property[J]. Clin Orthop Relat Res. (2010)468:1600-1610.
作者简介:郭亮副教授/副主任医师,研究生导师,研究方向;脊柱脊髓损伤。
课题研究:课题来源于重庆市科委自然基金(cstc2016jcyjA0299)
作者单位
重庆医科大学附属大学城医院骨科 400300
