微堆发酵普洱茶对人非小细胞肺癌的抑制作用研究
2020-09-10刘展良张慧柔吴晓蓉谭清华李伊琳林忠晓
刘展良 张慧柔 吴晓蓉 谭清华 李伊琳 林忠晓





摘 要:目的:探索微堆发酵法制造的普洱茶对人肺NCI-H1299细胞的影响,为肺癌的预防及辅助治疗提供科学依据。方法:采用微堆发酵法生产普洱茶,并将其提取液作用于人肺NCI-H1299细胞,采用WST-1 细胞增殖及细胞毒性检测试剂盒检测H1299细胞的增殖情况、采用细胞划痕愈合法检测H1299细胞的迁移情况、采用Transwell细胞体外侵袭实验法检测H1299细胞的侵袭能力。结果:微堆发酵法生产出的普洱茶符合国家标准;该普洱茶提取液能有效抑制NCI-H1299细胞的增殖(P<0.01)、迁移(P<0.01)与侵袭(P<0.05),且呈浓度依赖性。结论:微堆发酵法生产的普洱茶能够抑制人非小细胞肺癌H1299的增殖、迁移和侵袭。
关键词:微堆发酵;普洱茶;细胞增殖;细胞迁移;侵袭
肺癌主要分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),其中NSCLC占了肺癌的85%,而那些未得到有效治疗的转移性NSCLC患者的生存期仅有短短的4~5个月,1年的生存率更是低到仅有10%[1-3],NSCLC患者总体的5年生存率仍旧只有15%[4]。
以普洱茶树叶子加工成的生晒毛茶再经过渥堆发酵成普洱熟茶,在加工过程中微生物代谢产生的胞外酶和湿热作用下,产生茶多糖、茶色素、人体必需氨基酸、酶和矿物质,并含益生菌[5-9]。本研究探索微堆发酵方法(30~100 kg生晒毛茶为原料)能否生产出合格的普洱茶,并将该普洱茶汤作用于肺癌细胞,为肺癌的预防保健和治疗提供科学依据。
1 材料与方法
1.1 材料与试剂
普洱生晒毛茶,云南省勐臘县易武山古茶树新稍为原料加工而成(实用新型专利:2017202876680.9);人非小细胞肺癌H1299细胞,广州一骏生物制品有限公司;DMEM培养基,赛默飞世尔(苏州)仪器有限公司;胎牛血清,赛默飞世尔(苏州)仪器有限公司;0.25%胰蛋白酶,江苏凯基生物技术股份有限公司;不含钙离子和镁离子的PBS缓冲液,赛默飞世尔(苏州)仪器有限公司;BD MatrigelTM基底膜基质,北京凯乐思科技有限公司;结晶紫染色液,北京索莱宝科技有限公司;含4%多聚甲醇的通用型组织固定液,武汉赛维尔生物科技有限公司;BSA,江苏凯基生物技术股份有限公司;Transwell检测试剂盒,康宁(上海)管理有限公司;WST-1细胞增殖及细胞毒性检测试剂盒,江苏凯基生物技术股份有限公司。
1.2 仪器与设备
Alrstream Ⅱ级A2型生物安全柜(AC2-6S1型),浩瀚(香港)有限公司;Thermo二氧化碳培养箱(FORMA SERIES Ⅱ WATER JACKET),美国Thermo公司;德国eppendorf低速冷冻离心机(centrifuge5702R型),上海艾研生物科技有限公司;荧光倒置显微镜(EVOS fl型),北京东胜创新生物科技有限公司;正倒置一体荧光显微镜(EchoRevolve型),北京深蓝云生物科技有限公司;恒温水浴摇床(SBS40型),北京诺植科技有限公司;旋转蒸发仪(RE-52AA型),上海亚荣生化仪器厂;美的冰箱(BCD-530WKM),合肥美的电冰箱有限公司;超低温保存箱(MDF-U700VXL-PC型),日本松下健康医疗器械株式会社;全功能微孔分析仪(Mithras2 LB943型),广州云星科学仪器有限公司;德国Memmert高温烘箱(UF260型),瑞轩电子科技(上海)有限公司;万分之一天平(BSA323-CW型),赛多利斯科学仪器(北京)有限公司。
1.3 实验方法
1.3.1 微堆发酵生产普洱茶 以50.0 kg易武生晒毛茶为原料,潮水经45 d微堆发酵,最终得到42.1 kg产品,产率达84.2%。
1.3.2 细胞培养基的配置与实验分组 细胞使用DMEM(1X)高糖培养液[基础DMEM(1X)培养基∶FBS∶双抗溶液=9∶1∶0.1]进行培养,配置后转移至4 ℃冰箱中冷藏备用,使用时37 ℃复温。实验分为试验组与对照组,试验组为H1299细胞+ DMEM(1X)高糖培养液+培养基稀释不同浓度的普洱茶提取液(100%、50%、20%、10%、5%);阴性对照组为H1299细胞+DMEM(1X)高糖培养液;空白细胞对照组为DMEM(1X)高糖培养液。
1.3.3 普洱茶提取液的获取 适量普洱茶于研钵中研磨成茶粉,用千分之一天平称取2.000 g普洱茶粉,倒入500 mL烧杯中,加入250 mL超纯水搅拌均匀,随后放置于微波炉中用中高火加热10 min,取出用干净纱布将茶汤过滤,弃茶渣,随后用旋转蒸发仪减压浓缩,结束后将浓缩的普洱茶提取液转移至250 mL锥形瓶内密封好,巴氏杀菌法在65 ℃烘箱中放置30 min,随后取出立即存放于4 ℃冰箱使普洱茶提取液的温度骤降,达到杀菌目的,留以备用,随后,超净台内再次用0.22 μm针筒式滤膜过滤器过滤除去细菌。
普洱茶水提取液含量(%)=(1 mL普洱茶提取液的质量-1 mL纯水质量)/1mL普洱茶提取液的质量×100%(1)
1.3.4 肿瘤细胞增殖的测定 收集对数生长期的H1299细胞制备细胞悬液,于96孔板中加入H1299细胞,100 μL /孔(约5 000个),放置二氧化碳培养箱中培养24 h,弃旧培养基,并按试验组与对照组的设计要求加入DMEM(1X)高糖培养液及普洱茶提取液,孵育适当时间,加入WST-1细胞增殖及细胞毒性检测试剂(唑盐工作液)10 μL,二氧化碳培养箱中孵育1~4 h。于450 nm波长处检测每孔的吸光度,用OD值表示。将各测试孔的OD值减去空白无细胞OD值,各重复孔的OD值取均数±SD。细胞的存活率以T/C%表示、T为加药细胞的OD值、C为对照细胞的OD值。
细胞存活率(%)=(加药细胞OD/对照细胞OD)×100%(2)
1.3.5 肿瘤细胞迁移的测定 取培养至对数生长期的H1299细胞,用0.25%的胰蛋白酶消化液消化并制备成细胞悬液,进行细胞计数,根据细胞计数结果调整细胞密度为5×105/孔,接种于12孔板中(1 mL/孔),每孔加入1 mL调整好的细胞悬液后,放置于二氧化碳培养箱,贴壁后用1 mL无菌移液头在12孔板内的每孔垂直划痕(近孔中线处),尽量保持每孔的划痕大小一致,随后用PBS磷酸盐缓冲液冲洗2遍,按实验分组加入试验药物及DMEM(1X)高糖培养液。放入二氧化碳培养箱中培养,用倒置显微镜分别观察记录第0、6、12、24、48 h的细胞迁移情况,并计算4×视野内迁移划痕的面积变化。划痕的愈合率越高,表明细胞的迁移能力越强。
划痕愈合率=(初始划痕面积-观察时间点划痕面积)/ 初始划痕面积×100%(3)
1.3.6 肿瘤细胞侵袭的测定 (1)铺Matrigel基质胶∶按Matrigel基质胶∶无血清DMEM基础高糖培养基=1∶8的比例混匀,取200 μL稀释好的Matrigel基质胶均匀涂抹于每个Transwell小室的聚碳酸酯膜上面(冰面上进行),随后放置二氧化碳细胞培养箱中孵育5 h。取出Transwell小室转移至超净操作台,吸去未贴壁的Matrigel基质胶,上室加入400 μL水浴恒温至37 ℃的DMEM(1X)基础培养基(不含胎牛血清),下室则加入1 000 μL,随后放置二氧化碳培养箱中待其水化2 h。(2)细胞饥饿培养:收集已用DMEM(1X)高糖培养液在二氧化碳培养箱培养至融合度达90%的H1299细胞,用0.25%的胰蛋白酶消化液消化后,加入DMEM(1X)基础培养基(不含胎牛血清),靜置培养24 h以备用。(3)侵袭过程:已饥饿培养24 h的H1299细胞,弃旧培养基,用PBS冲洗2遍后,消化,含0.1%胎牛血清和0.1% BSA的DMEM培养基重悬细胞,细胞计数后调整细胞浓度为2×105/mL。上室加入400 μL H1299细胞悬液及不同浓度(50%、20%、10%)普洱茶液提取液,下室加入600 μL含20%胎牛血清的DMEM(1X)高糖培养基。培养24 h,取出Transwell小室,用PBS磷酸盐缓冲液冲洗2遍,静置干燥,无菌棉球轻轻擦拭上室内贴壁细胞,用含4%多聚甲醇的通用型组织固定液固定细胞10 min,吸弃固定液,再用PBS磷酸盐缓冲液冲洗细胞2遍,随后用1%结晶紫染色液染色15 min,染色结束用PBS磷酸盐缓冲液冲洗2遍。(4)细胞染色与处理:将结晶紫染好色的Transwell小室放在载玻片上,并置于荧光倒置显微镜下观察,遵循随机原则选择20×视野5个进行拍照,采用ImageJ系统计算穿越小室的细胞数量,计算其平均值及标准差。
1.4 数据处理
测定结果用±s表示。采用GraphPad Prism 6处理数据并进行显著性分析,P<0.05认为有显著性差异。
2 结果与分析
2.1 微堆发酵普洱茶产出及理化检测结果
50.0 kg易武生晒毛茶为原料,经45 d微堆发酵,最终得到42.1 kg产品,产率达84.2%。发酵产出率较高。产品外观条索紧细匀整、色泽红褐润显毫,茶汤陈香浓郁、红艳明亮,滋味浓醇甘爽;含水量8.7%,水提取液含量38.9%(国家标准要求≥28%),多酚总量13.5%(国家标准要求≤15.0%)。
2.2 普洱茶水提取液含量测定
本研究所用普洱茶提取液(100%)的普洱茶水提取液含量为(10.72±0.32)%。
2.3 普洱茶提取液对H1299细胞增殖的影响
增殖实验原理是活细胞会与本检测试剂中的叠氮类四唑盐生成甲臜,而生成的甲臜量与细胞活力成正比,进而通过检测各孔板孔吸光度的差异判断细胞活力[10-11]。不同浓度普洱茶提取液作用于NCI-H1299细胞24 h及48 h后,随着浓度的提高,细胞活力显著下降(图1),每一实验组两两对比,可见细胞生长受到明显的抑制作用,表明抑制效应表现为浓度依赖性,即处理时间相同时,随处理浓度的增加,细胞增殖的存活率便随之减少,差异具有统计学意义(P<0.01)(表1、图2)。
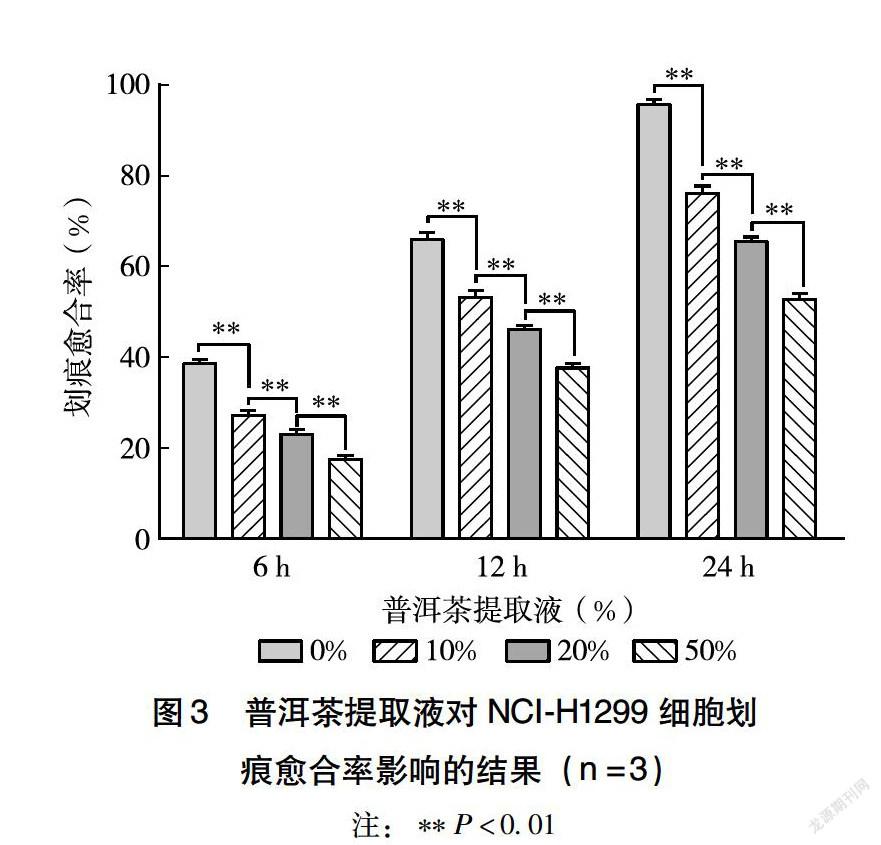
2.4 普洱茶提取液对H1299细胞迁移的影响
本研究采用细胞划痕法测定普洱茶提取液对人肺NCI-H1299细胞迁移能力的影响,该法是测定肿瘤细胞的运动特性的方法之一,其借鉴体外细胞致伤愈合实验模型,在体外培养的单层细胞上划痕致伤,然后加入试24 h及48 h后的存活率。
2.5 普洱茶提取液对H1299细胞侵袭的影响
在体外细胞模拟实验中,Transwell结果显示,经不同浓度普洱茶提取液处理的NCI-H1299细胞与空白对照组相比,试验组侵袭的细胞数量显著低于空白对照组,并呈浓度依赖性,即指在相同处理时间下,普洱茶提取液的浓度越高,细胞侵袭数量越少,细胞侵袭能力下降,差异具有统计学意义(P<0.01)(表3、图4)。
3 结论
本研究利用NCI-H1299细胞系考察不同浓度普洱茶提取液(10%、20%、50%、100%)对肺癌细胞体外增殖的抑制作用,并根据实验结果分别选取了浓度为10%、20%、50%(24 h存活率依次为85.54%、76.66%、47.23%;48 h存活率依次为83.02%、73.94%、42.98%)的普洱茶提取液作用于NCI-H1299细胞24 h进行后续的迁移和侵袭实验,以减少肺癌细胞生长增殖对其迁移和侵袭造成的干扰。研究结果表明,经过上述浓度普洱茶提取液处理后,NCI-H1299细胞的体外增殖、迁移和侵袭能力均受到抑制作用,且呈浓度依赖性,即随着普洱茶提取液浓度的增大,其产生的抑制作用越明显,差异具有统计学意义(P<0.05)。本研究表明,微堆发酵能产生品质合格的普洱茶,不同浓度该普洱茶提取液均可以抑制NCI-H1299细胞的增殖、迁移及侵袭,并且其抑制作用随普洱茶提取液浓度的提高而增大,表明普洱茶能够抑制肺癌的发展。
4 讨论
茶多酚可抑制并阻断人体内的亚硝化反应,减少亚硝胺含量从而抑制致癌物的生成[14]。茶色素通过调控基质金属蛋白酶2、环加氧酶2、G蛋白信息调节因子基因、表皮生长因子等细胞信号分子以及诱导型一氧化氮合酶信号转导系统而达到抗肿瘤的效果[15]。云南普洱茶所含茶多酚较高,经过渥堆发酵的熟茶仍保留了一定的茶多酚,同时产生比例较高的茶色素,为其抑制人非小细胞NCI-H1299的体外增殖、迁移和侵袭能力打下物质基础。
參考文献
[1]Rebecca L,Kimberly D,Jemal A.Cancer statistic,2017[J].Ca Cancer J Clin,2017,67(1):7-30.
[2]Raungrut P,Wongkotsila A,Lirdprapamongkol K,et al.Prognostic significance of 14-3-3γ overexpression in advanced non-small cell lung cancer[J].Asian Pacific Journal of Cancer Prevention,2015,15(8):3513-3518.
[3]SheJ,YangP,HongQ,et al.Lung cancer in China challenges interventions[J].Chest,2013,143(4):1117-1126.
[4]Schiller JH,et al.Comparison of four chemotherapy regimens f advanced non-small-cell lung cancer[J].The New Engl Journal of Medicine,2012,346(2):92-98.
[5]梁明达,胡美英.普洱茶—二十一世纪的抗癌保健饮料[J].农业考古,1993,13(4):78-79.
[6]Xu X,Yan M,Zhu Y.Influence of fungal fermentation on the de-velopment of volatile compounds in the puer tea manufacturing process[J].Engineering in Life Sciences,2005,5(4):382-386.
[7]朱广鑫,周红杰,赵明.普洱茶发酵技术研究进展[J].江西农业学报,2011,23(5):76-81.
[8]潘斐.酶和现代技术在普洱茶膏加工过程的应用研究[D].广东:华南理工大学,2017.
[9]方祥,等.普洱茶功效成分及其品质形成机理研究进展[J].食品工业科技,2008,29(6):313-316.
[10]李红艳,夏启胜,徐梅,等.MTT、MTS、WST-1在细胞增殖检测中最佳实验条件的研究[J].中国康复医学杂志,2005,20(11):824-826.
[11]蓝轲,范维珂,黄昕.WST-1法用于抗恶性肿瘤药物筛选的实验研究[J].重庆医科大学学报,1998,23(3):225-229.
[12]谭鸿霞,黄健云,向蓉,等.卵泡抑素样蛋白5对HCCLM3细胞迁移和侵袭的影响[J].中华实用诊断与治疗杂志,2018,32(11):1056-1058.
[13]孙卓琳,刘京伟,匡长春.苦杏仁苷抑制人肺癌NCI-H1299细胞体外侵袭的机制[J].中国药科大学学报,2016,47(4):479-482.
[14]陈宗懋.茶多酚类化合物抗癌的生物化学和分子生物学基础[J].茶叶科学,2003,23(2):83-93.
[15]Mizuno H,Cho YY,Zhu F,et al.Theaflavin-3-3digallate induces epidermal growth factor receptor downregulation[J].MolCarcinog,2006,45(3):204-212.
