菠萝蜜低聚肽对db/db小鼠炎症反应、血糖及血脂的影响
2020-09-10刘欣然康家伟王天星郝云涛珠娜刘睿胡佳妮李臻于晓晨李勇
刘欣然 康家伟 王天星 郝云涛 珠娜 刘睿 胡佳妮 李臻 于晓晨 李勇
摘 要:目的:研究菠萝蜜低聚肽(JOPs)干预对db/db糖尿病模型小鼠炎症反应、血糖及血脂的影响作用。方法:选择db/db糖尿病小鼠模型,将其随机分为3个JOPs组(0.2、0.4、0.8g/kg·BW)以及糖尿病模型对照组、二甲双胍对照组、乳清蛋白对照组,并选用db/m小鼠作为非糖尿病小鼠空白对照。经过为期6个月的干预,检测小鼠空腹血糖(FPG)、血清胰岛素(INS)、白细胞介素6(IL-6)、白细胞介素8(IL-8)、白细胞介素10(IL-10)和肿瘤坏死因子α(TNF-α)、C反应蛋白(CRP)以及脂代谢指标。结果:JOPs可显著降低db/db糖尿病小鼠空腹血糖水平及胰岛素抵抗指数;可使血清IL-6、TNF-α、总胆固醇(TC)和甘油三酯(TG)显著降低,并使高密度脂蛋白胆固醇(HDL-C)显著升高。结论:JOPs干预可有效降低糖尿病小鼠的血糖水平,改善胰岛素抵抗,同时有效调节炎症反应及血脂代谢。
关键词:菠萝蜜低聚肽;降血糖;炎症;db/db糖尿病小鼠
糖尿病(DM)是一种常见的内分泌代谢系统疾病[1-2],常伴有长期免疫系统失衡、代谢综合征或与肥胖相关的代谢异常,并且DM的许多并发症也都表现出异常的炎症反应,因此炎症被认为是DM发生发展的主要驱动力并与胰岛素抵抗(IR)密切相关。目前,防治DM及其并发症已成为科学工作者研究的重点,其中控制血糖水平和调节炎症反应则是重中之重。
生物活性肽(BAP)是从二肽到复杂的线性、环形结构的不同肽类的总称,是源于蛋白质的多功能化合物,具有特殊的生理特性,在医药和保健食品领域的研究已成为热点。研究发现,许多植物来源的BAP具有降血糖的功效,如燕麦低聚肽、人参低聚肽和核桃低聚肽等[3-7]。低聚肽作为BAP中的一类,因其更短小的氨基酸组成,具有更易吸收且活性更强的特性,有广阔的发展前景。菠萝蜜(Artocarpus heterophyllus )主要产自东南亚、印度及我国南部。与其他热带水果相比,菠萝蜜的果肉和种子均含有更多的蛋白质、钙、铁、维生素等,其中果肉中蛋白质含量为1.2%~1.9%,而通常不被利用的种子中则含有更多的蛋白质,含量为6.6%~7.0%,某些品种的菠萝蜜种子蛋白质含量甚至高达11.85%[8-9] 。同时,菠萝蜜中还有多种人体必需的氨基酸,如精氨酸、胱氨酸、组氨酸、亮氨酸、赖氨酸、蛋氨酸、苏氨酸和色氨酸等[10],是水果中非常优质的肽类来源。研究发现,菠萝蜜具有一定的降血糖作用[11-12],在短期菠萝蜜低聚肽(JOPs)干预实验中也可发现其显著的降血糖作用,但对于其降糖机制以及对炎症反应的影响尚不可知。同时,DM及炎症发生的同时伴随着的血脂代谢异常也值得关注。因此,本研究探究JOPs长期干预对于db/db糖尿病小鼠血糖及炎症反应的调节作用。
1 材料与方法
1.1 受试物
JOPs,淡黄色固体粉末,利用生物酶解技术从菠萝蜜果肉及种子中制取得到的小分子BAP的混合物,主要成分为分子量<1 000Da的低聚肽(海南盛美诺生物技术有限公司)。
1.2 实验动物
选择12周龄SPF级雄性db/db型糖尿病小鼠(空腹血糖水平≥11.1mmol/L)48只及与之周龄、性别匹配的非DM健康同窝出生仔畜db/m小鼠(lepr-/m)8只。db/db小鼠及正常健康小鼠db/m均由常州卡文斯实验动物有限公司提供。动物饲养在北京大学医学部实验动物科学部,动物实验环境设施(屏障环境)合格证书:医动字第 01-2055。动物分笼饲养,每笼2只,均给予普通饲料,饲养环境符合屏障环境,温度(25±1)℃,相对湿度50%~60%RH,室内照明控制在12 h/12 h光暗周期节律。动物喂养及实验操作严格按照《北京市实验动物管理条例》执行,并经过北京大学医学部伦理委员会审核通过(批准号:LA2017189)。
1.3 主要试剂和仪器
葡萄糖(纯度99.8%),北京金汇太亚化学试剂有限公司;浓缩乳清蛋白Lacprodan 80,(纯度79.2%),北京中柏创业化工产品有限公司;格华止盐酸二甲双胍片,国药准字H20023370,中美上海施贵宝制药有限公司;三诺安稳血糖仪,长沙三诺生物传感技术有限公司;胰岛素ELISA试剂盒,南京建成生物工程研究所;IL-6 ELISA试剂盒,南京建成生物工程研究所;IL-8 ELISA试剂盒,南京建成生物工程研究所;IL-10 ELISA试剂盒,南京建成生物工程研究所;TNF-α ELISA试剂盒,南京建成生物工程研究所;BMG FLUO star Omega多功能酶标仪,BMG LABTECH公司;AU480全自动生化仪,日本奥林巴斯株式会社。
1.4 分组、剂量及干预方式
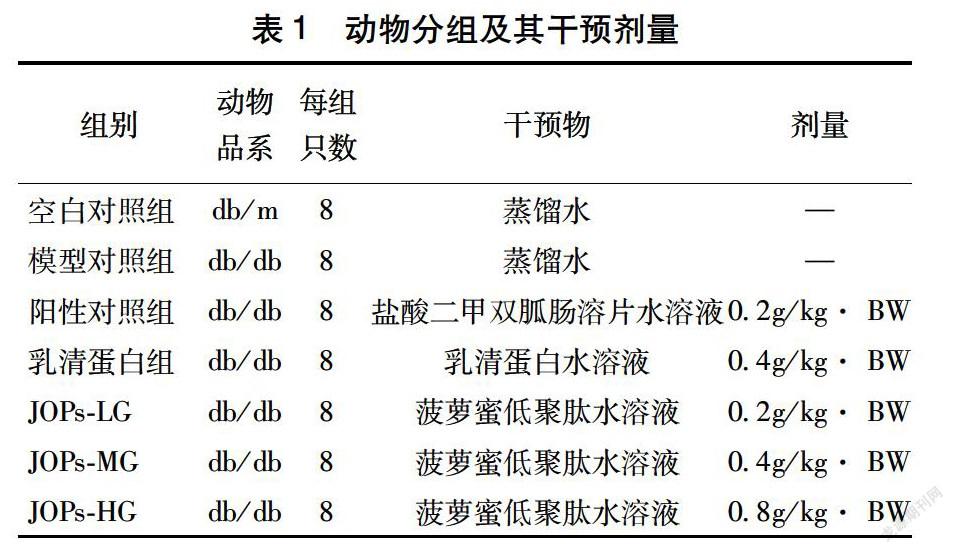
将48只db/db小鼠按空腹血糖水平随机分为6组:1个模型对照组、1个阳性对照组(0.2g/kg·BW盐酸二甲双胍肠溶片水溶液)、1个乳清蛋白组(0.4g/kg· BW乳清蛋白水溶液)和3個JOPs剂量组(0.2、0.4、0.8g/kg·BW),每组8只。8只db/m小鼠作为空白对照组。各组干预方式均为每日经口灌胃,持续6个月,实验期间动物自由进食、饮水(表1)。
1.5 检测指标及方法
1.5.1 一般情况 每日观察各组大鼠状态,定期记录摄食和体重等情况。
1.5.2 空腹血糖及胰岛素检测 6个月干预结束后,将小鼠禁食5h,摘眼球取血后颈椎脱臼处死,将血液以3 000r/min离心10min分离血清,检测FPG及INS浓度,并根据稳态模型法公式计算胰岛素抵抗(HOMA-IR)指数,计算公式为式(1):
HOMA-IR指数= FPG(mmol/L)×INS(mIU/L)/ 22.5(1)
1.5.3 炎症因子检测 收集血清方法同(2),按照试剂盒说明书操作测定IL-6、IL-8、IL-10和TNF-α,采用全自动生化仪检测C反应蛋白(CRP)。
1.5.4 血脂检测 收集血清方法同(2),利用全自动生化仪检测血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
1.6 数据处理与统计分析
正态分布数据以均数±标准差(±s)表示,用SPSS 24.0软件进行单因素方差分析或独立样本t检验,以P<0.05表示差异有统计学意义。
2 结果与分析
2.1 一般情况
干预期间,空白对照组小鼠(db/m)毛色黑亮有光泽,精神状态良好。模型对照组皮毛松散,体表潮湿,精神状态较差,活动量明显少于空白对照组,而JOPs干预后的小鼠毛色及精神状况逐渐有所好转,活动量有所增加,干预时期内极少出现感染症状(如尿道感染等)。干预期间,各DM组(db/db)小鼠体重均高于空白对照组(db/m)小鼠,但DM小鼠各组间差异无统计学意义。
2.2 JOPs对糖尿病小鼠空腹血糖及胰岛素的影响
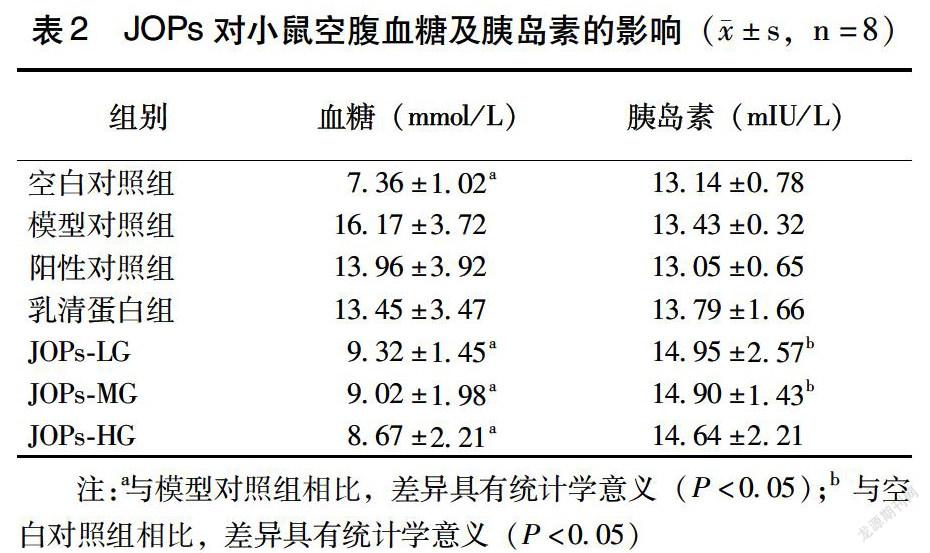
干预前,空白对照组小鼠FPG均值为7.09mmol/L,db/db 2型DM模型小鼠FPG值均大于11.1mmol/L,已达到2型DM的标准;并且在干预期间,模型对照组小鼠随机FPG也并无明显变化,说明该DM模型较为稳定,符合后续研究的需要。于JOPs干预的第6个月为小鼠禁食并断头处死,收集检测小鼠FPG、空腹INS浓度。db/db DM小鼠FPG均明显高于正常组小鼠,而相比模型对照组小鼠,JOPs干预的3组小鼠FPG均显著降低,差异具有统计学意义(P<0.05)。JOPs干预后的小鼠INS水平较模型对照组无显著差异(表2)。
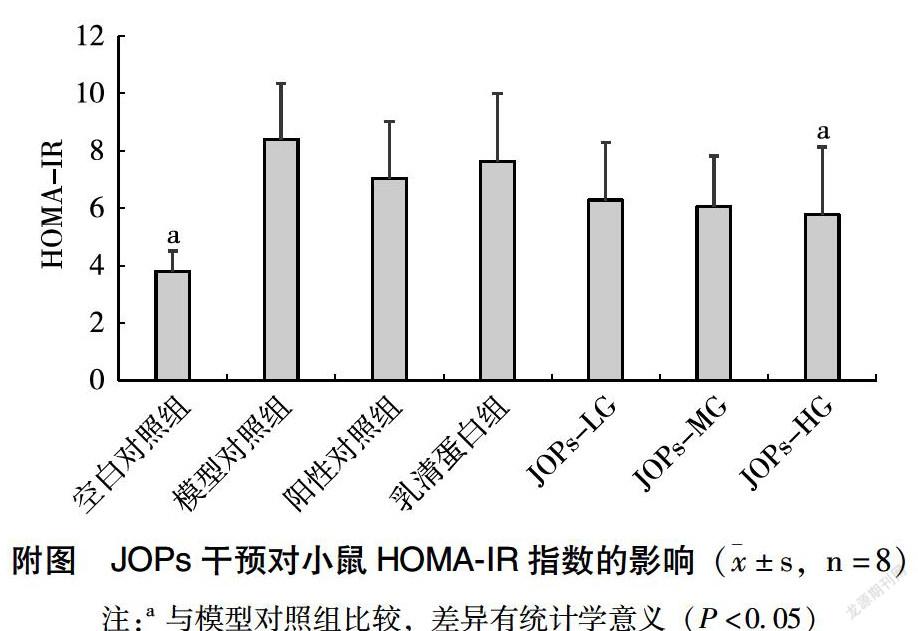
根据稳态模型法公式计算各组小鼠HOMA-IR指数。由附图可见,空白对照组小鼠HOMA-IR指数显著低于其他各组,说明各组DM小鼠都处于严重的IR状态。而相比模型对照组,JOPs-HG小鼠HOMA-IR指数显著降低(P<0.05),说明JOPs干预可以改善IR;同时,JOPs-LG和JOPs-MG小鼠HOMA-IR指数也有一定程度的降低,但差异无统计学意义。
2.3 JOPs对糖尿病小鼠炎症因子的影响
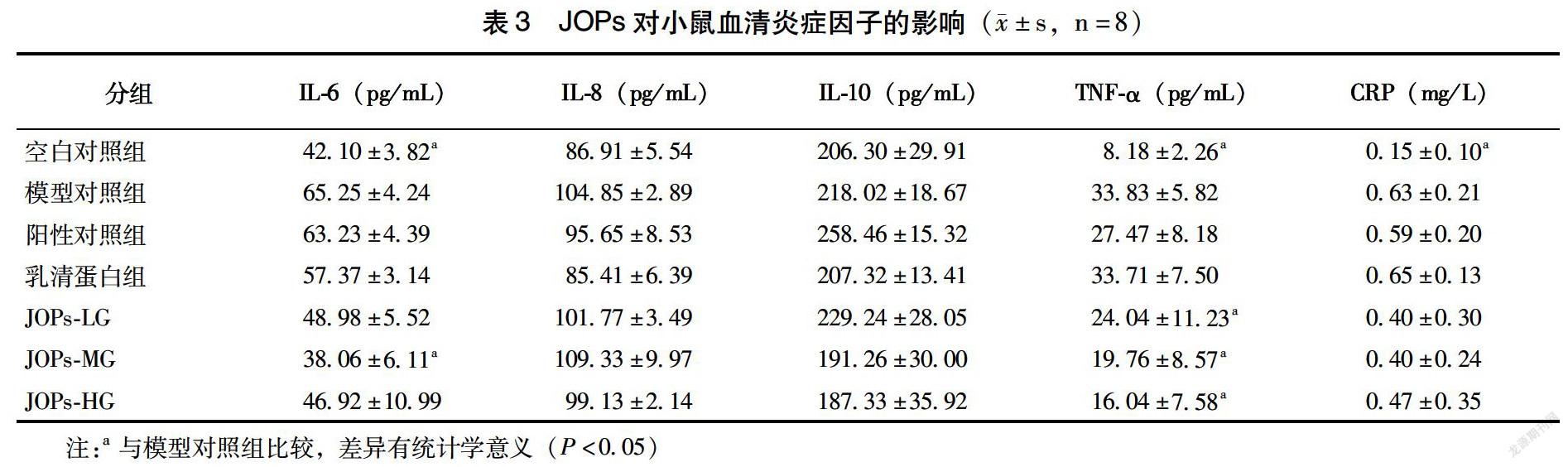
如表3所示,空白对照组及JOPs-MG小鼠血清IL-6含量较模型对照组显著降低,差异有统计学意义(P<0.05);空白对照组及JOPs干预的3组小鼠血清TNF-α含量均显著低于模型对照组(P<0.05);对于血清CRP来说,仅有空白对照组内含量显著低于模型对照组(P<0.05);模型对照组小鼠的血清IL-8、IL-10含量与其他组相比差异无统计学差异。
2.4 JOPs对糖尿病小鼠血脂代谢的影响
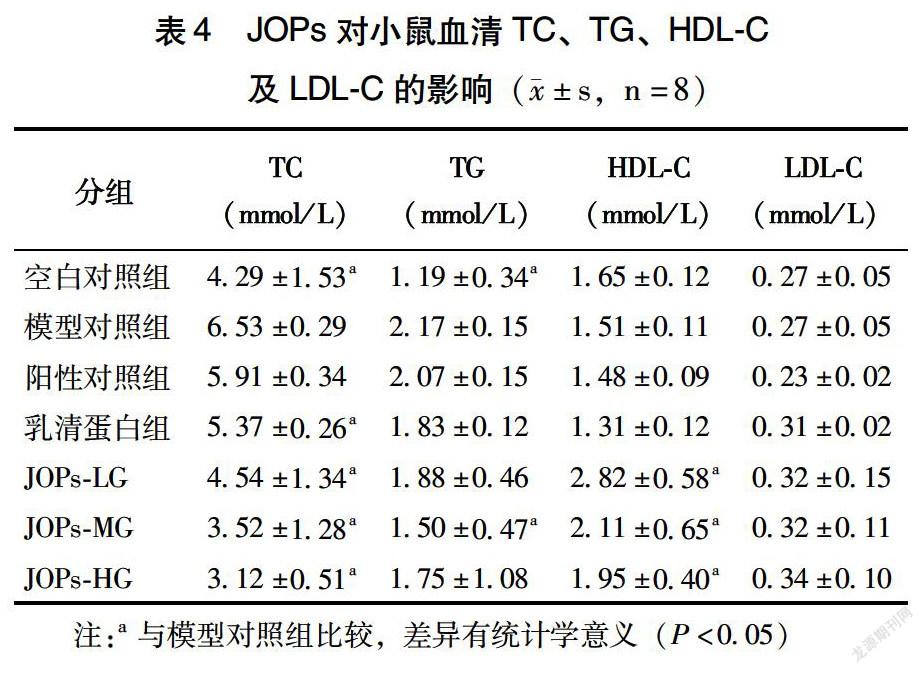
如表4所示,空白对照组、乳清蛋白对照组及JOPs干预的3组小鼠血清TC值均显著低于DM模型对照组,差异有统计学意义(P<0.05);空白对照组及JOPs-MG小鼠的血清TG显著低于DM模型对照组(P<0.05);JOPs干预的3组小鼠血清HDL-C均显著高于模型对照组,差异有统计学意义(P<0.05)。模型对照组小鼠的血清LDL-C含量与其他组相比差异无统计学差异。
3 讨论
探究JOPs血糖调节作用的研究基础首先需要依赖于DM动物模型。目前国内外主要使用的DM模型动物主要分为自发性模型动物、转基因模型动物和诱发性模型动物等。在诸多动物模型中,db/db小鼠是属于自发性模型动物中比较优质的用来研究2型DM的模型小鼠,价格也比较昂贵,它是由C57BL/KsJ近亲交配株常染色体隐性遗传衍化而来。纯合的自发突变小鼠在3~4周龄时产生可以辨认的肥胖表型;出生后10~14日,血浆胰岛素和血糖开始升高,并出现多饮、多食、多尿的“三多”症状,其存活寿命为10个月左右。db/db小鼠的DM发生发展近似人类DM病理改变过程,适合用于外物干预下的DM降糖作用研究,模型持续时间长,可为后续的研究奠定稳固的基础[13]。对于DM的治疗来说,控制好FPG是最基础的方向,FPG的降低可以延缓或抑制DM的进一步恶化,对于防治DM并发症也有很好的效果[14-16]。本研究中,JOPs干预后的3组db/db小鼠的FPG均显著低于模型对照组(P<0.05),甚至在数值上比阳性对照组二甲双胍的血糖值更低,说明JOPs可以有效降低FPG,长期干预下可能效果优于二甲双胍。同时,JOPs干预后3组的FPG也显著低于乳清蛋白对照组,意味着JOPs在乳清蛋白对照组平衡了膳食蛋白摄入量的情况下依然显示出突出的降糖效果,说明体现出了BAP比普通参照蛋白具有更强的活性优势。
胰岛素是机体调节血糖水平的重要蛋白质激素,与血糖水平密切相关。IR是2型DM的发病基础[17],指胰岛素作用的靶器官对胰岛素的敏感性下降,使胰岛素促进葡萄糖摄取和利用的效率下降的状态。研究结果中虽然INS绝对水平在各组间无显著差异,但经计算了HOMA-IR指数后可发现,JOPs-HG小鼠HOMA-IR指数显著低于模型对照组,说明JOPs最高剂量下可有效改善IR,对于控制血糖、控制DM进展有重要意义。
IR主要的诱因有遗传因素、肥胖、炎症反应、氧化应激增加等。其中,炎症反应是2型DM、IR、心血管疾病以及肥胖等状态的共同交集,参与了多种疾病的发生发展[18-19]。IL-6是目前被认为最具内分泌特征的细胞因子,不仅由免疫活性细胞产生,也由脂肪细胞产生,参与机体炎症反应及能量代谢。IL-6可参与机体炎症反应并通过与胰岛素的相互作用影响DM的发生和发展[20]。同时,IL-6还可与TNF-α等因子相互作用共同參与炎症反应,加速DM的发展,有研究发现,DM患者空腹血清IL-6和TNF-α水平明显升高。TNF-α是一种非糖基化蛋白,巨噬细胞、中性粒细胞等多种细胞均可合成,有研究发现,TNF-α在IR的动物脂肪组织中过度表达[21-22]。本研究发现,JOPs可显著降低血清IL-6和TNF-α,提示JOPs可能通过调节炎症反应来改善IR。除了IL-6和TNF-α这两个重要的炎症因子以外,IL-8可通过对中性粒细胞有细胞趋化作用而实现其对炎症反应的调节;IL-10作为抑炎因子,有研究发现,在饮食诱导脂肪性肝病的动物模型中,抑制IL-10可使促炎细胞因子的表达增加、胰岛素信号传导恶化以及糖异生的激活[23];而CRP与 2型DM及其并发症密切相关,是2型DM发病的最强的预测因子[24-25]。但本研究未发现JOPs干预对IL-8、IL-10、CRP有显著影响。这可能与JOPs的作用靶点有关,有待进一步深入研究阐明。同时,本研究发现,在血脂代谢方面,JOPs有效降低了血清TC、TG,同时升高了HDL-C水平,说明JOPs可一定程度地促进脂类的代谢,改善脂质紊乱,显著降低DM大鼠的血脂水平。
本研究发现,JOPs具有降血糖、降血脂以及调节机体炎症反应的作用,推测JOPs通过调节炎症因子改善IR从而有效降低血糖。由于国内外尚无关于JOPs的相关研究,因此,本研究具有一定的独创性。随着近年来BAP领域的深入研究,人们发现许多BAP类都具有降血糖的作用[3-4,26-27]。JOPs从结构基础来讲,比蛋白质和多肽更易消化,吸收速度甚至高于氨基酸,可减轻肾脏代谢负担,具有独特的生理功能和理化性质,是蛋白质或氨基酸所不具备的,具有重要的科学意义和临床应用价值。
4 结论
本研究以db/db小鼠为DM模型小鼠,设立不同剂量的JOPs干预组和多种对照组,探讨JOPs对DM小鼠血糖、血脂和炎症反应的调节作用,结果显示,JOPs具有降低DM小鼠FPG、HOMA-IR指数的作用,同时还可使血清IL-6、TNF-α、TC和TG显著降低,并使HDL-C显著升高,这对于降低DM患者血糖及防治DM有重要意义。
参考文献
[1]李秀钧,邬云红.糖尿病是一种炎症性疾病?[J].中华内分泌代谢杂志,2003(4):5-7.
[2]Cho N H,Shaw J E,Karuranga S,et al.IDF diabetes atlas:global estimates of diabetes prevalence for 2017 and projections for 2045[J].Diabetes Research & Clinical Practice,2018,138:271-281.
[3]李勇.生物活性肽研究现况和进展[J].食品与发酵工业,2007(1):3-9.
[4]刘欣然,刘思奇,侯超,等.燕麦低聚肽对糖尿病大鼠血糖的影响[J].中国食物与营养,2018,24(4):46-50.
[5]盛清凯,姚惠源.苦瓜多肽-P的分离及其降糖活性[J].无锡轻工大学学报(食品与生物技术),2005(1):49-51.
[6]Xu M,Sun B,Li D,et al.Beneficial effects of small molecule oligopeptides isolated from panax ginseng meyer on pancreatic beta-cell dysfunction and death in diabetic rats[J].Nutrients,2017,9(10):1061.
[7]Wang J B,Liu X R,Liu S Q,et al.Hypoglycemic effects of oat oligopeptides in high-calorie diet/STZ-induced diabetic rats[J].Molecules,2019,24(3):558.
[8]張涛,潘永贵.菠萝蜜营养成分及药理作用研究进展[J].广东农业科学,2013,40(4):88-90.
[9]Mehra M,Pasricha V,Gupta R K.Estimation of nutritional,phytochemical and antioxidant activity of seeds of musk melon (Cucumis melo)and water melon (Citrullus lanatus)and nutritional analysis of their respective oils[J].Journal of Pharmacognosy and Phytochemistry,2015,3(6):98-102.
[10]Ranasinghe R A S N,Maduwanthi S D T,Marapana R A U J.Nutritional and health benefits of jackfruit (Artocarpus heterophyllus Lam.):a review[J].International Journal of Food Science,2019,2019:1-12.
[11]Fernando M R,Thabrew M I,Karunanayake E H. Hypoglycaemic activity of some medicinal plants in Sri-Lanka[J].Gen Pharmacol,1990,21(5):779-782.
[12]Hettiaratchi U,Ekanayake S,Welihinda J.Nutritional assessment of a jackfruit (Artocarpus heterophyllus)meal[J].Ceylon Medical Journal,2011,56(2):54-58.
[13]朱超,朱莹莹.2型糖尿病动物模型的构建[J].中国实验动物学报,2013,21(2):84-88.
[14]Sarwar N,Gao P,Seshasai S R,et al.Diabetes mellitus,fasting blood glucose concentration,and risk of vascular disease:a collaborative meta-analysis of 102 prospective studies[J].Lancet,2010,375(9733):2215-2222.
[15]Sung J,Song Y M,Ebrahim S,et al.Fasting blood glucose and the risk of stroke and myocardial infarction[J].Circulation,2009,119(6):812-819.
[16]Cheng Y J,Gregg E W,Geiss L S,et al.Association of A1C and fasting plasma glucose levels with diabetic retinopathy prevalence in the U.S.population:Implications for diabetes diagnostic thresholds[J].Diabetes Care,2009,32(11):2027-2032.
[17]Tangvarasittichai S.Oxidative stress,insulin resistance,dyslipidemia and type 2 diabetes mellitus[J].World J Diabetes,2015,6(3):456-480.
[18]Avzaletdinova D S,Sharipova L F,Kochetova O V,et al. Association of adiponectin gene alleles with type 2 diabetes mellitus in residents of Bashkortostan[J].Probl Endokrinol (Mosk),2019,65(1):31-38.
[19]Xia C,Rao X,Zhong J.Role of T lymphocytes in type 2 diabetes and diabetes-associated inflammation[J].J Diabetes Res,2017,2017:6494795.
[20]Rehman K,Akash M,Liaqat A,et al.Role of interleukin-6 in development of insulin resistance and type 2 diabetes mellitus[J].Crit Rev Eukaryot Gene Expr,2017,27(3):229-236.
[21]陈明卫,王佑民,胡红琳,等.血清肿瘤坏死因子α、游离脂肪酸以及抵抗素与2型糖尿病患者胰岛素抵抗的关系[J].中国糖尿病杂志,2006(1):4-6.
[22]陈思娇,高阳,熊盈,等.2型糖尿病血糖水平与IL-6和TNF-α的相关性研究[J].中国老年保健医学,2008(1):36-38.
[23]Cintra D E,Pauli J R,Araujo E P,et al.Interleukin-10 is a protective factor against diet-induced insulin resistance in liver[J].J Hepatol,2008,48(4):628-637.
[24]梁建嫦.超敏,CRP与2型糖尿病及其血管并发症的相关性研究[J].中外医学研究,2014,12(23):48-49.
[25]Odegaard J I,Ricardo-Gonzalez R R,Goforth M H,et al. Macrophage-specific PPARgamma controls alternative activation and improves insulin resistance[J].Nature,2007,447(7148):1116-1120.
[26]王瑩,徐秀林,朱乃硕.生物活性肽降血糖功能的研究进展[J].食品科学,2012,33(9):341-344.
[27]Patil P,Mandal S,Tomar S K,et al.Food protein-derived bioactive peptides in management of type 2 diabetes[J].European Journal of Nutrition,2015,54(6):863-880.
Abstract:Objective To study the effects of jackfruit oligopeptides(JOPs)on inflammation,glucose and lipid in db/db diabetic mice.Method Totally 48 db/db diabetic mice were randomly divided into six groups (8 in each groups) including three jackfruit oligopeptides groups(treated orally with 0.2,0.4 and 0.8 g/kg·BW JOPs),diabetic model group(treated orally with distill water),positive control group (treated orally with 0.2 g/kg·BW metformin hydrochloride enteric-coated tablets aqueous solution)and whey protein control group(treated orally with 0.4 g/kg·BW whey protein aqueous solution),while 8 db/m mice were used as blank control for non-diabetic mice.FPG,INS,inflammatory cytokines and serum lipid metabolism were measured after 6-months intervention.Result JOPs could significantly reduce FPG,HOMA-IR,IL-6,TNF-α,TC and TG while HDL-C increased significantly.Conclusion JOPs have a hypoglycemic effect in db/db mice and its mechanism is related to improving insulin resistance by regulating inflammatory cytokines.
Keywords:jackfruit oligopeptides(JOPs);insulin resistance;inflammation;db/db diabetic mice
(责任编辑 李婷婷)