基于微藻SLogistic模型的海藻糖保藏藻种活力评价
2020-09-10刘恒恒吴子健董世瑞张宏宇王素英
刘恒恒,吴子健,董世瑞,张宏宇,王素英
(天津商业大学生物技术与食品科学学院,天津300134)
微藻作为在全球经济中未被充分利用的可再生资源,具有生长快、固碳效果好和生长条件简单等诸多优点。微藻因其高营养价值而广泛应用于食品加工及水产饵料,不仅能够提高产品的营养价值还能缓解粮食压力。多种微藻含有丰富的生物活性物质[1-3],如维生素、藻蓝蛋白、不饱和脂肪酸和微藻多糖等,微藻及其代谢产物具有增强人体免疫力、保护心血管系统、抗肿瘤及病毒等保健功效[4],这使得开发微藻保健品、特色食品极具潜力。
微藻的生长可以用SLogistic曲线进行描述,SLogistic曲线又称S型生长曲线[5],微生物种群增长、陆生及水生动物种群增长、细胞生长[6-7]等过程均可用其描述。完整的微生物生长曲线包括渐增期、快增期、缓增期和衰减期4个时期[8]。用OriginPro8.0中的SLogistic1模型对微藻生长数据进行拟合可以得到拟合度较高的生长曲线,该模型引入最大生长速率以及终止生物量,能准确、定量地描述生物生长规律。拟合生长曲线可以呈现出藻种状态[9],整体把握藻种活力以及再生长情况。
经济微藻的研究与养殖离不开藻种保藏,最常用的保藏方法是液体藻种保藏法,当微藻种类较多时会出现占用空间大且传代频繁的缺点[10];超低温冷冻保藏法需要进行多步骤预冷且只适合于几种特殊的藻类[11]。在此基础上改良的浓缩液普通低温保藏法常常应用于微藻饵料的贮藏,但对于微藻是否能够存活以及存活藻种的活力并无要求[12]。为了提高微藻的存活率,在现有的浓缩藻液低温保藏条件中加入弱光照及合适的保护剂。研究表明新生态藻丝体更适应于在弱光照条件下存在[13]。弱光照条件不仅能够维持藻种的形态,还可以降低藻细胞的死亡率。而保护剂可以降低藻细胞由低温带来的冷损害,提高藻种质量和存活率。海藻糖可以在低温、高温以及干燥脱水等逆境胁迫条件下防止蛋白质变性,通过水分子置换以及稳定化学物质来减少细胞所受到的危害[14-15]。本试验根据节旋藻及螺旋藻的生长特性,在浓缩藻液低温保藏法的基础上,增添海藻糖保护剂与弱光照,以保藏时间长、菌种活力好以及菌种取用方便为原则优化保藏条件,克服常温继代保藏方法频繁传代、占用较多原材料及存储空间大的缺点。
1 材料与方法
1.1 材料与试剂
藻株:节旋藻 TJJ2、F-792、TJSD1、TJBC14-2、TJJ1、F-900-1、TJBC1、TJJ3 和螺旋藻 F-1070、F-351[16],由天津商业大学王素英课题组保存。
海藻糖(分析纯):北京索莱宝科技有限公司;碳酸镁(配制0.1%悬浮液)、丙酮(配制90%溶液):分析纯,天津市风船化学试剂科技有限公司;AB培养基参照文献[17]进行配制。
1.2 仪器与设备
DG-486B低温光照保藏柜:天津世纪茂源机械有限公司;Micro17台式高速离心机:赛默飞世尔科技有限公司;U-5100分光光度计:日本Hitachi公司;AS823分体式光照度计:东莞希玛仪表万创电子制品有限公司;SX-500高压蒸汽灭菌锅:日本TOMY公司;TWS-16单列六孔电热恒温水浴锅:天津市中环电炉有限公司。
1.3 试验方法
1.3.1 藻种耐低温性测定
将OD560nm≈0.8的10株藻种按照5%接种量接种,两周后分别取原藻液和5倍藻浓缩液放置于4℃保藏柜中自然光可照射范围,每10 d取样活化,比较死亡时间,选取相对耐低温的藻株进行保藏条件优化。
1.3.2 低温弱光保藏正交试验
1.3.2.1 海藻糖浓度选择
设置海藻糖保护剂的质量浓度为0.2%、1%、5%、15%,无菌环境下与AB培养基混合获得海藻糖保藏液。藻种浓缩液用海藻糖保藏液稀释至浓度为4×106CFU/mL,放置于4℃保藏柜中自然光可照射范围,保藏2个月后活化藻种检测藻种活力,进行活力指标的评价后选择海藻糖保护剂合适的浓度范围以进行正交试验。
1.3.2.2 正交试验设计
以海藻糖浓度、藻液浓度及光照强度为考察因素,设计L9(34)正交表[18]见表1。

表1 藻种保藏因素和水平表Table 1 Factors and levels of microalgae preservation
根据正交设计结果设置对应条件进行藻种保藏,在保藏 2、3、4、5、6 个月时检测藻种活力。
1.3.2.3 藻种保藏方法
以相对耐低温藻株为试验材料,在其OD560nm≈0.8时以5%接种量接种,两周后将藻液12 000 r/min离心10 min获得藻泥,用不同浓度的海藻糖保藏液稀释藻泥,血球计数板测定并计算藻液浓度,稀释至所需浓度,取4 mL藻液于10 mL保藏管中,置于相应条件下进行保藏。
1.3.2.4 保藏藻种的活化
在相应保藏时间下将保藏藻种接种于150 mL AB培养基中进行活化生长,藻液浓度为 2×106、3×106、4×106CFU/mL的保藏藻种对应的接种量分别为400、270、200 μL,生长条件为光照 12 h(32 ℃)、黑暗 12 h(30℃)。采用浊度法在第 0、3、5、7、9、11、13 天测定保藏藻种活化后生长的生物量(OD560nm)。
1.3.3 Origin Pro拟合生长曲线
以时间(天数)为自变量(X)、生物量(OD560nm)为因变量(Y),在 Origin Pro 8.0中对其进行 SLogistic1(SLogistic模型同系列的近似模型)的生长曲线拟合,得到高拟合度的生长曲线及相应函数。
对生长曲线函数进行一阶求导并绘图,得到生长速率曲线图,可求出藻种的最大生长速率(0≤X≤13 d)。对生长速率进行二阶求导得到生长速率函数的两个拐点,两拐点对应的时间点将生长曲线的生长过程分为渐增期、快增期和缓增期3个阶段[19]。在对应的保藏时间下,统计组内的渐增期、快增期、缓增期、生物积累量、最大生长速率、最大生长速率发生时间指标,并确定可以进行统计学分析的特征指标,以评价保藏藻种活力。
1.3.4 正交试验的极差与方差分析
在相应的保藏时间下,以特征指标为统计对象,对边际均值进行估算,通过均值极差法计算试验中各因素各水平对应的均值(K)和极差(R),比较得出的各保藏因素的重要程度,并根据K值选出组内最佳保藏条件。同时对主体间效应进行F检验,选择置信区间0.95,将各项数据结果的总变异分解为来源于不同因素的变异估计值,以评定出各因素在总变异中所占的相对重要性[20]。
1.3.5 叶绿素a含量的测定
参考文献[21]采用浊度法在测定生物量的同时测定藻体叶绿素a含量,叶绿素a浓度计算公式如下:
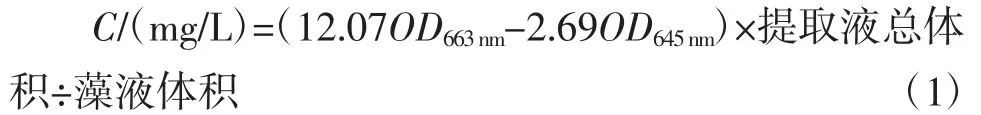
1.3.6 数据处理
所有试验均进行3次重复试验。数据采用SPSS 19.0统计软件和Oringin8.0绘图软件进行基础数据整理、显著性分析与作图。
2 结果与分析
2.1 藻种耐低温性检测
藻种耐低温性能的试验结果见图1。
由图1可知,在低温自然光条件下保藏时,浓缩藻液较原藻液的保藏时间更长;其中F-1070和TJBC14-2的原液和浓缩液在低温下存活时间都超过60 d,但TJBC14-2在低温下生理代谢受到影响,较易出现异腥味,低温弱光保藏后进行活化藻结块严重;F-1070没有明显的异味和结块,较适合低温保藏,因此选择螺旋藻F-1070用于随后的低温弱光保藏试验。
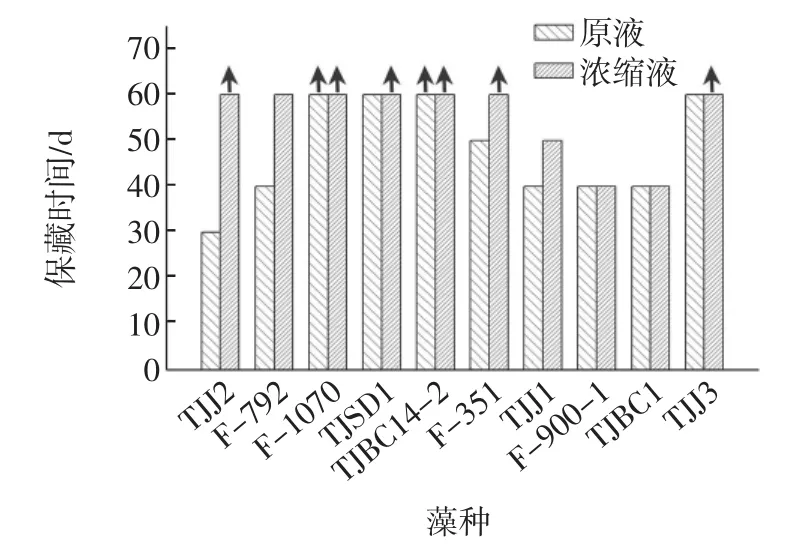
图1 试验藻种耐低温性能的试验结果Fig.1 Experimental results of low temperature resistance of microalgae species
2.2 低温弱光保藏正交试验结果
2.2.1 海藻糖浓度范围的选择
不同浓度海藻糖对生长速率与渐增期时间的影响见图2与图3。
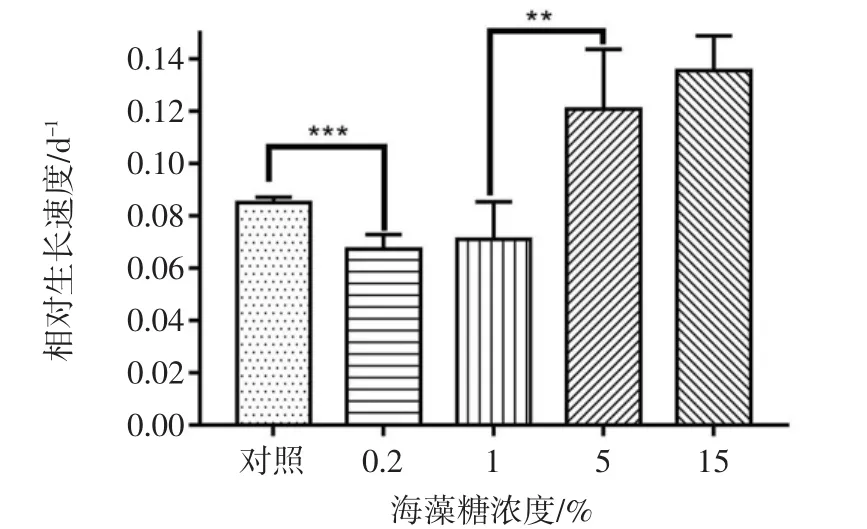
图2 不同浓度海藻糖对生长速率的影响Fig.2 Effects of different concentrations of trehalose on the growth rate
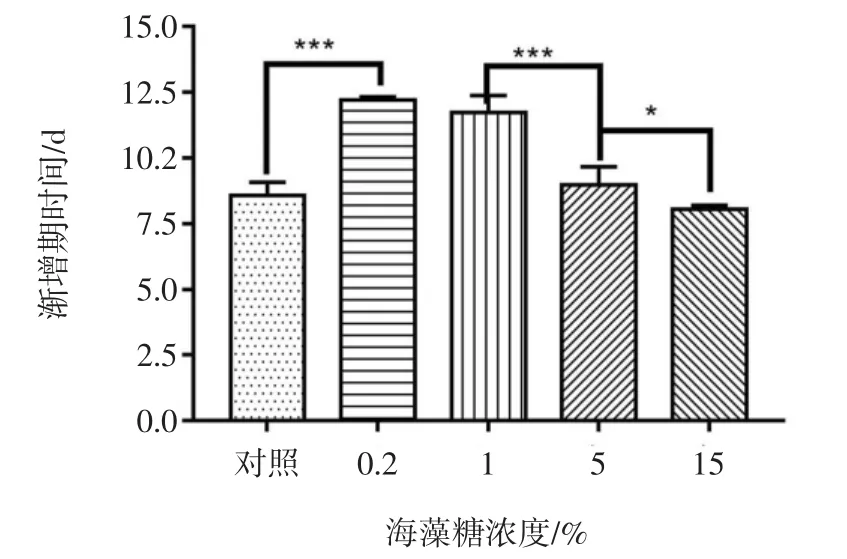
图3 不同浓度海藻糖对渐增期时间的影响Fig.3 Effects of different concentrations of trehalose on the delayed growth period
由图2与图3可知,不同浓度海藻糖对藻种保藏效果有较大影响,在海藻糖浓度为5%和15%时,保藏藻种F-1070的生长速率高于对照组,渐增期时间少于对照组,因此选择海藻糖浓度范围为5%~15%进行正交试验。
2.2.2 正交试验表
利用SPSS 19.0实现的正交设计表见表2。
表2 在SPSS中实现的正交设计表Table 2 Orthogonal design implemented in SPSS
2.3 拟合生长曲线结果
2.3.1 SLogistic模型的选择
SLogistic模型所对应的假设条件是在有限的生物资源条件下单个微生物生长具有相同的增长率,且所需营养相同[22]。把增长率dy/dx与任意时间的种群生物量y(x)联系在一起,典型的SLogistic模型可以表示为:

式中:k为常数;a为环境容纳最大生物容量,本试验以吸光度定义,即该生物生长过程中所能达到的OD560nm峰值。
其模型所包含的内在机制为:(1)随着y逐渐增长到 a 过程中,未知利用“剩余空间”(y/a)逐渐减少;(2)种群增长率先由小变大,到曲线中点即生长转折点(a/2)最大,然后逐渐减少,当达到最大生物容量时,增长率趋于零。
SLogistic1模型是SLogistic模型的近似模型,其曲线相比于SLogistic曲线具有更加清晰的3个生长阶段,其快增期更加陡峭。考虑到微藻的生长具有更明显的快增期,因此SLogistic1曲线更适合描述微藻的生长规律。SLogistic1模型可以表示为:

其中最大值及发生时间为:

SLogistic1曲线的特点是随X增加,Y值开始增长缓慢,而在以后的某一范围内迅速增长,X达到某限度后,Y增长趋于缓慢,整个曲线略呈陡峭的“S”型,两条渐近线分别为Y=a和Y=0,a值的物理意义是Y所能达到的最大值,k和XC为Slogistic1曲线方程的特征参数。采用SLogistic1模型进行保藏藻种再生长曲线的拟合,分析可得生长曲线所包含的渐增期、快增期、缓增期以及生长转折点。
以保藏藻株F-1070(编号1-2-2)保藏两个月时为例,活化再生长后的再生长拟合曲线及生长速率曲线见图4。
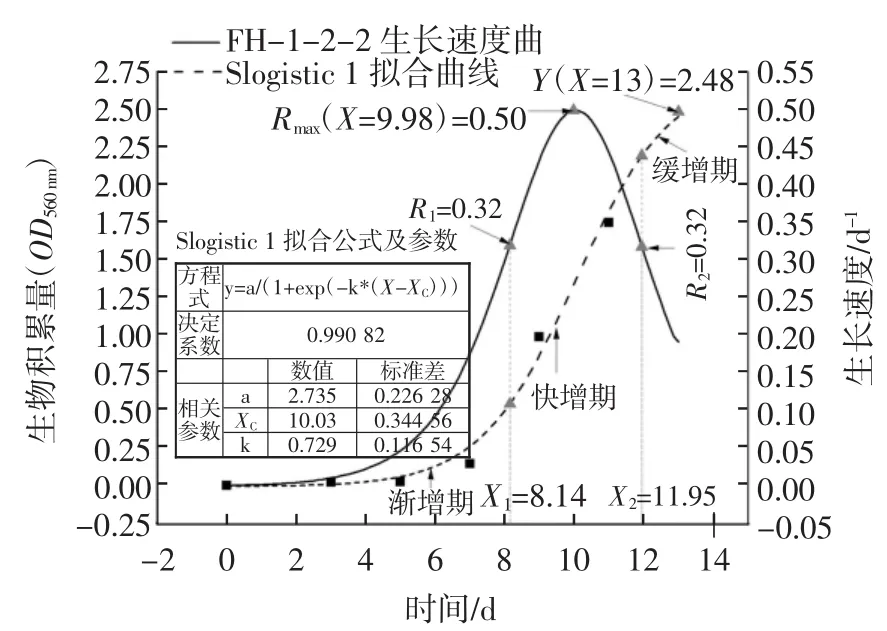
图4 正交试验藻种的再生长拟合曲线及生长速率曲线Fig.4 Regrowth fitting curve and growth rate curve of the orthogonal test
由图4可知,保藏藻株F-1070(编号1-2-2)保藏两个月时活化再生长后的SLogistic1拟合生长曲线拟合度较好,其中虚线曲线为拟合的生长曲线Y(X)(0≤X≤13 d),实线曲线为生长速率曲线 R(X)(0≤X≤13d),R(X)峰值为最大生长速率。对 R(X)二阶求导得到其两拐点(R1,X1)、(R2,X2),X1、X2将整个生长曲线周期分为渐增期、快增期和缓增期,函数模型拟合的曲线具有Y=a的渐近线,因此曲线不包含生物量下降的衰亡期。
2.3.2 藻种活力评价体系的构建
对SLogistic1模型拟合再生长曲线方程参数[22]的统计结果见表3。
由表3可知,随着保藏时间延长,一般情况下保藏菌种的活力减小,最大生物容量a值逐渐变小;下划线标注的模型预测指标a值出现异常,明显偏大,这可能是因为藻种活力较弱,因此再生长过程中渐增期明显延长即生长周期的延长,检测时间占整个生长周期的比例减小,造成拟合曲线预测性指标的准确性下降,但实际检测所得数据仍准确。这表明当藻种活力较弱时,运用拟合模型应适当延长检测的时间范围以获得更加丰富的数据用来准确的预测生长规律。
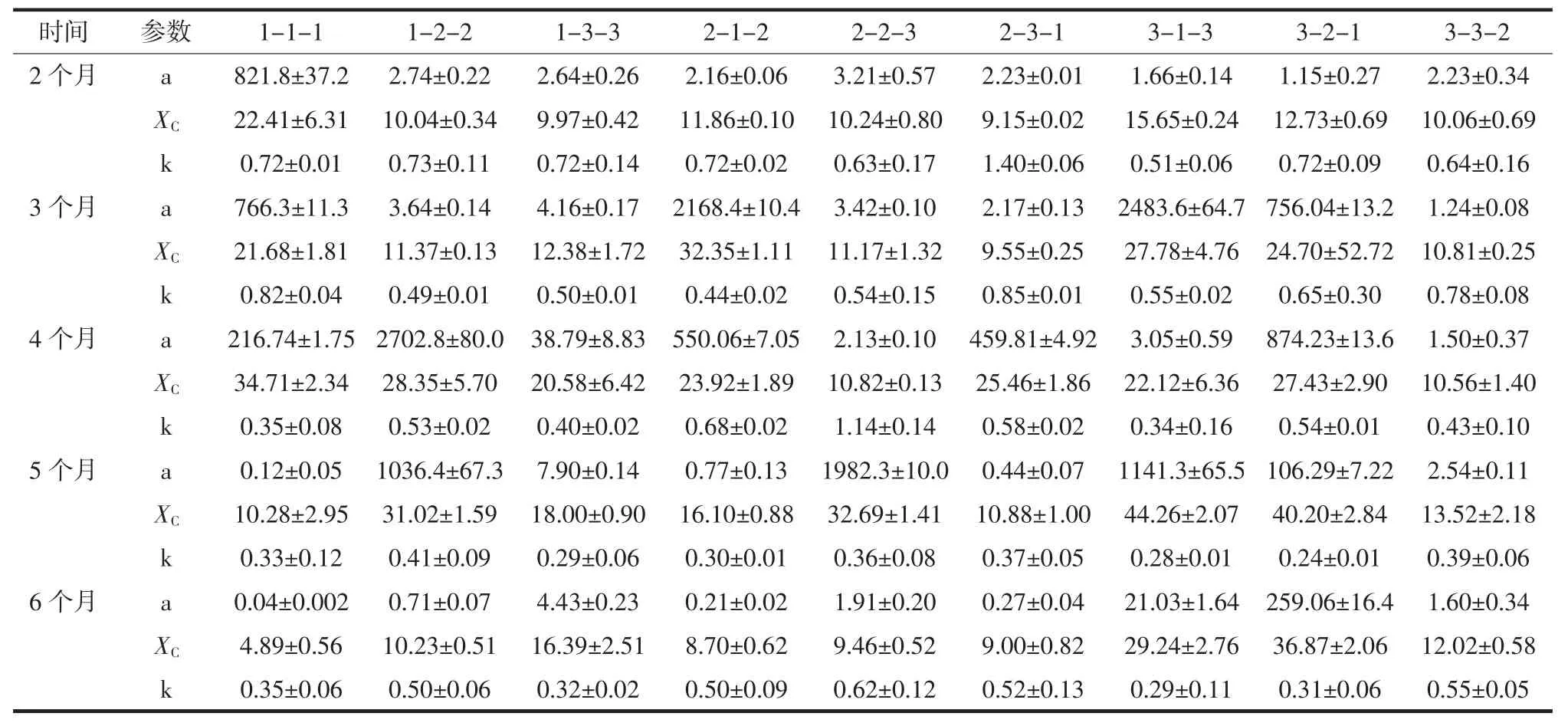
表3 SLogistic1模型对再生长曲线的拟合结果Table 3 The fitting results of SLogistic1 model to the regrowth curve
2.4 极差分析及SPSS分析
本试验中藻种活力评价体系所包含的特征指标为渐增期时间、生物积累量、检测范围内的最大生长速率(0≤X≤13 d)。在对SLogistic1拟合生长曲线的各项指标进行统计,由于一部分生长曲线未能全部覆盖快增期和缓增期,因此对于快增期时间、生长速率峰值、生长速率峰值真实发生时间都不能得到完整真实的统计。发生这种现象可能也是由于随着保藏时间的延长,藻种活力逐渐下降,渐增期逐渐延长,仅测定两周的生长状态无法使生长曲线包含完整的快增期,因此在统计分析数据时导致拟合生长曲线所展示的生长速率最大值并不是生长速率曲线的峰值,而是拟合速率曲线在X∈[0,13]时的最大值。求各个特征指标2~6个月的均值,统计结果并进行极差与正交分析。
正交试验结果见表4,对生物积累量、最大生长速率与渐增期时间的极差分析结果分别见表5、表6与表7。
由极差分析表可知,3种因素对生物积累量影响大小依次是:海藻糖浓度>光照强度>藻液浓度,均值(K)可得最优组合为A2B3C3;对最大生长速率影响大小依次是:光照强度>藻液浓度>海藻糖浓度,均值可得最优组合为A1B3C3;对渐增期时间影响大小依次是:藻液浓度>海藻糖浓度>光照强度,均值可得最优组合为A2B3C2(渐增期越小表明藻种保藏结果越好)。方差分析结果表示在a=0.05水平下,3个因素对3个评价指标均未达到显著水平。
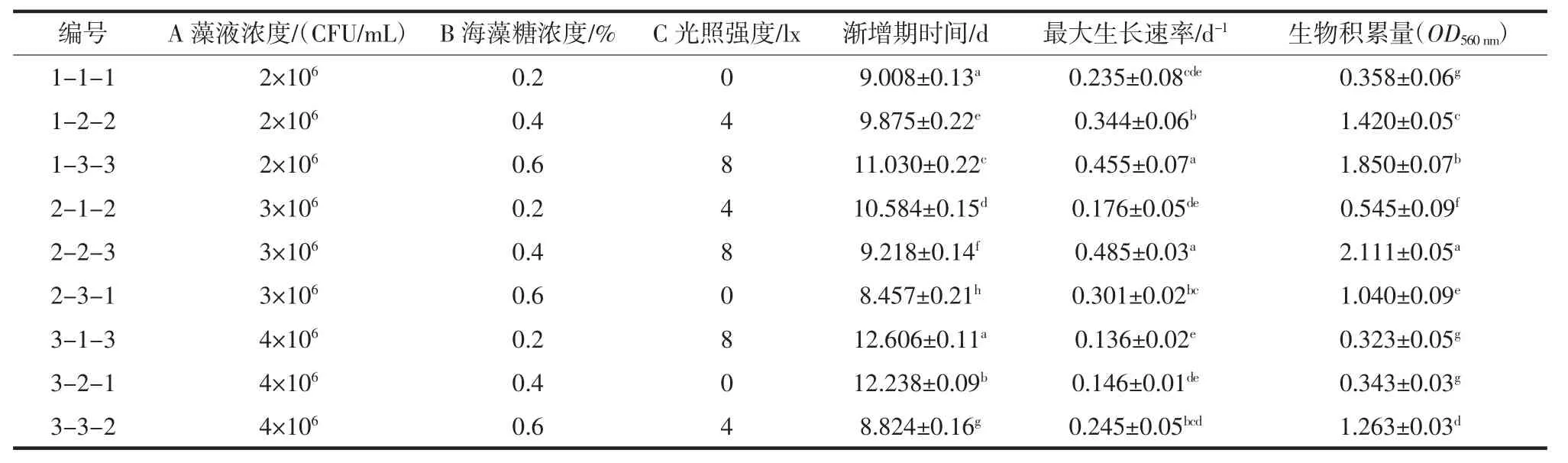
表4 正交试验结果Table 4 Orthogonal test results
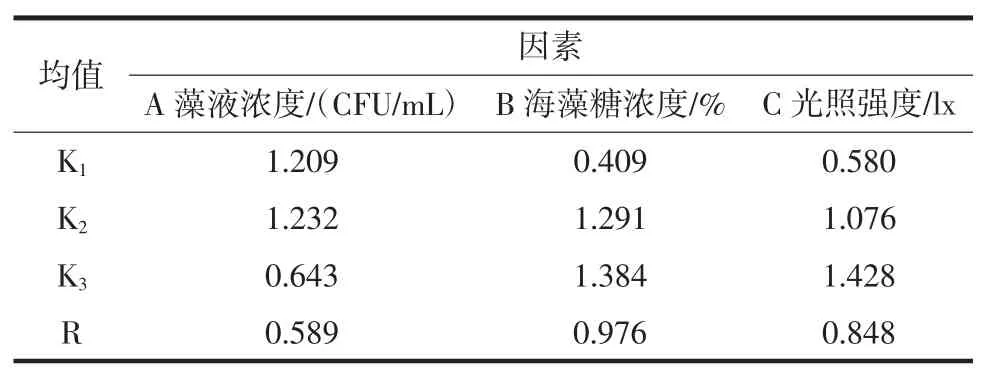
表5 生物积累量的极差分析数据表Table 5 Variance analysis data table of biological accumulation amount
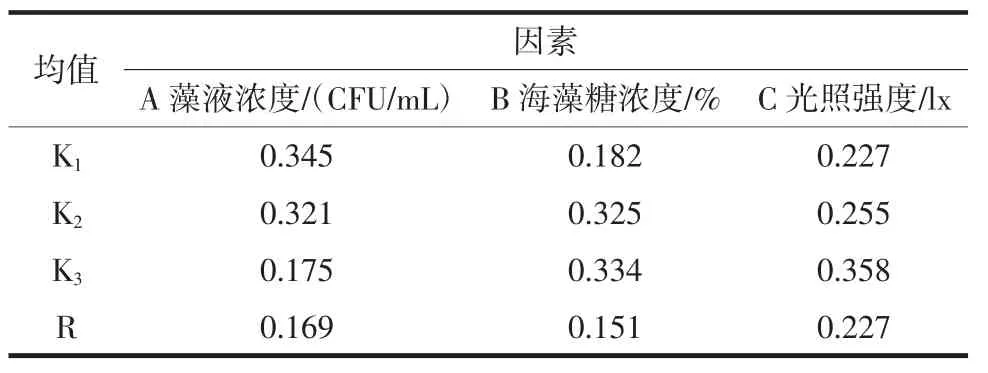
表6 最大生长速率的极差分析数据表Table 6 Variance analysis data table of maximum growth rate
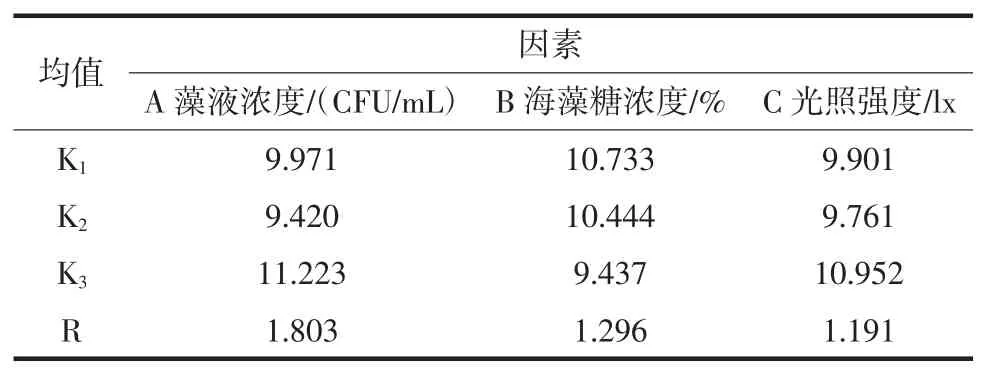
表7 渐增期时间的极差分析数据表Table 7 Variance analysis data table of delayed growth period
综合藻种活力评价体系的特征指标的分析结果可以看出:螺旋藻F-1070以海藻糖保护剂进行低温弱光保藏时的保藏条件最优组合为A1/2B3C2/3,藻液浓度 2×106CFU/mL~4×106CFU/mL 以 15%浓度的海藻糖做保护剂,于弱光照下保藏(保藏箱恒温4℃),进行再生长的螺旋藻F-1070在第13天的生物积累量较高,同时渐增期更为短暂,能够更快地步入快增期阶段,且具有更大的生长速率峰值,这有利于生物量的积累,也表明在藻种活力方面明显更具有优势,相比于其他条件组合更为理想。
2.5 叶绿素a含量分析
叶绿素a变化趋势见图5。
由图5可知,光照对螺旋藻的生理状态有着较为明显的影响[23],叶绿素a的合成与代谢能力与光照相关[24]。对再生长藻种进行叶绿素a的测定,计算2~6个月每组的叶绿素a均值,作图并比较结果,结果显示编号3-3-2、1-3-3的叶绿素a含量在整个生长周期中都有着较为明显的优势,而编号3-2-1、1-1-1的叶绿素含量较低,前者共同特点是具有15%的海藻糖保护剂以及弱光照条件,后者不具有光照条件且海藻糖浓度较低。这一结果与正交试验结果一致,表明光照是以海藻糖为保护剂的低温弱光保藏中重要的因素,影响藻种F-1070的菌种保藏效果。
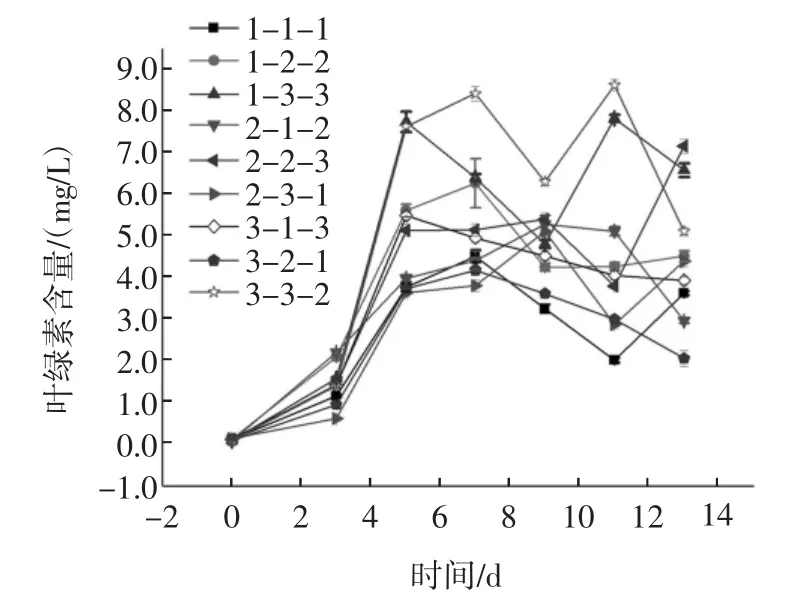
图5 叶绿素a变化折线图Fig.5 Broken line diagram of chlorophyll a change
3 结论与讨论
通过藻种的耐低温性测定试验选取螺旋藻F-1070,作为低温弱光保藏试验的试验藻种,进一步对添加海藻糖保护剂的浓缩藻液的低温弱光保藏法进行正交试验以优化保藏条件。通过对正交试验藻种的再生长结果进行生长曲线拟合与分析,统计特征指标后建立以生物积累量、最大生长速率以及渐增期时间为指标的评价体系,结果表明以海藻糖为保护剂时的低温弱光保藏的较优保藏条件为:浓缩藻液以15%的海藻糖浓度在弱光照下保藏,相应的藻株保存6个月仍保持良好的活力。
本试验在研究低温弱光保藏的方法中,初步了解藻液浓度、保护剂种类、海藻糖浓度和光照强度对保藏效果的影响。单就弱光照这一保藏条件来看,结果与尤珊[8]试验结果一致,即弱光照有利于微藻在低温下保藏。海藻糖作为保护剂的保藏结果与王永红等[25]一致,表明海藻糖作为保护剂,可以提高菌种保藏质量。SLogistic模型对于微藻的生长可以有一个较为完整的描述,通过对利用模型拟合的生长曲线的分析与比较,能够较为准确的把握菌种活力、细胞生长状态,通过对比分析特征指标从而评价菌种质量,或是应用于生产中作为初步判断生产质量的简易有效的测评方法。目前,螺旋藻的低温弱光保藏法相关的研究较少,本试验的藻种低温弱光保藏相比于阎斌伦等[26]的低温弱光保藏法保藏时间更长,菌种活力更好。本试验为今后选择更适合于螺旋藻不同藻种的普适性方法做出了初步研究,并且该保藏方法保存体积小、占用空间少、取用方便,适用于保存菌种较多、不定期取用、长时间保存的情况。
