超声波-微波协同辅助萃取紫苏叶黄酮工艺优化及其抗氧化活性研究
2020-09-10
(齐齐哈尔工程学院,黑龙江齐齐哈尔161005)
紫苏是一年生直立草本植物,在中国常用于中药,具有极强的经济价值。目前,针对紫苏资源的开发多集中在紫苏油上。大多数植物油是非常好的亚油酸来源,但只有很少的植物油在饮食中含有大量的α-亚麻酸(α-linolenic acid,α-LNA)。其中,紫苏籽油中n-3脂肪酸含量最高,约占57%[1-2]。一些研究表明,α-LNA及其高级衍生物在生理学上具有某些独特和必需的功能[3],n-3脂肪酸摄入的增加会具有降低血脂的功能[4-5]。据报道,紫苏油可改善学习能力、视网膜功能、抗氧化、抑制癌变和转移等[6]。紫苏叶也具有极高的经济利用价值,是一种良好的保健食物来源之一。其具有抗氧化、增强机体对外界致敏原的抵抗能力、抑菌、抗肿瘤等生物活性,主要是其含丰富的酚类化合物,如精油、迷迭香酸、花青素、咖啡酸、维生素和矿物质[7-13]。因此,针对于紫苏叶中黄酮的提取,对其资源的开发以及高值化应用具有重要的经济效益和实际意义[14]。
但目前关于紫苏叶的研究多集中于提取及纯化上,且提取工艺主要包括溶剂提取法[15-16]、超声辅助提取法和微波辅助提取等工艺[17-18]。但是关于利用超声微波协同辅助萃取紫苏叶黄酮的工艺鲜有报道。超声-微波协同辅助萃取是超声辅助法和微波辅助法发展起来的一项新技术,是超声与微波的有机结合,充分利用了微波的高能穿透效应和超声空化碰撞效应,克服了常规提取、超声辅助提取和微波辅助提取的缺点,并且提取速度快,效率高[19-20]。此外,研究表明黄酮具有抗氧化、抗衰老、抗炎、镇痛和抗肿瘤等生物活性,在保健品、医药和食品等领域均具有广阔的实用价值[21-23]。但是关于紫苏叶黄酮的体内抗氧化活性还尚未见报道。
因此,本文以紫苏叶为原料,利用超声-微波协同辅助萃取紫苏叶黄酮,以紫苏叶黄酮提取量为指标,确定其最佳提取工艺参数,并通过H2O2诱导RAW264.7巨噬细胞构建氧化应激模型,测定紫苏叶黄酮对巨噬细胞增殖率及胞内抗氧化物酶系的影响,进一步探讨其体内抗氧化活性研究,为紫苏叶黄酮的工业化生产和紫苏叶生物活性物质的深度开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
紫苏叶:吴氏生态农业有限公司;芦丁对照品:上海源叶有限公司;RAW264.7巨噬细胞:武汉大学生命科学学院;DMEM高糖培养基:索莱宝生物有限公司;低内毒素胎牛血清、磷酸缓冲盐溶液(phosphate buffer saline,PBS)、胰酶消化液、CCK-8 试剂盒:碧云天生物制剂研究所;抗氧化物酶试剂盒:上海酶联有限公司;乙醇、过氧化氢、氢氧化钠、硝酸铝、抗坏血酸(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
CW-2000超声-微波协同辅助萃取仪(超声功率固定300 W):上海新拓微波溶样测试技术有限公司;Pulverisette 14多功能粉碎机:德国飞驰有限公司;BBS-SDC超净工作台:山东博科生物产业有限公司;MSE124S-OCE-DU电子分析天平:赛多利斯(上海)贸易有限公司;HF-90 CO2培养箱:上海力康医疗设备有限公司;UV-2600型紫外-可见分光光度计:日本岛津公司;ELX-800酶标仪:赛默飞有限公司。
1.3 方法
1.3.1 黄酮提取工艺及提取量的测定
将紫苏叶在60℃的条件下烘干4 h,多功能粉碎机粉碎后过40目筛,准确称取20.0 g紫苏叶粉置于烧杯内,在不同的料液比、乙醇浓度的条件下,置于超声-微波协同辅助萃取仪进行萃取,于不同的提取时间和微波功率下提取紫苏叶黄酮,提取液8 000 r/min离心10 min,采用以芦丁为标准的比色法测定黄酮含量[24],于510 nm波长处测量吸光度,并计算紫花叶黄酮的提取量。
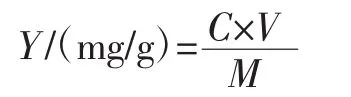
式中:C为提取液中黄酮含量,mg/mL;V为提取液体积,mL;M为紫苏叶质量,g。
1.4 超声波-微波协同辅助萃取黄酮工艺条件的选择
1.4.1 单因素试验设计
设置4个因素的不同水平,即料液比1∶5、1∶10、1 ∶15、1 ∶20、1 ∶25(g/mL),乙醇体积分数 60%,提取时间10 min,微波功率100 W;乙醇体积分数为50%、60%、70%、80%、90%,料液比 1∶10(g/mL),提取时间10 min,微波功率100 W;提取时间5、10、15、20、25 min,液料比 1 ∶10(g/mL),乙醇体积分数 60%,微波功率 100 W;微波功率 0、100、300、500、700 W,液料比 1∶10(g/mL),乙醇体积分数 60%,提取时间 10 min;研究不同提取条件对紫苏叶黄酮提取效果的影响。
1.4.2 响应面优化超声波-微波协同辅助萃取紫苏叶黄酮工艺
根据单因素试验试验结进行Box-Behnken试验设计,以黄酮提取量为指标,确定最优黄酮提取条件,试验因素水平编码见表1。
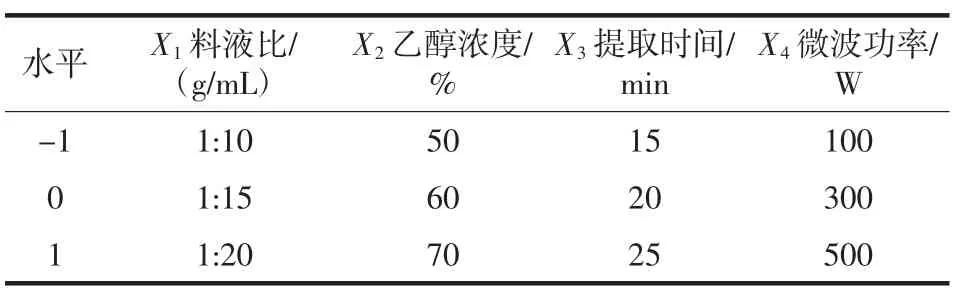
表1 Box-Behnken试验设计因素水平编码表Table 1 Factors and code levels
1.5 紫苏叶黄酮抗氧化活性的检测
参照何力[25]的方法进行紫苏叶黄酮的纯化(纯化后的紫苏叶黄酮纯度为84.68%),在此基础上进行抗氧化活性试验。
1.5.1 细胞的培养和分组
试验分为正常对照组、模型对照组和紫苏叶黄酮试验组。其中正常对照组:不加紫苏叶黄酮和H2O2干预处理,只加入等体积的无胎牛血清的培养基溶液;模型对照组:不加紫苏叶黄酮干预,加入等量的无胎牛血清的培养基溶液培养24 h后,加入终浓度为2 mmol/L H2O2溶液刺激1 h;紫苏叶黄酮试验组:紫苏叶黄酮(总浓度分别为 50、100、200、400 μg/mL)干预24h后,加入终浓度为2 mmol/L H2O2溶液刺激1h。具体细胞培养的方法参照郭增旺等[26]的方法进行。
1.5.2 紫苏叶黄酮对H2O2诱导RAW264.7氧化损伤细胞存活率的影响
参照马萍等[27]的方法,并略加改动。按CCK-8法试剂盒说明书进行试验,并测定存活率。其计算公式如下所示。

1.5.3 紫苏叶黄酮对H2O2诱导HepG2氧化损伤细胞的胞内抗氧化酶系的影响
参照马萍等[27]的方法,并略加改动。按照1.5.1分组方法处理细胞后,采用预冷的PBS缓冲液进行洗涤3遍后刮取细胞,并加入100 μL细胞裂解液,收集裂解液后4℃、12000×g离心10min。取上清液按照试剂盒说明书操作检测过氧化物歧化酶(superoxide dismutase,SOD),谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)及过氧化氢酶(catalase,CAT)的酶活力。
1.6 数据处理
本试验均重复3次测定值的平均值±标准偏差,采用SPSS 20.0软件的对数据进行差异显著性分析(One Way ANOVA),P<0.05表明具有差异显著性,采用Design Expert 8.0软件分析响应面试验结果。
2 结果与分析
2.1 标准曲线绘制
配制芦丁标准溶液,绘制黄酮浓度与吸光度值的标准线性回归方程:A=8.110 7C+0.005 6,其中R2=0.996 2,则紫苏叶黄酮提取量的计算公式如下所示。
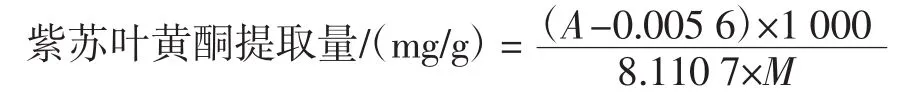
式中:M为紫苏叶的质量,g;A为紫苏叶黄酮提取液的吸光度值。
2.2 单因素试验分析
2.2.1 料液比对紫苏叶黄酮提取量的影响
料液比对紫苏叶黄酮提取量的影响见图1。
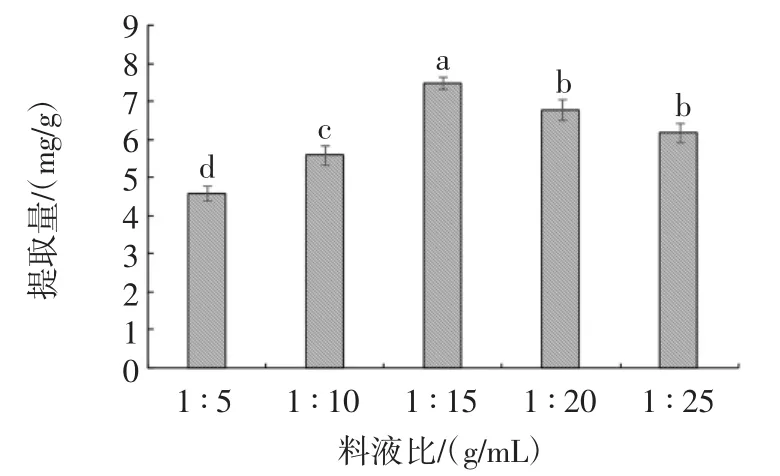
图1 料液比对紫苏叶黄酮提取量的影响Fig.1 Effect of liquid ratio on the extraction of flavonoids from perilla leaf
由图1可知,随着溶剂体积的增加,紫苏叶黄酮提取率呈现先升高后下降的趋势,且当料液比为1∶15(g/mL)时,紫苏叶黄酮的提取率达到最高。当溶剂体积较少时,浸提体系的溶质和溶剂更易达到相互扩散的动态平衡,导致紫苏叶黄酮的提取量较低;随着溶剂体积的升高,紫苏叶里的黄酮成分更易扩散到溶液中,导致黄酮的提取量提高;但当溶剂体积过高时,射流空化所作用的能量更多的辐射在溶剂上,导致紫苏叶中的溶质分子所吸收的能量有所下降,还伴随着溶出了其他脂溶性杂质[28],这不但会降低黄酮的提取量而且造成后续浓缩的工业成本升高,故选择料液比为1 ∶15(g/mL)。
2.2.2 乙醇浓度对紫苏叶黄酮提取量的影响
乙醇浓度对紫苏叶黄酮提取量的影响见图2。
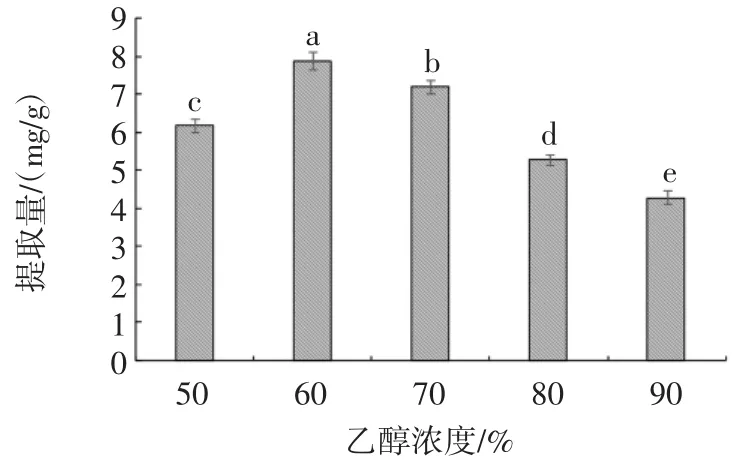
图2 乙醇浓度对紫苏叶黄酮提取量的影响Fig.2 Effect of ethanol concentration on the extraction of flavonoids from perilla leaf
由图2可知,随乙醇浓度的增加,紫苏叶黄酮的提取率呈先增大后减小的趋势,且在乙醇浓度为60%时,提取量达到最大值。随着乙醇浓度的升高会引起紫苏叶细胞的溶胀系数的改变进而促进了乙醇及水分子在细胞内外的流动,从而使提取量增加[29];而当乙醇浓度超过60%后,材料细胞的溶胀系数不在变化,此时溶剂极性的下降可能成为了影响提取量的主要因素,导致醇溶性杂质、色素及脂溶性杂质与黄酮分子相互竞争的结合溶剂分子,引起黄酮类化合物的溶解度和结合率的降低[30],导致黄酮提取量下降。因此,选择乙醇浓度为60%。
2.2.3 提取时间对紫苏叶黄酮提取量的影响
提取时间对紫苏叶黄酮提取量的影响见图3。
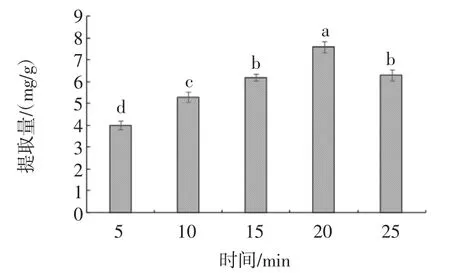
图3 提取时间对紫苏叶黄酮提取量的影响Fig.3 Effect of jet cavitation time on the extraction of flavonoids from perilla leaf
由图3可知,随着提取时间的增加,黄酮提取量先增加后减小,且提取时间为20 min时黄酮提取量达到最大。在超声与微波的协同作用会增强分子的振荡和碰撞[31],紫苏叶黄酮会快速进入乙醇溶液,有助于增加黄酮提取量;但提取时间过长会破坏黄酮的结构,同时黄酮类化合物会随着溶剂的不断蒸发而损失或降解[32],从而引起黄酮提取量降低。因此,选择提取时间为20min。
2.2.4 微波功率对紫苏叶黄酮提取量的影响
微波功率对紫苏叶黄酮提取量的影响见图4。
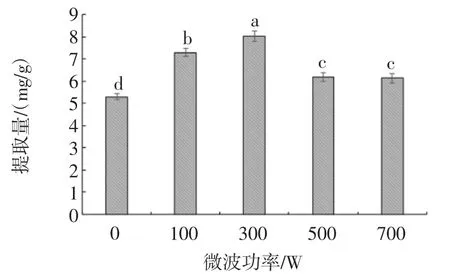
图4 微波功率对紫苏叶黄酮提取量的影响Fig.4 Effect of microwave power on the extraction of flavonoids from perilla leaf
由图4可知,紫苏叶黄酮提取量随着微波功率的升高呈先升高后下降的趋势,且在微波功率为300W时提取量达到最高。这可能是由于微波能促进植物细胞壁的破裂和分子的布朗运动,进而促进了紫苏叶黄酮分子的溶出,导致紫花叶黄酮的提取率随着微波功率的升高而逐渐升高[33]。但是过高的微波功率会导致紫苏叶黄酮发生一定的氧化反应和降低,且会促进其他醇溶性杂质的溶出,进而导致其提取率的下降[34]。因此,选择最佳的微波功率为300 W。
2.3 响应面试验结果分析
2.3.1 试验模型的建立及其显著性检验
根据单因素试验结果,采用Design Expert 8.0软件对试验数据进行多元回归拟合,分析各因素对紫苏叶黄酮提取量(Y)的影响,试验方案及结果见表2。
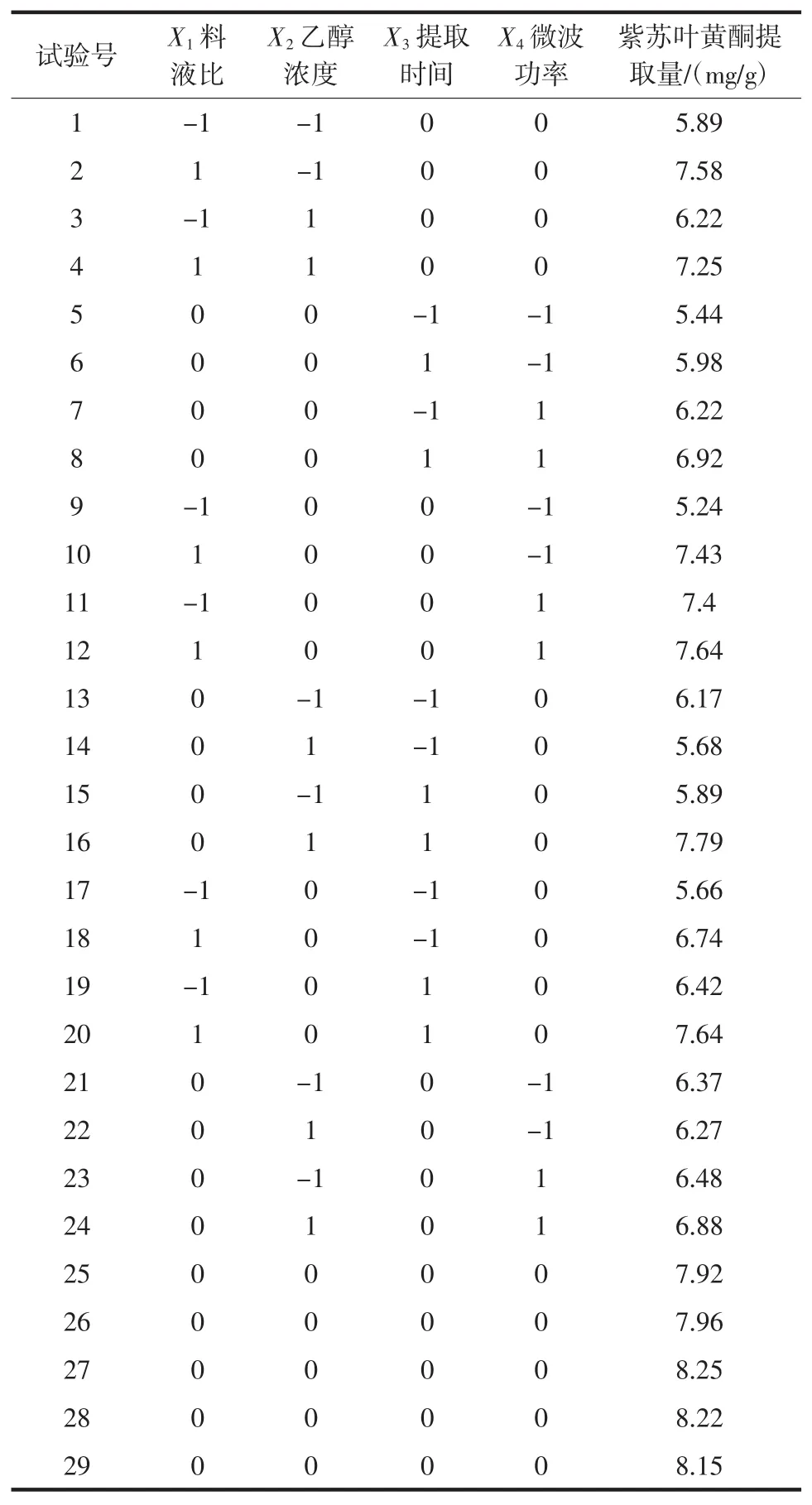
表2 试验方案及结果Table 2 Experiment structural matrix and results
用Design Expert 8.0软件对表2的结果进行多元回归分析,得到紫苏叶黄酮提取量(Y)与料液比(X1)、乙醇浓度(X2)、提取时间(X3)、微波功率(X4)的编码的二次多项式回归方程如下:
Y=8.10+0.62X1+0.14X2+0.39X3+0.40X4-0.16X1X2+0.035X1X3-0.49X1X4+0.60X2X3+0.12X2X4+0.04X3X4-0.46X12-0.79X22-1.03X32-0.82X22
其中模型决定系数R2=0.958 6校正的R2=0.917 2。
回归模型方差分析见表3。
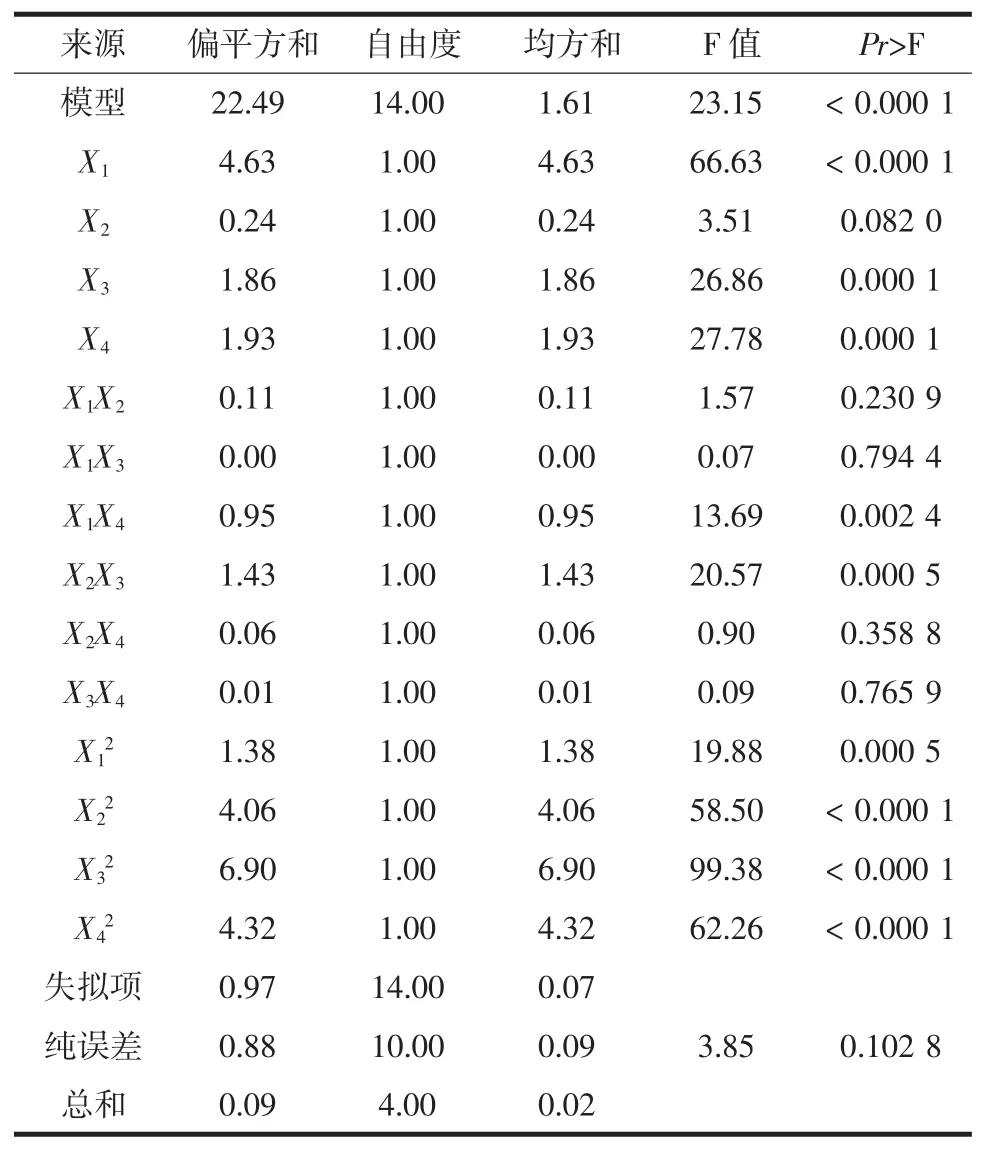
表3 方差分析Table 3 Analysis of variance(ANOVA)for the quadratic model
从表3中可以得出模型的F值为23.15,对应的P值小于0.000 1,表明达到极显著水平,且失拟项P为0.102 8大于0.05,表明差异不显著,这说明该模型对紫苏叶黄酮的提取量具有较好的拟合度,可用于模型分析。由F值可知,各因素的主次顺序为:料液比>微波功率>提取时间>乙醇浓度。回归方程系数显著性检验结果:X1、X3、X4的一次项及二次项均达到极显著水平(P<0.01),X2的一次项差异不显著(P>0.05)、二次项达到极显著性水平(P<0.01);交互项 X1X4,X2X3达到极显著(P<0.01),其他交互项均不显著。
2.3.2 因素交互效应分析
响应面相互作用见图5。
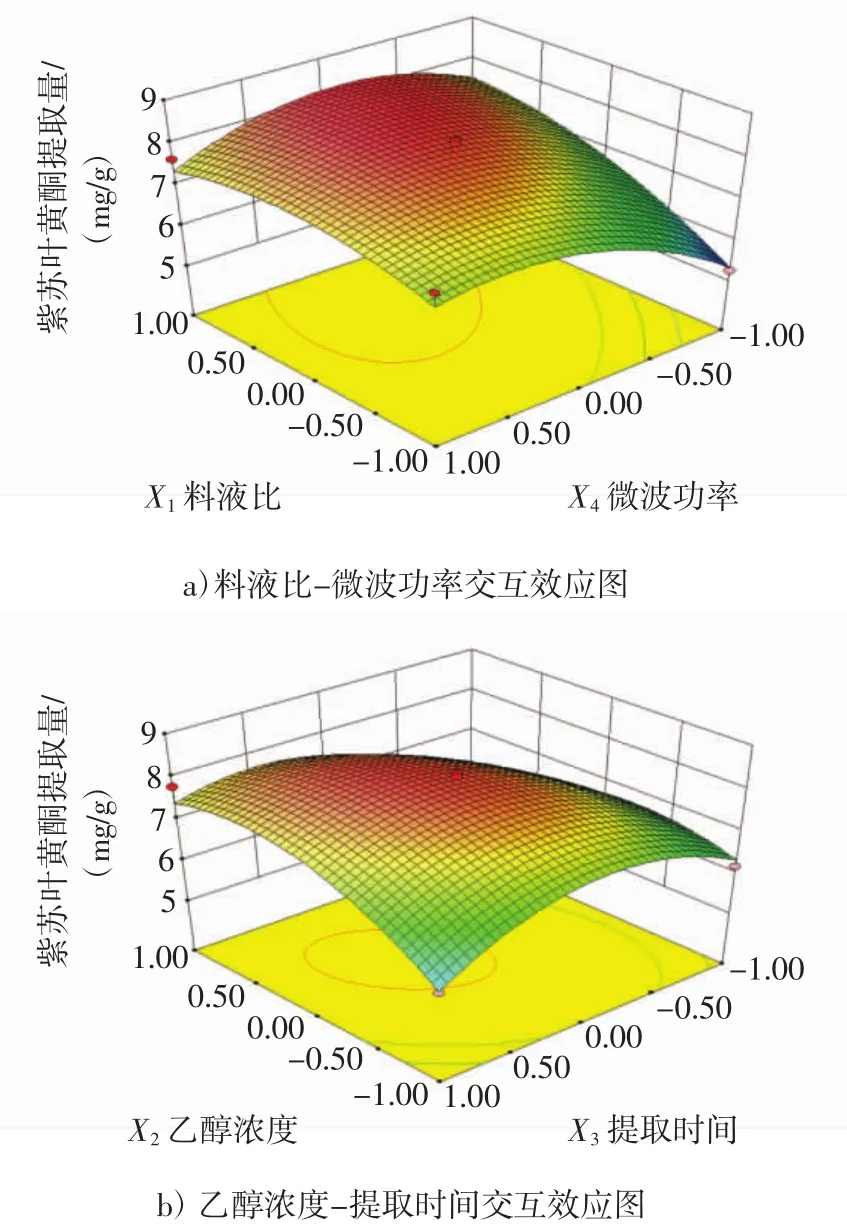
图5 交互效应图Fig.5 Interaction effect diagram
由图5可知,紫苏叶黄酮提取量随着各因素的编码水平增高呈现先升高后下降的趋势。通过比较各因素等高线的密集程度发现,乙醇浓度等高线的密集程度显著低于料液比、提取时间和微波功率的等高线,这表明乙醇浓度对紫苏叶黄酮提取量的影响因子显著低于料液比、提取时间和微波功率;通过比较因素交互作用中心和底部等高线的中心点位置发现,图5a和5b的两者位置均发生了明显偏移,这表明料液比-微波功率间的交互作用和乙醇浓度-提取时间的交互作用均较为显著,这些结果均和方差分析结果一致。因此,交互作用表明只有4个试验因素进行合理组合的情况下,才能获得最优的紫苏叶黄酮的提取工艺。
2.3.3 最优工艺验证
根据优化试验得到紫苏叶黄酮的最佳提取工艺参数为:料液比为 1 ∶17(g/mL),乙醇浓度为 62%,时间为20 min,微波功率为300 W,在此条件下预测得到黄酮提取量为8.28 mg/g。根据此条件进行验证试验后获得的实际提取量为8.33 mg/g,误差小于1.0%,说明优化后的工艺条件可靠,方程拟合良好,具有参考价值。
2.4 紫苏叶总抗氧化活性分析
2.4.1 紫苏叶黄酮对H2O2刺激RAW264.7细胞增殖的影响
紫苏叶黄酮对H2O2刺激RAW264.7细胞增殖的影响见表4。
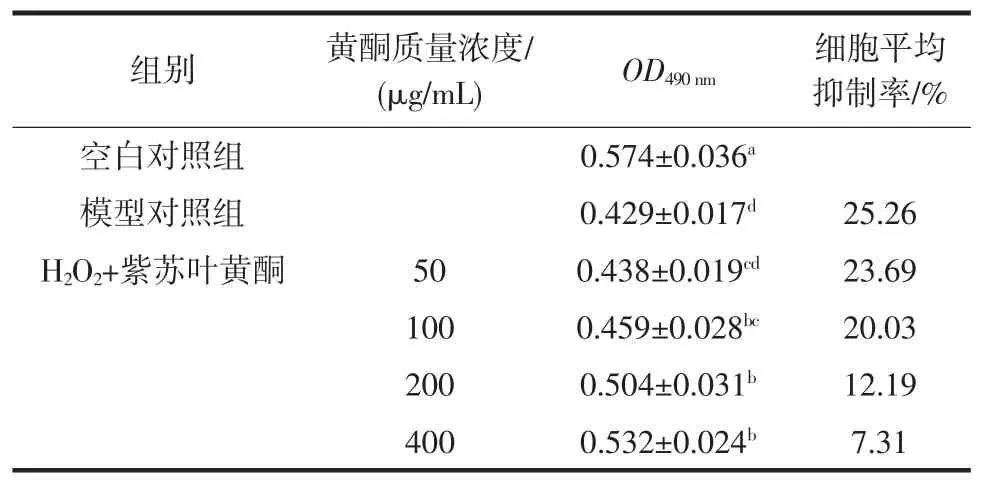
表4 紫苏叶黄酮对H2O2刺激RAW264.7细胞增殖的影响Table 4 Effects of perilla leaf flavonoids on the proliferation of RAW264.7 cells stimulated by H2O2
细胞的增殖率是反映外界环境对细胞损伤的最直观指标。氧化应激环境可以导致胞内活性氧升高和氧化应激酶系失活,进而导致细胞发生氧化损伤和引起细胞凋亡[35]。H2O2是一种常见的氧化应激源,在氧化应激试验中常作为模型药物进行构建体外氧化应激损伤模型,其分子中的O22-能和胞内铁离子和膜上脂质物质及蛋白质发生氧化应激反应,造成细胞氧化损伤[36]。由表4可知,与正常组相比,氧化应激模型组的细胞存活率显著下降(P<0.05),这表示H2O2构建的RAW264.7氧化应激模型成功,可用于后续试验;与氧化应激模型组相比,紫苏叶黄酮在剂量高于100 μg/mL可显著提高细胞的存活率(P<0.05),且呈现剂量依赖性关系。这表明紫苏叶黄酮在一定程度上对RAW264.7具有保护作用,能显著缓解H2O2对RAW264.7的氧化应激损伤,从而提高细胞的存活率,具有一定的抗氧化效果。
2.4.2 紫苏叶黄酮对H2O2刺激RAW264.7胞内抗氧化酶系的影响
紫苏叶黄酮对H2O2刺激RAW264.7胞内抗氧化酶系的影响见表5。
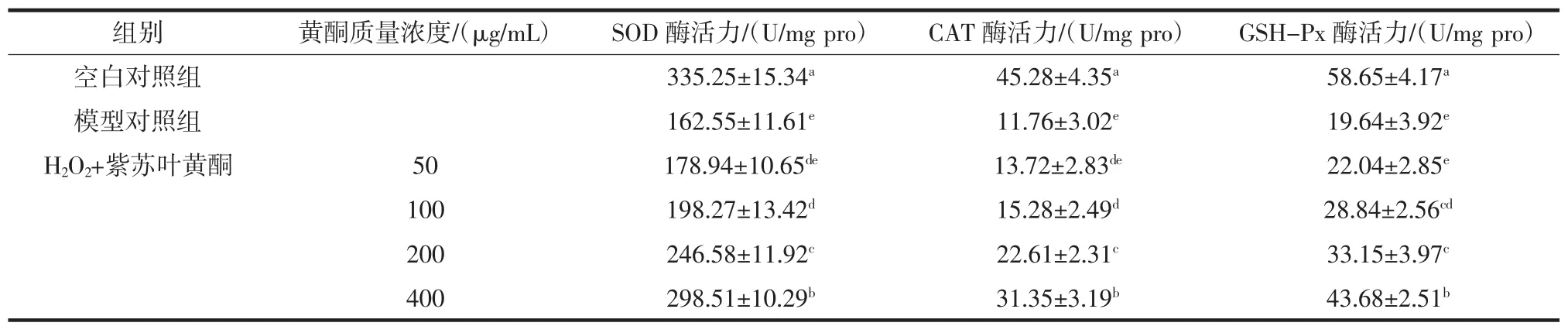
表5 紫苏叶黄酮对H2O2刺激RAW264.7胞内抗氧化酶系的影响Table 5 Effects of perilla leaf flavonoids on intracellular antioxidant enzymes stimulated by H2O2in RAW264.7
机体存在自身的氧化应激调节体系如酶抗氧化系统进行防御外界氧化应激源对机体造成伤害[37]。谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(SOD)和过氧化氢酶(CAT)是抗氧化物酶系的重要组成部分,其抗氧化物酶系酶活力的水平直接反映出机体对外界氧化应激源的平衡调控能力[38]。由表5可知,与正常组相比,氧化应激模型组的胞内酶活力显著下降(P<0.05),这表示H2O2降低RAW264.7细胞胞内的抗氧化酶活力,导致细胞氧化动态平衡遭到严重的破坏;与模型组相比,当紫苏叶黄酮在剂量高于100 μg/mL可显著提高胞内SOD、CAT、GSH-Px的酶活性(P<0.05)。这表明紫苏叶黄酮预培养后可显著缓解H2O2所引起的胞内抗氧化物酶系酶活力的降低和提高机体对外界氧化应激的调控能力。这和之前紫苏叶黄酮能缓解H2O2所引起细胞存活率降低的结果相一致。以上结果表明,紫苏叶黄酮的抗氧化作用可能与调节机体的抗氧化物酶系酶活力,恢复机体的氧化应激调节系统有关,但是其具体抗氧化机理还需要进一步的研究。
3 结论
研究结果表明,影响紫苏叶黄酮提取量因素大小顺序为料液比>微波功率>提取时间>乙醇浓度,最佳提取工艺参数为料液比是1∶17(g/mL)、乙醇浓度是62%、时间是20 min、微波功率是300 W,此工艺条件紫苏叶黄酮的提取量为8.33 mg/g;抗氧化试验显示,紫苏叶黄酮能显著提高氧化应激环境下RAW264.7细胞的存活率,恢复胞内抗氧化物酶系酶活力。这表明紫苏叶黄酮能通过提高胞内抗氧化酶系的活性进行缓解氧化应激损伤,是一种新型的天然抗氧化物。
