微波-超声波协同辅助优化阳荷多糖提取工艺及抗氧化性分析
2020-09-10
(1.陕西理工大学陕西省催化基础与应用重点实验室,陕西汉中723000;2.陕西理工大学化学与环境科学学院,陕西汉中723000)
阳荷(Zingiber strioatum),又名野山姜、瓣姜、野姜等,属姜科姜属多年生草本植物,在我国主要分布于云南、贵州、广西、四川、湖南和湖北等地[1]。阳荷是一种药食同源植物,其嫩芽、茎果均可食用,富含氨基酸[2]、蛋白质[3]、微量元素[4]、膳食纤维和黄酮类物质[5-6]等,具有抗氧化、抗菌、降血糖、活血调经和消肿解毒等功效,药用价值非常高。目前国内外对阳荷资源的研究主要集中于红色素提取工艺及稳定性研究、膳食纤维多糖、抑菌活性、氨基酸和蛋白质的分类及微量元素含量等方面[7]。多糖是单糖通过脱水形成的糖苷链,是一切有机体必不可少的生物聚合物,具有调节免疫力、抗病毒、抗氧化、降血脂等功效[8]。微波-超声波协同辅助提取多糖,将微波和超声波的优点相结合,促使植物多糖从植物细胞内释放速度更快、释放效率更高,具有提取时间短、提取温度低和提取效率高等优点[9-11]。目前,微波-超声波协同辅助提取阳荷中的多糖及抗氧化活性研究鲜有报道。本研究以陕南野生的阳荷为原材料,采用微波-超声波协同辅助提取阳荷多糖,通过响应面分析法优化其提取工艺;借助体外抗氧化模型进一步评价阳荷多糖的抗氧化性,以期为秦巴野生阳荷资源的进一步开发提供参考。
1 材料与方法
1.1 材料
阳荷:采集于汉中市汉台区,60℃恒温干燥箱中烘干,冷却至25℃后粉碎,过40目筛,脱脂(石油醚浸泡24 h),风干后密封备用。
双氧水(30%)、葡萄糖、无水乙醇、铁氰化钾、三氯乙酸(均为分析纯):国药集团上海化学试剂有限公司;邻二氮菲、硫酸亚铁、DPPH、三羟基氨基甲烷(Tris)、没食子酸(邻苯三酚)、ABTS、抗坏血酸(VC):均为分析纯,上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
EL104型电子分析天平:梅特勒-托利多仪器上海有限公司;JXL-2S-6A恒温水浴锅:金坛市金祥龙电子有限公司;UV-2600型紫外-可见分光光度计:日本岛津公司;WGL-125B电热鼓风干燥箱:天津TST仪器有限公司;KQ-7200D型超声波清洗器:宁波新芝生物科技股份有限公司;TDL-5-A型台式离心机:江苏金怡仪器科技有限公司。
1.3 试验方法
1.3.1 阳荷中多糖的提取及测定
准确称取一定量脱脂阳荷样品,准确加入一定体积柠檬酸-柠檬酸钠缓冲溶液(pH7),设定微波-超声波辅助提取条件,进行提取、离心得到多糖提取液。依据苯酚-硫酸法测定阳荷中的多糖含量,其计算公式如下:
阳荷多糖得率/%=[(n×C×V)/m]×100
式中:m为准确称取多糖样品质量,g;n为稀释倍数;C为待测样品的浓度,mg/mL;V为准确移取待测样品的体积,mL。
依据文献方法[12]绘制葡萄糖溶液标准曲线,得到标准线性回归方程为:y=10.859x+0.105 2,R2=0.999 2。
1.3.2 单因素试验与阳荷多糖得率的影响
依据1.3.1试验方法,考察缓冲溶液pH值、微波功率、微波时间、超声功率、提取时间、提取温度和料液比对阳荷多糖得率的影响。在试验过程中,各因素的考察范围分别为:缓冲溶液 pH 值 4、5、6、7、8;微波功率 100、200、300、400、500 W;微波时间 1、2、3、4、5 min;超声功率 280、350、420、490、560 W;提取时间5、10、15、20、25 min;提取温度 30、40、50、60、70 ℃;料液比 1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50(g/mL)。
1.3.3 响应面分析试验与阳荷多糖提取工艺的优化
在试验过程中,固定微波功率200 W,微波时间3 min,依据Box-benhnken中心组合试验设计原理,以超声功率、提取时间、提取温度和料液比4个因素为自变量,设计四因素三水平共计27个试验点的响应面分析试验,其因素与水平详见表1。

表1 响应面分析因素的因素与水平Table 1 Factors and levels of response surface analysis
1.3.4 阳荷多糖的抗氧化性分析
依据文献[13]的方法,测定阳荷多糖清除ABTS+自由基能力;依据文献[14]方法,测定阳荷多糖清除羟基自由基(·OH)的能力;依据文献[15]方法评价阳荷多糖清除超氧阴离子自由基(O2-·)能力;依据文献[16]方法评价阳荷多糖清除DPPH自由基能力。配置同浓度的抗坏血酸溶液,相同的试验条件下进行对照试验,其清除率计算公式如下:

式中:A0为自由基与缓冲溶液的吸光度值;A样品为阳荷多糖和自由基混合溶液的吸光度值;Ai为阳荷多糖与蒸馏水溶液的吸光度值;A损伤为过氧化氢与缓冲溶液的吸光度值;A未损为蒸馏水代替过氧化氢溶液的吸光度值。
2 结果与分析
2.1 单因素试验对阳荷多糖得率的影响
2.1.1 缓冲溶液pH值影响
以料液比1∶30(g/mL),微波功率200 W,微波处理1 min后,设定超声功率350 W,提取温度60℃继续超声辅助提取15 min后,研究柠檬酸-柠檬酸钠缓冲溶液的pH值对阳荷多糖得率的影响,结果见图1。
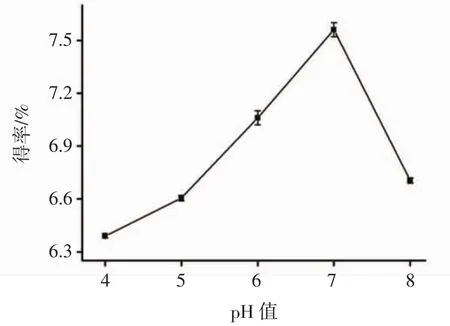
图1 pH值对多糖得率的影响Fig.1 Effect of pH value on the polysaccharide extraction rate
由图1可知,随着柠檬酸-柠檬酸钠缓冲溶液pH值的逐步增大,多糖得率呈现先增大后减小的趋势。当缓冲溶液pH值到达7时,多糖得率最大。这是因为不同pH值下多糖中一些特定基团的溶解程度不同[17],因此,选择pH 7的柠檬酸-柠檬酸钠缓冲液为提取溶剂。
2.1.2 微波功率影响
选定料液比 1∶30(g/mL),缓冲溶液的 pH 7,设定超声功率350 W,提取温度60℃继续超声辅助提取15 min后,考察不同微波功率微波处理1 min后对阳荷多糖得率的影响,试验结果见图2。
阳荷多糖得率伴随微波功率的增加呈现先增后减趋势,当微波功率达到200 W时阳荷多糖得率达到最大,由于多糖得率会随着微波功率的增强而出现氧化分解,之后阳荷多糖得率随着提取功率的增加而逐渐减小,故选择提取微波功率200 W为宜。
2.1.3 微波时间影响
选定料液比 1∶30(g/mL),缓冲溶液 pH 7,设定超声功率350 W,提取温度60℃继续超声辅助提取15 min后,微波功率200 W条件下,考察不同微波处理时间对阳荷多糖得率的影响,试验结果见图3。
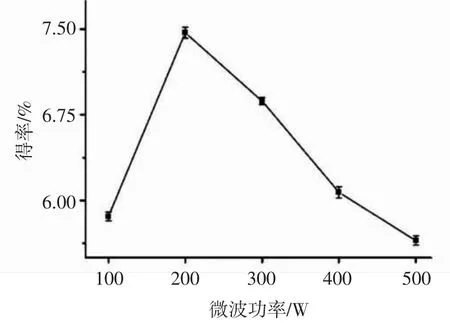
图2 微波功率对多糖得率的影响Fig.2 Effect of microwave power on the polysaccharide extraction rate

图3 微波时间对多糖得率的影响Fig.3 Effect of microwave time on the polysaccharide extraction rate
由图3可知,阳荷多糖得率随提取时间的增加,呈现先增后减趋势,在3 min时阳荷多糖的得率达到最大,多糖的浸出率达到了动态平衡,超过3 min后,多糖氧化分解速度逐渐增加,随时间的增加阳荷多糖得率逐渐下降。固定微波处理时间为3 min作为进一步优化提取的条件。
2.1.4 超声功率影响
选定料液比 1∶30(g/mL),缓冲溶液的 pH 7,设定微波功率200 W条件下微波时间1 min,继续60℃条件下超声辅助提取15 min,探索不同的超声功率对阳荷多糖得率的影响,试验结果见图4。
由图4可知,阳荷多糖得率随超声功率的增大先增加后减小,这是由于超声波可以加快水的振动,使传质强化,同时加大细胞的破碎程度,可以促进多糖的浸出,但多糖结构也会因为较大的超声功率而受到一定的破坏出现损失[18],所以选择420 W的功率提取阳荷多糖较为适宜。
2.1.5 提取温度影响
选定料液比 1∶30(g/mL),缓冲溶液的 pH 7,设定微波功率200 W条件下微波时间1 min,超声功率350 W条件下超声辅助提取15 min,探索不同的提取温度对阳荷多糖得率的影响,试验结果见图5。

图4 超声功率对多糖得率的影响Fig.4 Effect of ultrasonic power on the polysaccharide extraction rate
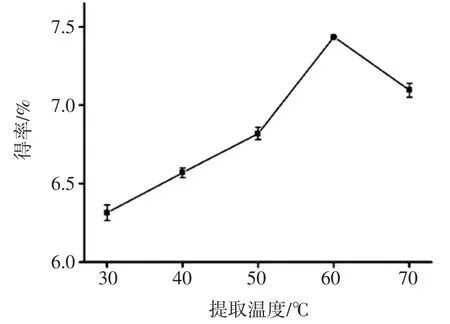
图5 提取温度对多糖得率的影响Fig.5 Effect of ultrasonic temperature on the polysaccharide extraction rate
由图5可知,阳荷多糖得率随提取温度的升高出现先增大后减小的趋势,在60℃温度时,阳荷多糖得率达到最大值,而后随温度的升高而逐渐下降。因为阳荷多糖结构受到过高的温度而遭受破坏,部分阳荷多糖被分解,因此,提取阳荷多糖时温度选择60℃。
2.1.6 提取时间影响
选定料液比1∶30(g/mL),缓冲溶液的 pH 7,设定微波功率200 W条件下微波时间1 min,超声功率350 W条件提取温度为60℃,探索不同的超声辅助提取时间对阳荷多糖得率的影响,试验结果见图6。
随着超声辅助提取时间的增加,阳荷多糖得率呈现先增加后减小的趋势,当超声处理时间为15 min时阳荷多糖得率达到最大值。当提取时间继续增加时,阳荷多糖的分子结构会因为溶液过热而受到破坏,导致阳荷多糖得率下降。因此超声辅助提取时间应选择15 min。
2.1.7 料液比影响

图6 提取时间对多糖得率的影响Fig.6 Effect of ultrasonic time on the polysaccharide extraction rate
选定缓冲溶液的pH 7,设定微波功率200 W条件下微波时间1 min,超声功率350 W,提取温度60℃条件提取15 min,探索不同的料液比对阳荷多糖得率的影响,试验结果见图7。

图7 料液比对多糖得率的影响Fig.7 Effect of solid to liquid on the polysaccharide extraction rate
由图7可知,阳荷多糖得率随溶剂体积增大逐渐增大当达到最大值后缓慢降低,料液比为1∶40(g/mL)时阳荷多糖得率达到最大值,此时多糖的溶出率已达到平衡,继续加入提取剂已不能够再产生更多的阳荷多糖,反而如果继续加入过多的提取剂则有可能会造成多糖的损失。因此最佳的料液比为1∶40(g/mL)。
2.2 响应面试验优化提取工艺
2.2.1 响应面分析试验方案及试验结果
固定pH 7柠檬酸-柠檬酸钠缓冲液为提取溶剂,微波功率200 W,微波时间3 min条件下,依据Box-Benhnken中心组合设计原理[19],选择A超声功率(W)、B提取时间(min)、C提取温度(℃)、D 料液比(g/mL)4个因素,设计四因素三水平共计27个试验点,响应面分析试验方案与结果见表2。
2.2.2 响应面试验结果分析与回归模型方差拟合
使用Design-Expert7.0软件,对响应面试验数据进行解析,回归分析得到结果见表3。
经二次回归拟合得到多糖得率与超声功率、提取温度、提取时间、液料比的函数表达式即回归方程为:
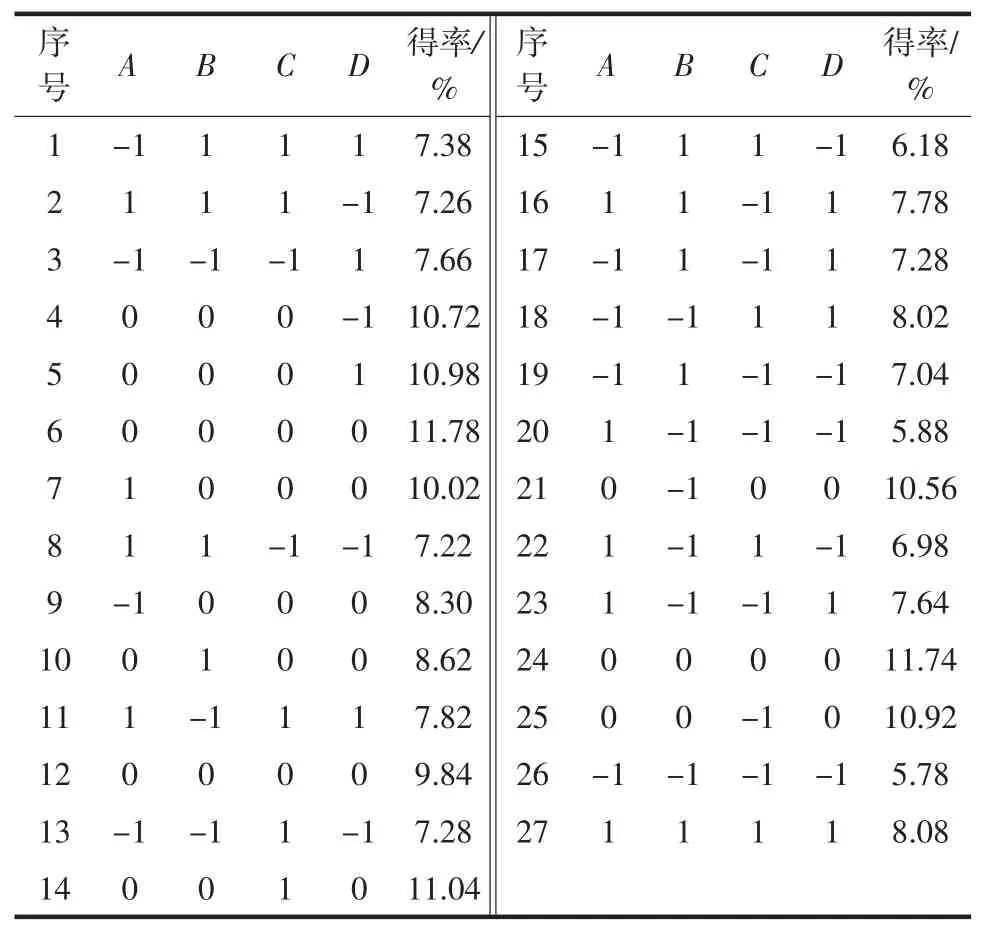
表2 响应面分析试验的设计及结果Table 2 Experimental design for response surface analysis and corresponding experimental data

表3 响应面的方差分析结果Table 3 The result of variance analysis regression for surface analysis
多糖得率/%=4.76+0.018A+2.778×10-3B+0.044C+0.13D+0.054AB-0.011AC+0.040AD+0.012BC-0.029BD+0.016CD-0.22A2-0.41B2-0.21C2-0.21D2
该回归模型,F 值 73.82,P<0.000 1,表明该试验所得的四元二次回归方程达到极显著水平,相关系数R2=0.978 8,说明四元二次回归方程预测值与试验值具有较高的相关性,超过97.88%的试验值可以利用该模型进行解释与预测。校正后的相关系数R2Adj=0.965 5,表明影响阳荷多糖得率的变化量有96.55%来自于所选变量。失拟项 F=3.30,(P=0.072 1>0.05),失拟项差异不显著,说明该试验误差较小,残差由随机误差引起。变异系数(C.V.%=2.13%小于5%),表明该回归方程拥有较好的重现性。由F及P值分析各因素交互性作用,可以看出BD、AB、AC、BC即提取时间和料液比、超声功率与提取时间、超声功率与提取温度、提取时间与提取温度的交互作用显著,其他因素之间的交互作用显著性相对较弱[20]。由F值分析各因素对阳荷多糖得率的影响强弱顺序为料液比>提取温度>超声功率>提取时间。综上分析,所建模型准确性和可信度高,可用于阳荷多糖的提取分析、预测。
2.2.3 最佳工艺条件及验证性试验
求解回归方程,得到阳荷多糖提取的最佳工艺条件为:超声功率454.30 W,提取温度为67.20℃,提取时间为15 min,料液比为1∶26.40(g/mL)。预测阳荷多糖的得率10.36%。为了方便实际试验操作,将理论条件进行近似处理,选择超声功率为454 W,超声辅助提取时间为 15min,提取温度为67℃,料液比为 1∶26(g/mL),在此工艺条件下,进行3次平行试验,得到的结果分别为10.31%、10.39%、10.41%,其平均值为10.40%。该值与理论预测值相比较,相对误差为0.35%,在试验允许误差范围内,说明响应面分析法优化阳荷多糖提取试验结果可靠,且该工艺具有稳定性和可行性。
2.3 阳荷多糖抗氧化性分析
2.3.1 阳荷多糖对DPPH·清除能力
图8是不同质量浓度阳荷多糖和VC清除DPPH·的活性对比图。

图8 DPPH·清除能力Fig.8 The elimination ability on DPPH·
由图8可知,在质量浓度为0.02mg/mL~0.39mg/mL范围内,VC对DPPH·清除率变化不明显,维持在96.00%左右。但阳荷多糖提取液对DPPH·的清除率随着浓度的变化逐渐升高。在浓度达到0.39 mg/mL时,阳荷多糖提取液对DPPH·清除率为90.2%,清除性能接近VC溶液。这表明阳荷多糖具有较强的DPPH·清除能力。
2.3.2 阳荷多糖对ABTS+自由基清除能力
不同质量浓度的阳荷多糖对ABTS+自由基清除活性如图9所示。

图9 ABTS+自由基清除能力Fig.9 The elimination ability on ABTS+·
随阳荷多糖质量浓度的增加,其清除ABTS+自由基活性逐渐增强,但同浓度的VC溶液清除ABTS+自由基活性变化缓慢,稳定在95.0%~98.0%之间。当阳荷多糖质量浓度提高到0.034 mg/mL时,其清除率达到97.6%,但低于VC溶液的清除活性。试验证明阳荷多糖具有一定的ABTS+自由基清除作用。
2.3.3 阳荷多糖对O2-·清除能力
不同质量浓度的阳荷多糖和VC溶液对O2-·清除活性如图10所示。

图10 O2-·清除能力Fig.10 The elimination ability on O2-·
较低浓度的阳荷多糖对O2-·清除活性相对较弱;伴随样品浓度的增加,阳荷多糖和VC溶液对O2-·清除活性逐渐升高;当VC溶液浓度超过0.18 mg/mL后,其清除效率增强缓慢。当质量浓度为0.54 mg/mL时,阳荷多糖对O2-·清除率为85.6%,低于同浓度VC溶液对O2-·清除率99.8%。但能够说明阳荷多糖在浓度较高时对O2-·清除效果良好,且具有良好的量效关系。
2.3.4 阳荷多糖对·OH清除能力
图11为不同质量浓度的阳荷多糖和VC溶液对·OH清除能力。
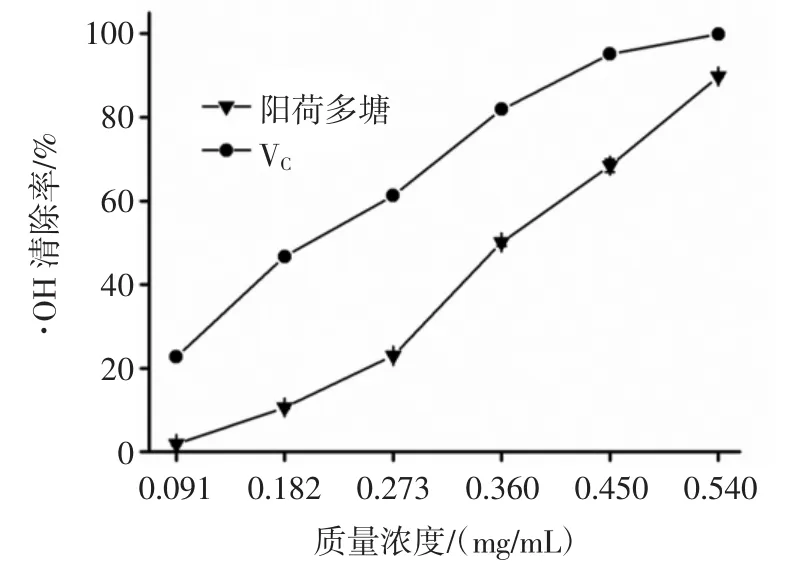
图11 ·OH清除能力Fig.11 The elimination ability on·OH
对·OH清除活性随阳荷多糖质量浓度的增加而逐渐增强,较低浓度的阳荷多糖清除能力较弱;当浓度增大到0.54 mg/mL时,阳荷多糖对·OH清除率为89.6%,而VC溶液对·OH清除能力接近100%。体外抗氧化试验证明阳荷多糖具有一定的清除·OH能力。
3 结论
以陕南野生阳荷为原材料,多糖得率为评价指标,选取微波-超声协同辅助提取法提取阳荷多糖。在单因素试验的基础上,结合响应面分析法优化多糖提取工艺,得到结论如下:
阳荷多糖的最佳提取工艺为:超声功率454 W,提取时间 15 min,提取温度 67℃,料液比 1∶26(g/mL),在此工艺条件下,多糖的得率为(10.40±0.35)%。
体外抗氧化试验表明,阳荷多糖具有较强的清除DPPH·、ABTS+·、O2-·和·OH 能力,其自由基清除活性随阳荷多糖浓度的增加而增强。在浓度达到0.39 mg/mL时,阳荷多糖提取液对DPPH·清除率为90.2%;当阳荷多糖质量浓度为0.034 mg/mL时,阳荷多糖提取液对ABTS+自由基清除率为97.6%;当质量浓度增大到0.54 mg/mL时,阳荷多糖对O2-·和·OH清除率分别为85.6%和89.6%,证明阳荷多糖与VC近似具有一定的抗氧化活性,可为其天然抗氧化剂和功能性天然食品的开发与应用等提供试验依据。
