超高效液相色谱-串联质谱法同时检测鸡蛋中5种磺胺类药物和甲氧苄啶残留量
2020-09-10李文辉孙志文
李文辉,孙志文
(北京市兽药监察所, 北京 102600)
磺胺类药物为人工合成的抗菌药,它具有抗菌谱较广、性质稳定、使用简便、生产时不耗用粮食等优点。特别是1969年抗菌增效剂-甲氧苄啶(TMP)发现以后,与磺胺类药物联合应用可使其抗菌作用增强、治疗范围扩大,对革兰阳性及阴性菌均有抑制作用。抗菌机制是通过与对氨基苯甲酸竞争细菌的二氢叶酸合成酶, 导致细菌体内叶酸合成受阻而使细菌的生长、繁殖受挫。磺胺类药物种类多,本文主要研究兽医领域经常使用的磺胺二甲嘧啶、磺胺喹噁啉、磺胺间甲氧嘧啶、磺胺二甲嘧啶、磺胺甲恶唑。甲氧苄啶是抗菌增效剂的一种, 属于二氨基嘧啶类药物, 它干扰细菌的叶酸代谢, 阻止细菌菌体蛋白合成中的二氢叶酸还原成四氢叶酸, 进而影响菌体合成去氧核酸、核搪核酸、菌体蛋白等, 使细菌生长和繁殖不能正常进行[1]。与此同时, 磺胺类药物利用其结构与对氨基苯甲酸相似, 可以竞争二氢叶酸合成酶, 抑制二氢叶酸的合成。所以经常将磺胺类与甲氧苄啶合用, 达到抗菌增效的效果。2000年, 大肠杆菌对甲氧苄啶的耐药率在一些研究中达到70%以上, 表明食品动物细菌耐药性的增长与兽医临床抗菌药的持续和大剂量的使用有关[2]; 甲氧苄啶可以引起骨髓微核抑制和其他的不良反应[3], 2类药物若在动物源性食品中残留, 人类在食用后就可能在人体内形成蓄积, 对身体造成很大的危害。为了控制磺胺类药物和甲氧苄啶的使用,中国、欧盟等国家和组织对它们的最高残留限量做出了规定, 我国农业农村部2019年颁布的GB31650-2019《食品安全国家标准食品中兽药最大残留限量》[4], 对磺胺类药物的规定是所有食品动物中脂肪的最大残留限量100 μg/kg; 对甲氧苄啶的规定是禽的肌肉、皮脂、肝脏、肾脏中的最大残留限量50 μg/kg, 并且规定日允许量为0~4.2 μg/kg·BW/d。目前磺胺类药物的检测方法主要有酶联免疫法[5]、液相色谱法[6-9]、液相色谱-串联质谱法[10-14],甲氧苄啶的检测方法主要是液相色谱法[15],单独检测磺胺类药物或者甲氧苄啶的方法比较多, 同时进行动物源性2类药物的液相色谱-串联质谱方法较少,并且灵敏度不够高[16],尤其是鸡蛋组织中2类药物同时检测的方法鲜有报道,而且这些方法具有前处理步骤多、效率低、检测组织等局限。
现今食品安全问题已经成为与人们生活密切相关的问题, 动物性食品中抗生素等有毒有害物质一旦超过限量, 将严重威胁人类的身体健康。本研究建立超高效液相色谱-串联质谱法(ultrahigh performance liquid chromatography-tandem mass spectrometry, UPLC-MS/MS)同时测定鸡蛋中5种磺胺类药物和甲氧苄啶的检测方法, 以期方便日常检测工作。
1 材料与方法
1.1 仪器 Waters Xevo TQ-XS超高效液相色谱-串联质谱仪(美国Waters公司); PB602-N电子天平(瑞士Mettler公司);氮吹仪(美国Organomation Associates公司); CF16RN高速冷冻离心机(日本HITACHI 公司); MS 3 basic涡旋混合器水平振荡器(德国IKA 公司);Milli-Q academic超纯水仪(美国Millipore 公司);溶剂过滤器(美国PALL公司); 微量加样器(德国Eppendorf 公司)。
1.2 试剂和耗材 磺胺二甲嘧啶、磺胺喹噁啉、磺胺间甲氧嘧啶、磺胺二甲嘧啶、磺胺甲恶唑5种磺胺类药物标准品(纯度≥99.1%)、甲氧苄啶标准品(99.2%)(德国Dr.Ehrenstorfer公司); 甲醇、乙腈、甲酸(质谱纯,美国Thermo Fisher Scientific公司); 正己烷(分析纯, 北京化工试剂厂);所用水为超纯水;Sep-Pak Vac 12cc(2g) Alumina B Cartridges(美国沃特世公司)。
1.3 标准溶液配制 分别精密称取5种磺胺类药物、甲氧苄啶标准品约10 mg, 于10 mL容量瓶中, 用乙腈溶解并定容至刻度, 配制成1 mg/mL磺胺类药物、甲氧苄啶的标准储备液; 准确吸取0.1 mL标准储备液至另一10 mL容量瓶中, 用乙腈+0.1%甲酸水溶液(20 ∶80,V∶V)溶解并稀释至刻度, 配制成10 μg/mL标准工作液。
1.4 样品采集与制备 试验所采用的样品, 来自标准养殖示范基地,经检测无药物残留,将鸡蛋均质匀浆,置于50 mL离心管中备用。
1.5 样品的前处理 称取鸡蛋试样(5±0.02) g, 置于50 mL塑料离心管, 加乙腈20 mL, 50 ℃水浴5 min, 涡旋混匀, 涡旋振荡10 min, 8000 r/min离心10 min, 取上层液体于另一离心管中; 10 mL乙腈重复提取一次, 合并上清液, 于50 ℃水浴氮气吹干。
在残留物加入95%乙腈5 mL溶解,直接过Sep-Pak Vac 12cc(2g) Alumina B Cartridges碱性氧化铝柱,吹干,再用5 mL 30%乙腈洗脱,收集洗脱液,用0.22 μm滤膜过滤, 滤液供超高效液相色谱-串联质谱仪测定。
1.6 仪器条件
1.6.1 色谱条件 色谱柱为美国沃特世Waters ACQUITY UPLC(BEH C18 1.7 μm,2.1 x 50 mm); 流动相A相为乙腈溶液, B相为0.1%甲酸水溶液; 流速: 0.25 mL/min; 进样量: 5 μL; 柱温30 ℃。色谱梯度洗脱条件见表1。
1.6.2 质谱条件 离子源: 电喷雾离子源; 扫描方式: 正离子扫描; 检测方式: 多反应监测(multiple response monitoring, MRM); 电离电压: 2.0 kV; 源温: 150 ℃; 雾化温度: 450 ℃; 锥孔气流速: 150 L/h; 雾化气流速: 650 L/h(表2)。
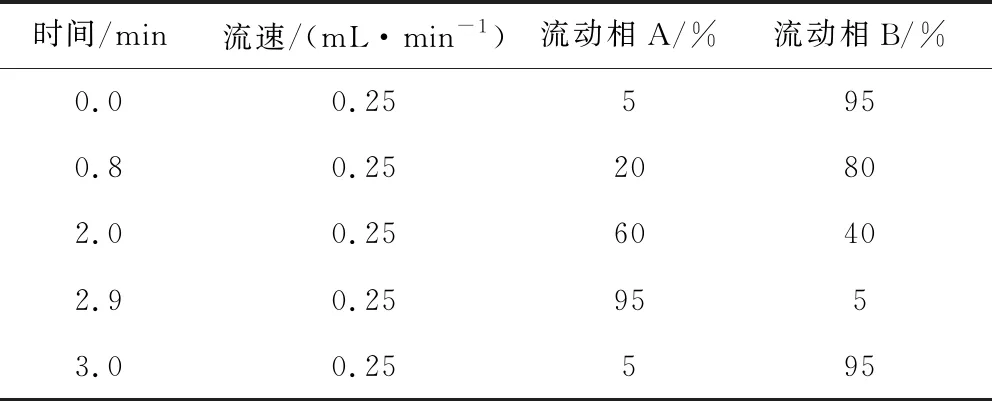
表1 液相色谱梯度洗脱条件Tab 1 Gradient elution conditions of liquid chromatography
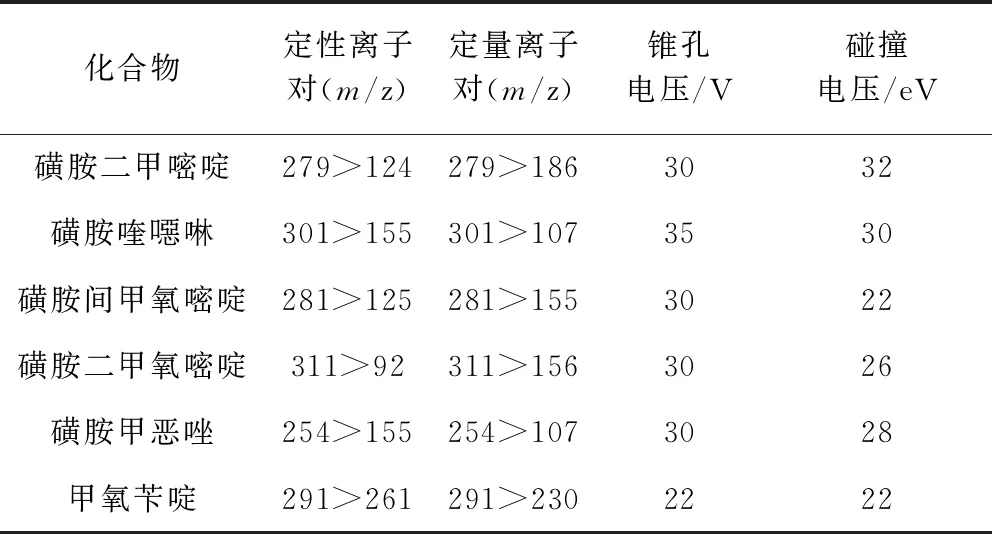
表2 5种磺胺类药物和甲氧苄啶定性、 定量离子对、锥孔电压和碰撞能量Tab 2 Qualitative and quantitative ion pair, cone hole voltage and collision energy of five kinds of sulfonamide and trimethoprim
1.7 基质标准曲线的制备 在空白鸡蛋基质中添加适量的标准工作液配制成6个不同浓度(0.5、2.5、5.0、20、50、100 μg/kg)系列基质标准溶液, 以其浓度为横坐标, 对应的峰面积为纵坐标,制备基质标准曲线。
1.8 方法的回收率、精密度和灵敏度 采用标准添加法, 分别准确称取空白样品2 g, 添加一定体积的标准工作溶液, 使鸡蛋中5种磺胺类药物、甲氧苄啶浓度分别为1.0、25、50、100 μg/kg, 按上述样品前处理方法处理后进行测定, 一日内每种药物的每个添加浓度取5个平行样品分别进行测定, 每个添加浓度设5个平行, 重复测定3 d, 外标基质标准曲线法定量,计算回收率和批内、批间相对标准偏差(RSD)。
采用空白鸡蛋中添加目标化合物的方法, 依据特征离子质量色谱峰信噪比S/N≥3的浓度为方法定量限,S/N≥10的浓度为方法定量限, 添加适量标准溶液于5 g空白试样中,制备得到一定浓度的添加样品, 经前处理后检测, 在相应的保留时间, 空白试样对所测药物无干扰, 测定灵敏度。
2 结果与分析
2.1 基质标准曲线线性结果 以6个不同浓度系列基质标准溶液浓度为横坐标, 对应的峰面积为纵坐标,绘制基质标准曲线, 线性回归方程及相关系数见表3。由表3可见,在0.5~100 μg/kg的浓度范围内5种磺胺类药物、甲氧苄啶色谱峰面积与浓度呈良好线性相关, 相关系数均大于0.99。
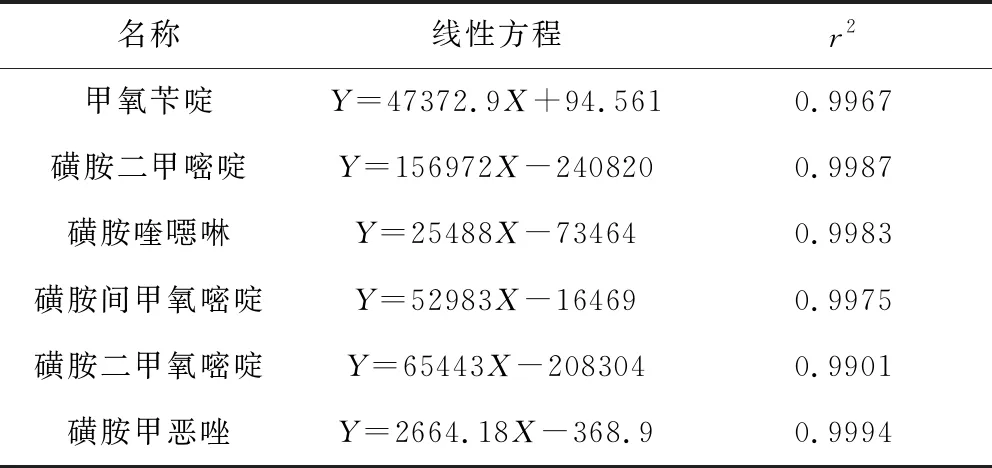
表3 基质标准曲线线性回归方程及相关系数Tab 3 Linear regression equations and Correlation Coefficients
2.2 回收率、精密度和灵敏度 根据回收率的测定方法进行测定, 结果表明, 鸡蛋样品中5种磺胺类药物、甲氧苄啶在1.0~100 μg/kg添加水平内的平均回收率为66.3%~97.5%, 批内相对标准偏差为3.1%~9.7%, 批间相对标准偏差在1.4%~11.4%。结果表明5种磺胺类药物、甲氧苄啶的添加回收率及相对标准偏差均满足残留检测的相关要求, 且方法的重现性很好。鸡蛋中5种磺胺类药物和甲氧苄啶添加回收率实验结果见表4。取信噪比S/N≥3时的浓度为检测限,信噪比S/N≥10的浓度为定量限,测得该方法检测限为0.5 μg/kg,定量限为1.0 μg/kg。其中50 μg/kg 5种磺胺类药物和甲氧苄啶基质匹配标准溶液MRM色谱图如图1, 5种磺胺类药物和甲氧苄啶鸡蛋空白MRM色谱图如图2, 鸡蛋添加50 μg/kg 5种磺胺类药物和甲氧苄啶MRM色谱图如图3。

表4 5种磺胺类药物和甲氧苄啶的添加回收率试验结果Tab 4 Results of tests on the recoveries of five kinds of sulfonamide and Trimethoprim

图1 50 ng/mL 5种磺胺类药物和甲氧苄啶基质匹配标准溶液MRM色谱图 (1.磺胺甲恶唑;2.磺胺二甲嘧啶;3.磺胺间甲氧嘧啶;4.甲氧苄啶;5.磺胺喹噁啉;6.磺胺二甲氧嘧啶)Fig 1 MRM chromatogram of 50 ng/mL five kinds of sulfonamide and trimethoprim matrix matching standard solution ( 1.sulfamethoxazole;2.salfamethazine;3.sulfamonimethoxine;4.trimethoprim;5.sulfaquinoxaline;6.sulfadoxine)

图2 5种磺胺类药物和甲氧苄啶鸡蛋空白MRM色谱图 (1.磺胺甲恶唑2.磺胺二甲嘧啶3.磺胺间甲氧嘧啶4.甲氧苄啶5.磺胺喹噁啉6.磺胺二甲氧嘧啶)Fig 2 Blank MRM chromatogram of five kinds of sulfonamide and trimethoprim in eggs ( 1.sulfamethoxazole;2.salfamethazine;3.sulfamonimethoxine;4.trimethoprim;5.sulfaquinoxaline;6.sulfadoxine)
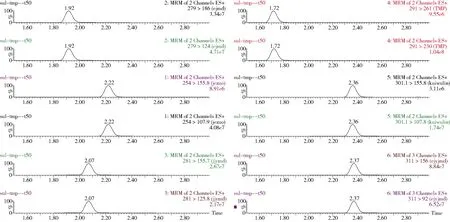
图3 鸡蛋添加50 μg/kg 5种磺胺类药物和甲氧苄啶MRM色谱图 (1.磺胺甲恶唑2.磺胺二甲嘧啶3.磺胺间甲氧嘧啶4.甲氧苄啶5.磺胺喹噁啉6.磺胺二甲氧嘧啶)Fig 3 MRM chromatogram of eggs added with 50 μg/kg five kinds of sulfonamide and trimethoprim ( 1.sulfamethoxazole;2.salfamethazine;3.sulfamonimethoxine;4.trimethoprim;5.sulfaquinoxaline;6.sulfadoxine)
3 讨论与结论
3.1 色谱条件的确定 色谱柱的选择:选择常用的Agilent ZORBAXSB-C18色谱柱(2.1 mm×50 mm,1.8 μm) 和Waters Acquity BEH C18色谱柱(2.1 mm×50 mm,1.7 μm) 进行分离实验对比分析结果显示,使用BEH C18进行分离时,各化合物的峰形较好,信噪比更高,主要是因为BEH C18是端基封尾的色谱柱,其固定相上无残留的硅羟基,可以改善峰的形状,且耐受的pH更宽,因此,最终选择BEH C18色谱柱(2.1 mm×50 mm,1.7 μm) 作为分离柱。
流动相的选择:本方法对比了甲醇和乙腈作为有机相时的分离效果,发现乙腈可提高待测组分的离子化效率,而在水相中加入0.1%甲酸时,化合物的离子化效果更好,峰形有所改善,灵敏度也相应提高。
确定以乙腈和0.1%甲酸水溶液作为流动相,目标化合物可获得较好的分离度,且保留时间适中,灵敏度高。
3.2 质谱条件的确定 使用液质联用方法进行检测时,质谱条件可直接影响方法的灵敏度,优化条件主要包括一级质谱扫描(Q1扫描)、二级质谱扫描(子离子扫描)和多反应监测(MRM)扫描,其中一级质谱条件主要需优化的参数为锥孔电压,其他参数如毛细管电压、萃取锥孔电压等的变化对待测化合物离子响应变化影响不大;二级质谱条件主要优化碰撞能量。本实验采用注射杆直接进样的方式,分别进1 μg/mL的5种磺胺和甲氧苄啶标准溶液来优化质谱参数。结合分子式结构并比较电喷雾正负离子模式下的信号强度,最终本实验选择电喷雾正离子模式。在Q1扫描中找出每个化合物的母离子,在子离子扫描中找到3~4个响应较大的子离子,最后在MRM扫描下优化参数,选择响应较高,稳定性好的1个子离子作为定量离子,优化的质谱参数见表2。
3.3 前处理方法的优化 对动物性产品常用的前处理提取试剂为乙腈[16]、甲酸乙腈[14]乙酸乙酯[10]、丙酮[10]提取试剂,本方法尝试以上试剂发现,使用乙腈作为提取试剂获得的回收率和峰型最好,进行两次提取比进行一次提取后溶液更干净,更容易进一步实验,采用正己烷除脂肪是效果比较好的试剂,但进行两次除脂肪比较麻烦[17],本研究选用碱性氧化铝柱能除脂和杂质,过柱速度非常快,一般只需要1~2 min就可以完成,跟不过柱直接上机相比,更容易过膜且峰型明显偏好,同时进行了HLB、MCX、MAX萃取柱过柱回收率的比较,发现回收率明显偏低,而且过柱时间长。
本研究采用乙腈提取碱性氧化铝柱净化的前处理技术, 建立了超高效液相色谱-串联质谱法同时检测鸡蛋中5种磺胺类药物、甲氧苄啶残留量的方法。该方法在0.5~100 ng/mL的质量浓度范围内, 线性关系良好, 相关系数均大于0.99。在1.0~200 μg/kg添加水平, 平均回收率在66.3%~97.5%之间, 回收率高, 方法检出限为0.5 μg/kg,定量限为1.0 μg/kg。该方法具有准确度高、精密度好、前处理简单快捷、成本低廉等特点, 适用于鸡蛋中5种磺胺类药物、甲氧苄啶残留量的检测。
