即食海蜇菌群分析与腐败菌种分离和鉴定
2020-09-10林以琳曾绍校林少玲
林以琳, 林 瑜, 缪 松, 曾绍校, 林少玲*
(1. 福建农林大学 食品科学学院,福建 福州350002;2. 爱尔兰农业部农业与食品发展局TEAGASC 食品研究中心,都柏林 科克R93XE12)
即食海蜇是一种水分含量高、低脂肪且营养丰富,具有抗氧化、免疫调节功能的食品[1]。 海蜇含有人体需要的多种营养成分,尤其含有人们饮食中所缺的碘,是一种重要的营养食品。 海蜇最主要的成分是胶原蛋白, 现代医学研究发现其具有抗氧化、抗疲劳和免疫调节功能,对治疗风湿性关节炎具有一定的效果[2-3]。 海蜇多肽可应用于抗氧化、降血脂、降血压等药物的开发[4-5]。 此外,据文献记载,海蜇对慢性气管炎、风湿、高血压等多种病症具有良好的疗效,已成为一种具有较高食用、营养及药用价值的名贵海洋食品。
新鲜海蜇含水量高,易分解和自溶,因此在加工过程中需要添加大量的食盐和明矾使其迅速脱水,收敛和凝固蛋白质[6]。 加入明矾可显著提高海蜇的贮藏品质,但同时也带来海蜇铝残留量过高的问题。 而人体中铝含量过高,则会对神经、骨骼及免疫具有潜在的毒性[7]。 即食海蜇制品通常是三矾盐渍海蜇经过清洗、切割、灭菌、包装等一系列加工处理后得到的即食食品。 即食海蜇生产加工中脱铝技术的应用,不仅降低了铝离子对人体的危害[8]还有效避免了微生物的生长。 根据我国农业部发布的NYT 1515-2007《绿色食品海蜇及制品》[9],除了不得检出沙门氏菌、志贺氏菌、副溶血性弧菌、金黄色葡萄球菌等致病菌外,大肠菌群和菌落总数也不得超标。 随着即食海蜇产品明矾含量及铝残留量的降低,湛江市场对软包装即食海蜇丝制品细菌学品质进行了分析,并对产品中残存细菌的安全性进行了评价[10]。 结果表明:即食海蜇产品大肠菌群数均为30 MPN/hg,革兰氏阴性杆菌(88.9%)、少量的革兰氏阳性无芽孢球菌(8.3%)、极少量的革兰氏阳性有芽孢杆菌(2.8%)。 对即食海蜇的微生物指标问题进行长期监控及有效控制, 是当前要解决的问题之一。 明确即食海蜇腐败变质的微生物种类,并针对性寻找有效的抑菌方法,有效提高即食海蜇的食用安全性及经济价值。
作者通过对即食海蜇产品进行菌群分析,并对腐败优势菌种进行分离、 纯化和16S rDNA 的PCR扩增与序列测定后经过BLAST 分析,明确腐败优势菌种类。
1 材料与方法
1.1 材料与设备
即食海蜇:由福州永辉超市购得不同厂家生产的5 类即食海蜇产品;平板计数琼脂(PCA)培养基、营养肉汤培养基、 细菌基因组DNA 提取试剂盒:Solarbio 公 司 产 品;DreamTaq-TM DNA 聚 合 酶(EP0702):MBI 公司产品;SanPrep 柱式质粒DNA小量抽提试剂盒:上海生工生物工程股份有限公司产品;pMD®18-T Vector 连接试剂盒:Takara 公司产品。
PL202-S100 型精密分析天平:Mettler Toledo(上海) 仪器有限公司产品;HPX-9000 型数显电热培养箱: 上海博迅实业有限公司医疗设备厂制造;2720 thermal cycler 型PCR 仪:Applied Biosystems公司产品;T6 新世纪紫外可见分光光度计: 北京普析通用仪器有限责任公司产品;MR6 数显恒温水浴锅:金坛市双捷实验仪器厂制造;101-0 型电热鼓风干燥箱:上海阳光实验仪器有限公司产品。
1.2 实验方法
1.2.1 即食海蜇样品中微生物污染状况各取10 g即食海蜇样品,放入含有90 mL 无菌稀释液的无菌均质袋内,于8000 r/min 均质2 min,制成1∶10(体积比)样品匀液。 取1 mL 样品匀浆,以1∶10(体积比)进行梯度稀释,全过程控制在15 min 内。以稀释后的即食海蜇样品为原料, 进行各种微生物的测定,测定方法如表1。
1.2.2 腐败优势菌种分离纯化各取1 mL 制得的稀释样品加入无菌锥形瓶中置于30 ℃摇床培养。取1 mL 培养后的菌液,以1∶10(体积比)进行梯度稀释,得到10-2、10-3、10-4稀释样品。 移取稀释样品各100 μL,涂布于PCA 培养基中,倒置于30 ℃恒温生化培养箱中培养72 h。 取出平板,挑取菌落,转接到新的固体培养基,采用三线划线法接种培养至分离到纯种菌落,重复纯化步骤5次。 挑取纯种菌落, 溶于营养肉汤培养基中进行富集培养,30 ℃培养24 h, 取1 mL 培养后菌液与体积分数50%灭菌后甘油1∶1(体积比)混合均匀,于-80 ℃超低温冰箱保藏。

表1 几种即食海蜇中常见微生物的测定方法Table 1 Methods for the determination of common microorganisms in ready-to-eat jellyfish
1.2.3 腐败优势菌种16S rDNA 序列鉴定根据细菌基因组DNA 提取试剂盒抽提腐败优势菌的DNA,并于-20 ℃冰箱冻存。
1.2.416S rDNA 的PCR 扩增与序列测定取抽提得到的腐败优势菌DNA 进行16S rDNA 的PCR 扩增, 其中正向引物为7F:5'-CAGAGTTTGATCCTG G-CT-3', 反向引物为1540R:5'-AGGAGGTGATC CAGCCGCA-3'。PCR 循环设置:98 ℃预变性3 min;30个循环:98 ℃变性25 s,55 ℃复性25 s,72 ℃延伸1 min; 最后72 ℃温浴10 min,4 ℃30 min 终止反应。 通过琼脂糖凝胶电泳提取DNA 片段,送至上海生工技术公司进行测序。
1.2.5 序列分析与系统发育树的构建利用BLAST 对所得腐败优势菌的16S rDNA 序列进行相似性对比分析, 并使用Bootstrap 及Neighbour Joining 计算进化距离,构建系统发育树并分析。
2 结果与分析
2.1 即食海蜇样品中微生物污染状况

表2 即食海蜇细菌学品质指标Table 2 Bacterial standards of ready-to-eat jellyfish
如表2 所示, 即食海蜇样品中菌落总数为48000 CFU/g, 远高于国家标准所规定的不得高于30000 CFU/g,说明该产品被微生物污染。 同时,样品中并未检出大肠杆菌、蜡样芽孢杆菌、沙门氏菌和金黄色葡萄球菌,说明该产品在加工处理中受致病菌污染的可能性小,但总体上不符合即食海蜇产品的微生物限量标准规定。
2.2 16S rDNA 序列分析鉴定
2.2.116S rDNA 的PCR 扩增与序列测定提取经分离纯化后的2 菌株基因组DNA, 以其16S rDNA为模板进行PCR 扩增(图1)。 结果表明2 条目标条带约为1.35 kb。将菌株的阳性质粒送至上海生工生物公司测序,测得16S rDNA 大部分序列分别为1348 bp 和1336 bp(图2)。

图1 PCR 扩增16S rDNA 基因Fig. 1 PCR amplification of 16S rDNA gene
2.2.2 BLAST 同源性搜索与系统发育树的绘制菌株1 和菌株2 的16S rDNA 的序列分别经过BLAST 分析后,Burkholderia属的细菌与菌株1 与菌 株2 的16S rDNA 相 似 度 高 (表3), 其 中Burkholderia lata和Burkholderia cenocepacia分 别与菌1、菌2 序列相似度达到99%和100%,因此菌株1 种属初步鉴定为Burkholderia lata、 菌株2 为Burkholderia cenocepacia。

图2 菌株的16S rDNA 碱基序列Fig. 2 Sequence of 16S rDNA of the strain
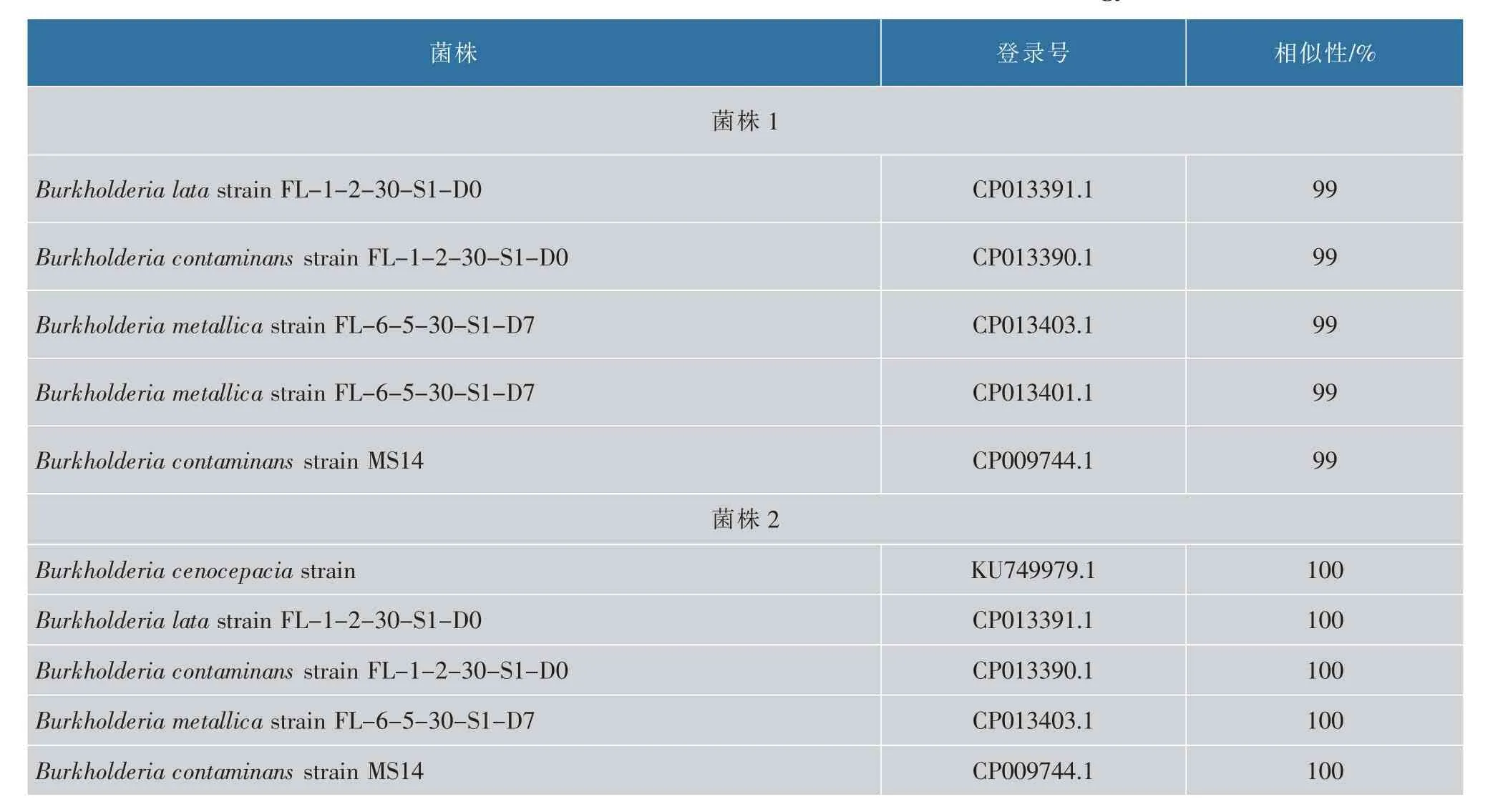
表3 菌株16S rDNA 序列同GeneBank 中细菌菌株同源性比较Table 3 Comparison of 16S rDNA sequence with the bacterial strain homology in GeneBank
将腐败优势菌的16S rRNA 基因序列与从Genebank 中选择的10 株菌进行系统进化分析,得到如图3 所示的系统发育树。 如图所示,菌株1 与Burkholderia latastrain FL-1-2-30-S1-D0、 菌株2与Burkholderia cenocepaciastrain 的分支的序列一致性达到95%,表明它们亲缘关系最近,进一步验证了鉴定结果。
3 结 语
即食海蜇食用方便,但保藏时间短。 在贮藏过程中容易受到环境中温度、pH 以及产品包装等方面的影响[16,19],这些栅栏因子有助于即食海蜇中微生物的生长[20]。 已有报道,通过PCR 技术快速检测出海蜇中的腐败菌有芽孢杆菌、假单胞菌以及腐败希瓦氏菌[17-18]。 本文作者通过即食海蜇样品的菌群分析,并未检出大肠杆菌、蜡样芽孢杆菌、沙门氏菌和金黄色葡萄球菌;但通过菌落总数分析法得知即食海蜇出厂3个月,其菌落总数(48000 CFU/g)已超出海蜇相关标准所规定(30000 CFU/g),但样品中说明该产品仍然被微生物污染, 菌落总数超标。菌落总数的快速增长严重影响即食海蜇的食用安全。 因此,明确腐败优势菌种是十分紧急且必要的。通过对腐败优势菌种进行16S rDNA 的PCR 扩增与序列测定后经过BLAST 分析,发现腐败优势菌群为革兰氏阴性菌并主要为Burkholderia菌属。Burkholderia菌属隶属于假单胞菌属,是富有运动性及好氧性,呈现棒状的革兰氏阴性菌。Burkholderia在可作为生物降解、生物控制及促进植物生长的主要微生物, 对人类免疫可造成潜在危害。 并且Burkholderia具有对抗生素的抗药性及高运动性,对于人类有较大的威胁。 所以,选择合适灭菌技术,有效抑制Burkholderia的生长, 从而对即食海蜇进行减菌处理具有十分重要的科学意义。

图3 菌株1 与菌株2 和相关菌株16S rDNA 基因序列系统进化树图Fig. 3 Phylogenetic tree of 16S rDNA gene sequence of strains 1,2 and related strains
