盐环境下氮素对苗期盐角草氮同化关键酶活性的影响
2020-09-10段婧婧马晓东付彦博
黄 建,段婧婧,马晓东,祁 通,付彦博
(新疆农业科学院土壤肥料与农业节水研究所,乌鲁木齐 830091)
0 引 言
【研究意义】氮是植物生长发育所必需的大量营养元素,在整个生长发育过程中具有重要的作用[1]。盐渍化是世界性的资源和生态问题[2],通常盐渍化土壤的pH值较高,盐渍化土壤中氮素的含量较低。很多盐生植物却能够在盐环境下生长发育并形成生物量。盐角草(Saliconia-Europea L.)又名海蓬子,为藜科盐角草属一年生双子叶草本植物[3],其耐盐极限浓度可达到5% NaCl,内茎的可溶性盐分含量达37%[4]。盐角草的强耐盐性,能够在很多盐渍化地区种植,其植株蛋白质含量很高[5],甚至可以达到豆科牧草的水平,部分盐生植物可作为盐碱地区改良利用的饲料作物[6]。【前人研究进展】盐角草能够在盐渍化土壤环境下正常生长,在人工模拟的人体尿液也能正常生长[7],研究表明,高浓度的尿素能够促进盐角草的生物量的增加[8]。 硝酸还原酶作为诱导酶,是植物体内氮素同化的第一个关键酶,也是整个同化过程的限速酶,在植物氮素同化过程中起关键作用[9]。盐角草不仅具有高耐盐能力,同时还具有高耐氮能力。【研究切入点】关于盐渍化生境中盐角草氮素吸收利用特性的系统研究还未见报道。采用盆栽方法分析盐环境下氮素对苗期盐角草氮同化关键酶活性的影响,研究盐角草氮素吸收与同化机制。【拟解决的关键问题】研究干旱区盐环境下不同氮水平下盐角草氮素同化吸收机制作,为盐碱地区盐角草的种植栽培及盐渍土的生物改良提供理论依据。
1 材料与方法
1.1 材 料
试验于2019年4~8月在新疆喀什岳普湖县农业技术推广中心试验站,N39°14'50",E76°44'45",属暖温带大陆性干旱气候。年平均气温11.8℃,极端低温-23.4℃,极端高温41.5℃,日照全年平均值2 780.3 h,平均无霜期232 d,年降水量66.4 mm。盐角草种子采自中国科学院新疆生态与地理研究所克拉玛依盐生植物园,盐角草(Salicornia-EuropaeaL.)为藜科(Chenopodiaceae)盐角草属(SalicorniaL.)的聚盐盐生植物(Ushakova et al, 2006)。供试盐碱土取自岳普湖县农田重度盐碱土,土壤质地为灌淤土,土壤pH值为8.58,总盐为10.9 g/kg,全氮为0.31 g/kg,全磷为0.62 g/kg,全钾为21.40 mg/kg,速效氮为34.00 mg/kg,速效磷为8.87 mg/kg,速效钾为107.33 mg/kg。
1.2 方 法
1.2.1 试验设计
采用盆栽土培的方法进行栽培种植,将供试土壤过5 mm筛,混合均匀并装盆,每盆装土2 kg,供试盆为塑料盆,高18 cm,内径16 cm。选择大小一致的盐角草种子播种于塑料盆中,每盆播50粒种子,在表面覆沙1 cm,在人工温室中培养至苗高4 cm时定植8株,移至室外继续培育待苗长至高10 cm左右时开始处理。氮素以尿素(含氮为46%)形式溶解于水中一次性加入,氮素(以每千克土壤所含纯N计) 设5个水平,即N0(不施氮)、N1(施氮0.3 g/kg)、N2(施氮0.6 g/kg)、N3(施氮1.2 g/kg)、N4(施氮2.4 g/kg),每个处理4个重复,共计20盆,定时定量补充植物每天所需水分。于2019年5月20日在正式处理30 d后进行采样及各项指标的测定。
1.2.2 测定指标
1.2.2.1 粗酶提取
取盐角草根、茎、同化枝鲜样各0.1 g,洗净剪碎,放在研钵中置低温冰箱冷冻30 min。取出在冰浴中加0.9 mL PBS缓冲液。研磨为匀浆,低温离心10 min(10 000 r/min),上清液即为粗酶提取液。
1.2.2.2 酶活性
采用酶联免疫分析法(ELISA)测定,设置6个重复。
(1)标准品的稀释与加样在酶标板上设标准品孔10孔,在第1、第2孔中分别加标准品100 μL,然后在第1、第2孔中加标准品稀释液50 μL,混匀;然后从第1孔、第2孔中各取100 μL分别加到第3孔和第4孔,再在第3、第4孔分别加标准品稀释液50 μL,混匀;然后在第3孔和第4孔中先各取50 μL弃掉,再各取50 μL分别加到第5、第6孔中,再在第5、第6孔中分别加标准品稀释液50 μL,混匀;混匀后从第5、第6孔中各取50 μL分别加到第7、第8孔中,再在第7、第8孔中分别加标准品稀释液50 μL,混匀后从第7、第8孔中分别取50 μL加到第9、第10孔中,再在第9第10孔分别加标准品稀释液50 μL,混匀后从第9和第10孔中各取50 μL弃掉。
(2)加样分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL(样品最终稀释度为5倍)。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
(3)温育用封板膜封板后置37℃温育30 min。
(4)配液:将30(48T的20倍)倍浓缩洗涤液用蒸馏水30(48T的20倍)倍稀释后备用。
(5)洗涤小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干。
(6)加酶每孔加入酶标试剂50 μL,空白孔除外。
(7)温育操作同(3)。
(8)洗涤操作同(5)。
(8)显色每孔先加入显色剂A50 μL,再加入显色剂B50 μL,轻轻震荡混匀,37℃避光显色15分钟.
(10)终止每孔加终止液50 μL,终止反应(此时蓝色立转黄色)。
(11)测定:以空白空调零,酶标仪450 nm波长依序测量各孔的吸光度(OD值),通过标准曲线计算样品抗原浓度。
1.3 数据处理
获得每处理3个重复的数据均采用SPSS 16.0统计软件进行方差分析和显著性检验(Duncan法,P﹤0.05),图形均采用Origin 8.5绘制。
2 结果与分析
2.1 不同施N水平对盐环境下盐角草幼苗NR活性的影响
研究表明,在相同氮素处理下,盐角草在不施氮及N1处理下,根、茎、同化枝活体NR活性呈显著增加的趋势,在N2、N3、N4处理下盐角草根活体的NR活性逐渐大于茎、同化枝;在不同氮素处理下,随着氮素处理浓度的增大,盐角草根活体NR活性呈显著增加的趋势,随着氮素浓度的升高,NR活性略微下降;盐角草茎活体NR活性不施氮与N1处理差异不显著,与N2、N3、N4处理差异显著,而N2、N3、N4处理之间差异不显著;盐角草同化枝活体NR活性不施氮、N1、N2、N4之间差异不显著,与N3差异显著。盐角草根、茎、同化枝活体NR活性在N3处理浓度下达到最大值。
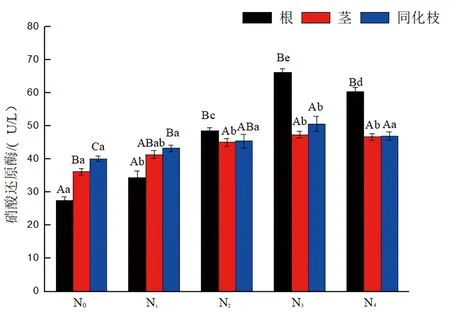
注:误差线上不同大写字母表示同一处理间不同部位在P≤0.05时有显著差异,不同小写字母表示同一部位下不同氮素处理在P≤0.05时有显著差异Note:Different capital letters on the error line indicate significant differences between different parts of the same treatment at P≤0.05, while different lowercase letters indicate significant differences between different nitrogen treatments at P≤005.图1 不同氮处理下盐角草硝酸还原酶活性变化特征(平均值±标准偏差)Fig.1 Variation characteristics of Salicornia europaea L. nitrate reductase activity at different nitrogen levels (mean ±SD)
2.2 不同施N水平对盐环境下盐角草幼苗GS活性的影响
研究表明,在相同氮素处理下,盐角草在不施氮处理下,盐角草同化枝活体GS活性显著低于根、茎,在N1、N2、N3处理下盐角草根、茎、同化枝活体GS活性差异不显著,在N4处理下,盐角草根活体GS活性显著高于茎、同化枝;在不同氮素处理下,盐角草根活体GS活性呈增加的趋势,不施氮与N1、N2差异不显著,与N3、N4差异显著;盐角草茎活体GS活性不施氮与N4差异不显著,与N1、N2、N3处理差异显著;盐角草同化枝活体GS活性不施氮显著低于各施氮处理,各施氮处理之间差异不显著。盐角草根、同化枝活体GS活性在N4处理时最大,茎在N3时最大。图2

图2 不同氮处理下盐角草谷氨酰胺合成酶活性变化特征(平均值±标准偏差)Fig.2 Variation characteristics of Salicornia europaea L. glutamine synthetase activity at different nitrogen levels (mean ±SD)
2.3 不同施N水平对盐环境下盐角草幼苗GOGAT活性的影响
研究表明,在不施氮、N1、N2处理下,盐角草根、茎、同化枝活体GOGAT活性差异不显著,在N3处理时,盐角草根、茎、同化枝活体GOGAT活性呈显著降低,在N4处理时,盐角草根活体GOGAT活性显著高于茎、同化枝;在不同施氮处理下,盐角草根活体GOGAT活性呈逐渐升高的趋势,不施氮、N1、N2差异不显著,与N3、N4之间差异显著;盐角草茎活体GOGAT活性不施氮、N1、N2、N4之间差异不显著,与N3处理差异显著;盐角草同化枝活体GOGAT活性不施氮、N1、N2、N3之间差异不显著,与N4处理差异显著。盐角草根、同化枝活体GOGAT活性在N4处理时最大,茎在N3时最大。图3
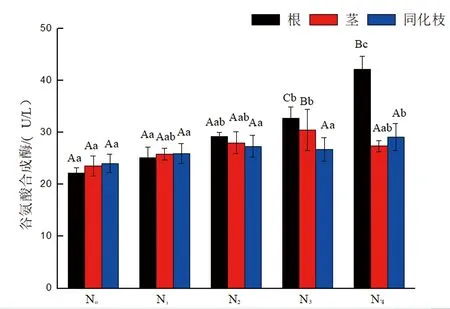
图3 不同氮处理下盐角草谷氨酸合成酶活性变化特征(平均值±标准偏差)Fig.3 Variation characteristics of Salicornia europaea L. glutamate synthase activity at different nitrogen levels (mean ±SD)
2.4 不同施N水平对盐环境下盐角草幼苗GLDH活性的影响
研究表明,在不施氮、N1、N4处理下,盐角草根、茎、同化枝活体GLDH活性差异不显著,在N3、N4处理时,盐角草根活体GLDH活性显著低于茎、同化枝;在不同施氮处理下,盐角草根活体GLDH活性呈逐渐升高的趋势,N1、N2、N3处理之间差异不显著,与不施氮、N4之间差异显著;盐角草茎活体GLDH活性不施氮与施氮处理差异显著,各施氮处理之间差异不显著;盐角草同化枝活体GLDH活性与茎有相同的趋势。盐角草根、茎、同化枝活体GLDH活性均在N4处理时最大。

图4 不同氮处理下盐角草谷氨酸脱氧酶活性变化特征(平均值±标准偏差)Fig.4 Variation characteristics of Salicornia europaea L. glutamate deoxygenase activity at different nitrogen levels (mean ±SD)
3 讨 论

4 结 论
4.1 与不施氮处理相比,在重度盐环境条件下,施氮可现在提高盐角草幼苗根、茎、同化枝NR、GS、GOGAT、GLDH的活性。
4.2 施N(1.2 g/kg)时,盐角草幼苗根、茎、同化枝活体NR活性、茎活体GS、GOGAT活性达到最大值。
4.3 施N(2.4 g/kg)时,盐角草幼苗根、同化枝活体GS、GOGAT活性及根、茎、同化枝活体GLDH活性达到最大值。
