倒置显微镜拍照法对浮游植物计数的稳定性分析
2020-09-09陈明华史康佳李志杰张建辉胡文涛
陈明华,史康佳,李志杰,蔡 菲,张 浩,张建辉,胡文涛
(1:南昌大学鄱阳湖环境与资源利用教育部重点实验室,南昌330031)(2:南昌大学生命科学学院生态学实验室,南昌330031)(3:南昌大学资源环境与化工学院,南昌330031)
浮游植物是水生生态系统中重要的初级生产者[1-2],准确地分析浮游植物种群和群落数量是河流、湖泊生态健康评价和生态功能分析的基础. 浮游植物定量分析方法现有镜检法、光密度法、流式摄像机计数法、流式细胞仪法、叶绿素a法等[3],其中镜检法又分为计数框行格法、目镜视野法、目镜行格法、倒置显微镜视野法,选择不同镜检方法对生物量计算有影响. 浮游植物生物量计算方法有标准法、细分法、粗分法和资料法[1],以上方法都是基于浮游植物细胞生物量体积法[4-5]. 影响浮游植物定量分析的因素有采样、浓缩和镜检等,其中浮游植物镜检尤其突出,显微镜镜检法作为浮游植物计数最经典方法,是检验其他方法是否有效的依据[2],是衡量浮游植物计数是否准确的标准,在河流湖泊生态学研究中具有不可替代的作用.
显微镜镜检法不仅可以测定浮游植物生物量,还可以进行浮游植物的种类及群落结构分析[6],显微镜镜检法不仅能较为全面地反映样品的种类分布情况,而且准确度高、变异系数小,目前仍为国际上浮游植物调查研究最通用的方法[1-2,6-8],通常采用的显微镜镜检法有计数框正置镜检法和Utermöhl管倒置镜检法[4-5,9-17]. 镜检法以外的方法在定量分析过程中很难解释浮游植物群落结构的变化及演替,例如流式细胞技术提供了一种简单、快速分析浮游生物的实验方法[4],但存在较大误差,无法准确评价浮游植物在湖泊河流生态系统中的作用. 镜检法通常依靠人的眼睛观察但存在问题:对浮游植物计数和体积测量因显微镜和研究人员不同而结果不同,尤其是镜检次数对计数影响如何?一个样品重复镜检多少次符合实际情况?不同门类浮游植物镜检次数是否要一样?不同倍数下镜检次数对计数影响如何?微囊藻与硅藻的计数次数是否应该一样?同一镜检条件下不同藻类如何镜检?这些实际问题直接影响浮游植物定量分析. 浮游植物生态学研究虽然已经积累了丰富的数据,但以上实际计数方法上的差异性导致研究结果较难与国际接轨. 现随着显微拍摄技术的发展,本研究提出倒置显微镜拍照法,减少人为因素导致的镜检误差,对拍照法的影响进行分析,进一步完善浮游植物计数的定量化研究,为藻类生态学研究提供科学方法.
1 材料与方法
1.1 样品采集
实验选用的浮游植物样品分为纯藻样品和野外样品,纯藻样品为实验室培养的四尾栅藻、斜生栅藻、小球藻3种纯藻,野外样品为鄱阳湖出湖口、主湖区和湖汊3种生境浮游植物样品. 野外浮游植物样品在水面与0.5 m深的水层之间使用柱状采水器采集,用网目孔径为4 μm的浮游植物网过滤5 L水样,并将浮游植物样品加1滴鲁格氏液保存在50 mL的样品瓶中,样品使用冷藏箱保存等待镜检. 野外样品须在水体透明度大于30 cm的水体采集,若透明度小于30 cm时,须将混后水样在10 L水桶中待泥沙沉降后再取混合水样,以避免泥沙对浮游植物镜检的影响.
1.2 样品镜检
计数框行格法采用长20 mm、宽20 mm、体积0.1 mL的计数框对浮游植物进行镜检,样品厚度约为250 μm,计数框横、竖各划分10行格,共100个小方格. 将计数样品充分摇匀,吸取0.1 mL到计数框中,对计数框上第2、5、8行共30个小方格(面积为120 mm2)进行计数[18],在5、10、20和40倍下分别需观察15、30、97和392个视野数.
倒置显微镜拍照法采用直径27.5 mm、面积593.6 mm2、体积5 mL的管状浮游浮游植物计数管对浮游植物进行镜检. 取0.5 mL样品置于计数管内,样品厚度约为842 μm,静置30 min,通过显微镜摄像头对浮游植物拍照. 倒置显微镜拍照法不需长时间沉淀和次级抽样步骤而直接计数,在5、10、20和40倍下对样品分别拍摄5、10、20和20张浮游植物照片,且40倍条件下至少拍摄每个样品中所含有种类数的照片量,即有多少种就需拍摄多少张照片,照片应均匀分布在计数管内.
1.3 计数公式
计数框行格法计数公式为:
(1)
式中,N为每升原水样中的浮游植物数量(个/L),Sk为计数框面积(mm2),Sj为计数面积(mm2),Vs为浓缩后水样的体积(mL),Va为取样镜检水样体积(计数框体积)(0.1 mL),n为计数所得浮游植物的数量,Vm为野外水样体积(mL).
倒置显微镜拍照法计数公式为:
N=∑Ni
(2)
(3)
式中,Ni为第i物种在1 L水样中的个体数量,Sg为计数管面积(mm2),Sj为计数照片面积(mm2),P为照片数.
2 结果与分析
2.1 计数框行格法计数
采用计数框行格法对纯藻样品和野外样品进行观察,样品在5倍下观察形状为两方格(图1),浮游植物个体太小,个数太多,无法计数;样品在10倍下观察形状为一个小方格(有少部分不在视野中),个体太小,个数太多,无法计数;样品在20倍下观察计数形状为圆形,小球藻个体偏小,个数太多,四尾栅藻、斜生栅藻个体清晰可见,计数准确,野外样品个体清晰可见,计数准确,但有些种类识别不出;样品在40倍下观察计数形状为圆形,纯藻样品和野外样品浮游植物清晰可见且计数准确.
小球藻在20倍下计数5个视野,平均每个视野浮游植物144个,在40倍下计数10个视野,平均每个视野浮游植物28个;四尾栅藻在20倍下计数5个视野,平均每个视野浮游植物74个,在40倍下计数10个视野,平均每个视野浮游植物13个;斜生栅藻在20倍下计数5个视野,平均每个视野浮游植物222个,在40倍下计数10个视野,平均每个视野浮游植物42个. 出湖口样品在20倍下计数5个视野,平均每个视野浮游植物6个,在40倍下计数10个视野,平均每个视野浮游植物2个;主湖区样品在20倍下计数5个视野,平均每个视野浮游植物18个,在40倍下计数10个视野,平均每个视野浮游植物10个;湖汊样品在20倍下计数5个视野,平均每个视野浮游植物18个,在40倍下计数10个视野,平均每个视野浮游植物3个(表1).
2.2 倒置显微镜拍照法计数
采用倒置显微镜拍照法对纯藻样品和野外样品进行观察,样品在5、10、20、40倍下观察计数形状都为长方形即照片形状(图2);样品在5倍下观察计数个体太小,个数太多,无法计数;样品在10倍下观察计数个体太小,个数太多,估算计数;样品在20倍下观察计数,小球藻个体偏小,个数较多,四尾栅藻、斜生栅藻、野外样品个体清晰可见且计数准确;样品在40倍下观察计数,小球藻、四尾栅藻、斜生栅藻和野外样品藻体清晰可见且计数准确.
小球藻在10倍下计数2张照片,平均每张照片浮游植物302个,在20倍下计数5张照片,平均每张照片浮游植物73个,在40倍下计数10张照片,平均每张照片浮游植物18个;四尾栅藻在10倍下计数2张照片,平均每个照片浮游植物102个,在20倍下计数5张照片,平均每张照片浮游植物27个,在40倍下计数10张照片,平均每张照片浮游植物7个;斜生栅藻在10倍下计数2张照片,平均每个照片浮游植物325个,在20倍下计数5张照片,平均每张照片浮游植物77个,在40倍下计数10张照片,平均每张照片浮游植物20个. 出湖口样品在20倍下计数5个视野,平均每个视野浮游植物2个,在40倍下计数10个视野,平均每个视野浮游植物0.5个;主湖区样品在20倍下计数5个视野,平均每个视野浮游植物10个,在40倍下计数10个视野,平均每个视野浮游植物2~3个;湖汊样品在20倍下计数5个视野,平均每个视野浮游植物13个,在40倍下计数10个视野,平均每个视野浮游植物3~4个(表2).
2.3 两种方法计数统计分析
采用计数框行格法和倒置显微镜拍照法对6种样品进行镜检计数数据分析. 结果表明,计数框行格法计数的变异系数都较大,变异系数最大的是四尾栅藻样品(25.980),变异系数最小的是出湖口样品(9.157);倒置显微镜拍照法计数的变异性都较小,变异系数最大的是出湖口样品(6.356),变异系数最小的是湖汊样品(0.812)(表3). 与计数框行格法相比,倒置显微镜拍照法变异系数较小,说明倒置显微镜拍照法在浮游植物计数时稳定,存在较少影响因素.
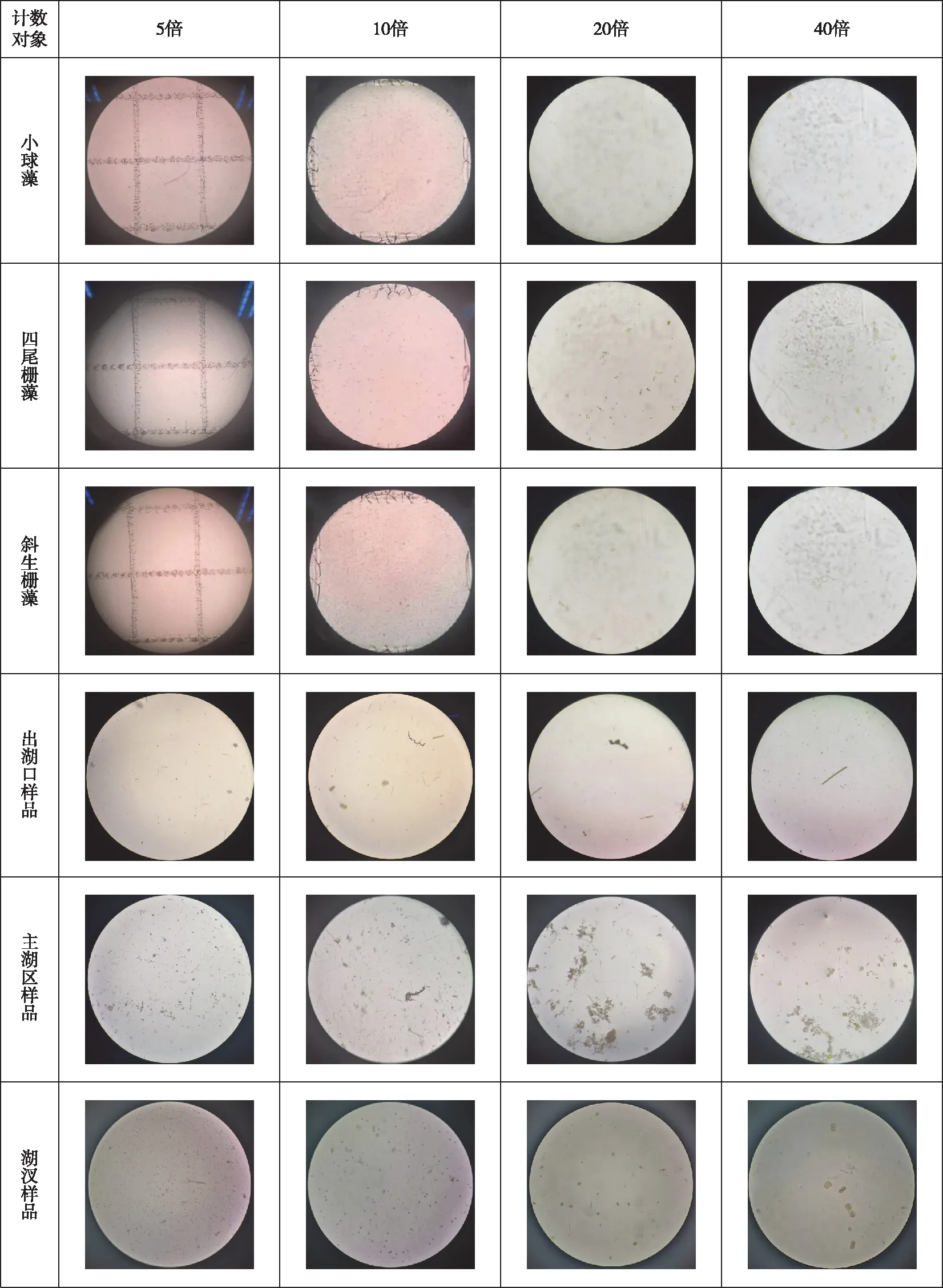
图1 计数框行格法计数视野Fig.1 Counting field of view by counting box row grid method


图2 倒置显微镜拍照法计数照片Fig.2 Counting photos with inverted microscope


表3 两种镜检方法的变异系数
3 讨论
3.1 影响浮游植物定量分析的因素
影响浮游植物定量分析的因素主要有采样、镜检和浮游植物种类等. ① 因野外采样方法不同常导致浮游植物定量分析不准确,例如使用浮游植物网采样会使微小浮游植物丢失;使用浓缩法在浮游植物样品浓缩不同倍数时浮游植物损失各不相同,因实际操作时浓缩法存在很大的经验性,从而降低了不同来源数据之间的可比性[2];使用联合国教科文组织1978年编入《浮游植物手册》(Phytoplankton manual)[17]的Utermöhl法可较好地避免浮游植物采样影响,但在移除样品上清液时会导致浮游植物损失,且Utermöhl倒置计数管视野法最大的沉淀样品量为100 mL. ② 浮游植物因镜检方法不同导致定量分析不准确,比如:计数框行格法、目镜视野法、目镜行格法、Utermöhl倒置计数管视野法等不同镜检方法在不同倍数条件下对定量分析的影响;因镜检使用不同容器及不同体积样品(如计数框0.1 mL和计数管1 mL)对定量分析的影响;因使用正置显微镜和倒置显微镜等不同显微镜及镜检不同人对定量分析的影响. 因此镜检方法选择是浮游植物定量分析的关键. ③ 浮游植物因种类不同而导致定量分析有差异. 不同门类植物的计数方式不同,例如盘星藻属、微囊藻属与裸藻属等计数方式不同,常导致定量分析不准确;不同浮游植物物种线性参数测量不同,浮游植物体积生物量计算模型构建不同. ④ 浮游植物定量分析从野外采样到数据分析,共经历3次重新抽样:第1次是野外采样调查;第2次是从样品中取0.1~1 mL计数;第3次是从计数框或计数管中选择观察的视野面积. 3次重新抽样分析和“采样、镜检和种类参数”分析未形成操作标准程序,常导致浮游植物定量分析数据不准确,最终研究结论较难解释实际现象和科学问题.
3.2 镜检方法的比较分析
镜检方法有正置镜检法和Utermöhl倒置计数管视野法,其中正置镜检法又分为计数框行格法、目镜视野法和目镜行格法,以上4种镜检方法都是人工视野法,即研究人员通过眼睛在目镜中观察每个视野,记录每个视野下有多少个浮游植物. 计数框行格法、目镜视野法、目镜行格法、Utermöhl倒置计数管视野法和倒置显微镜拍照法这5种镜检方法的比较分析见表4,以上5种方法在5、10倍下因浮游植物个体太小、个数太多,无法计数;目镜视野法、Utermöhl倒置计数管视野法在20、40倍下观察计数形状都为圆形,即一个视野,20、40倍下视野直径分别为1200、600 μm,面积分别为1.23、0.306 mm2,计数与计数框行格法结果一样. 目镜行格法在20、40倍下观察计数形状为宽度150或100 μm、长度2 mm的长方形,计数面积小于20、40倍下一个视野面积,故没采用目镜行格法计数方法.
本研究提出倒置显微镜拍照法可以减少以上4种方法缺陷,实现计数稳定. 倒置显微镜拍照法是将显微镜下观察到的浮游植物拍照保存,镜检过程仅需按程序拍照,然后对浮游植物照片进行分析计数及种类识别,避免因镜检人专业水平等因素影响. 影响倒置显微镜拍照法定量分析主要因素是显微镜的摄像头像素和拍照照片数量,样品静置沉降时间长短对定量分析有一定影响,由于浮游植物的沉降与藻体本身的形态、大小和生理状态等都有密切的关系, 理论上沉降的时间越长越好,但实际工作往往都有时间的限制[13],倒置显微镜拍照法沉淀浮游植物样品为0.5 mL,样品厚度842 μm,故此法沉降的时间在30 min即可消除沉降时间对镜检的影响.

表4 五种镜检方法的比较分析
3.3 镜检视野数和个体计数分析
镜检视野数和个体计数因浮游植物不同种类个体大小差异常导致定量分析不准确. 目前镜检法计数方式为:① 计数100~500个视野,计数值至少在300个以上,先计数100个视野,如计数后数值太少,再增加100个视野,计数视野均匀分布在计算框上;② 牛海玉等[7]认为镜检时选择计数400个即可基本保证定量数据的稳定性;③ 王骥等[19]认为视野在计数框中分布要满足均匀性和随机性,每次计数100个视野,每个样品计数两次取其平均值. 以上计数方法对浮游植物定量分析有较大不确定性,例如:计数值300个如何确定,盘星藻属与裸藻属计算个数方法不同;某些样品中浮游植物个数没有300个,又如何计数;“先计数100个视野”是在多少倍下计数没确定,不同藻类需在不同倍数下才能分清种类;在40倍条件下100个视野仅占计数框的8.1%,计数100个视野所用时间通常100~200 min,工作量太大. 镜检法计数常因研究人员不同,导致 “藻类计数、视野次数”等结果出现偏差,因此显微镜人工镜检对专业水平要求高[3]. 以上4种镜检方法并未对浮游植物分类及计数留下可重复分析的证据,常导致浮游植物定量分析不可重复计数.
3.4 倒置显微镜拍照法分析
倒置显微镜拍照法对四尾栅藻、斜生栅藻、小球藻和野外浮游植物样品进行拍照分析,拍照数量可依据浮游植物密度而增减,在20倍下镜检时,当每张照片浮游植物个数少于5个时,拍摄照片数不少于20张;当每张照片浮游植物个数为6~10个时,拍摄照片数不少于10张;当每张照片浮游植物个数为11~15个时,拍摄照片数不少于5张;当每张照片浮游植物个数大于15个时,需对水样进行稀释再观察,任何倍数下拍摄照片总面积不少于计数管面积的0.2%. 显微镜选择倒置Leica DMI4000B显微镜,视野参数、照片参数、计数照片数见表5.

表5 倒置显微镜拍照法镜检参数
倒置显微镜拍照法计数依据照片上的浮游植物进行计数,以保证计数结果的可比性和重复性. 在拍照过程中,常遇到某些个体一部分在照片中,另一部分在照片外,可规定出现在照片上都计数,因为每张照片都可单独拍照,相互之间独立. 计数单位可以用个体或细胞表示,用个体数表示,计数时较省力,但由于藻类的个体有单细胞或由数目相差悬殊的多细胞组成的群体,因此用个体数表示不及用细胞数表示精确. 当用细胞数表示时,对丝状、群体种类,可先计算个体数,然后求出该种类的个体的平均细胞数进行换算. 计数前先对样品在5倍物镜下作定性观察,以熟悉主要种类及其形态特点;在10、20和40倍物镜下分别拍摄10、20和20张,每个样品应取样计数3次,通过增加拍照数可提高计数的稳定性.
倒置显微镜拍照法影响因素主要有显微镜摄像头和浮游植物种类对计数影响. 浮游植物不同种类因个体大小相差悬殊而影响镜检计数,主要影响在一张照片上包含藻类数量,例如小球藻、四尾栅藻属可在一张40倍照片上,但颗粒直链藻则需在20倍下观察,因此在多少倍物镜条件下镜检要依据不同浮游植物种类来确定,避免对每种浮游植物测量线性参数和计数的影响. 采用浮游植物个体数量来估算浮游植物丰度可以说是不够精确的,因为不同种的浮游植物细胞大小差别很大[6],因此倒置显微镜拍照法才能准确地对每种物种进行计数分析,在进行生物量计算前首先要确定不同种类浮游植物的细胞大小及其计数的个数,依据种的计数才能计算出属、门等个数.
4 结论
1)倒置显微镜拍照法是浮游植物镜检的最佳方法. 在20倍下拍摄20张照片,对20张照片进行照片图像分析,避免传统方法的人为因素干扰. 增加镜检样品数和拍照次数,可提高定量分析数据稳定性. 倒置显微镜拍照法减少人为镜检不专业因素,为浮游植物长期观测数据可靠性奠定基础.
2)倒置显微镜拍照法比计数框行格法、目镜视野法、目镜行格法、倒置显微镜计数法对浮游植物计数更加稳定. 建议国家标准将倒置显微镜拍照法列为国家标准,有利于统一浮游植物定量分析的稳定性,有利于建立浮游植物大数据中心和浮游植物自动识别鉴定分析系统,更加有利于湖泊河流生态健康评价.
