含间位取代吡啶端基的新型pH荧光探针的合成与性能
2020-09-09邹佳成诸葛祥雪李业新袁春雪
邹佳成,诸葛祥雪,习 鹤,李业新,袁春雪*
(1.同济大学 材料科学与工程学院,上海 201804;2.西安电子科技大学 先进材料与纳米科技学院,陕西 西安 710071;3.济南大学 化学化工学院,山东 济南 250022)
pH检测在化学反应过程控制、环境分析、食品批量生产、医学诊断和生命科学分析中起着重要作用[1-5]。在众多pH检测方式中,pH荧光探针由于具有高灵敏度(亚分子水平)、亚纳米空间分辨率、高抗干扰能力、操作方便和实时检测的特性吸引了越来越多的关注[6]。近年来已经报道了众多pH荧光探针,例如荧光素、香豆素、罗丹明[7-9]和众多含氮杂环衍生物[10-11],然而它们大多具有一定的局限,例如一些探针仅适用于接近中性的pH范围或因较短的斯托克斯位移而受到严重的激发干扰。因此,设计一种用于检测酸性pH变化,并具有优良性能的pH荧光探针具有较好的实际意义。
朝格尔碱(Tröger’s base,TB)由于其具有C2对称性、手性和刚性凸形的独特结构,已被应用于诸如分子开关或液晶掺杂剂等广泛的领域[12-15]。此外,吡啶基团具有高灵敏度和高酸碱质子交换速率[16],这两者的独特性质引发了我们强烈的兴趣。本课题组在前期工作中报道了多种基于TB骨架的荧光探针,它们都展现了出色的pH检测特性[17-21]。通常,荧光探针的光物理性质可以通过设计不同的末端基团有效地调控;不仅如此,改变取代位点也可以实现对于荧光探针光物理特性的调控,因此进一步探索取代位置效应对荧光探针光物理性质的影响具有重要的意义。对于使用间位取代吡啶端基的荧光探针研究较少,并且氮原子在吡啶上的取代位置对于基于TB的荧光探针光物理性质的影响尚未见报道。
本文设计并合成了含间位取代吡啶端基的荧光探针2,8-双((E)-2-(吡啶-3-基)乙烯基)-6H,12H-5,11-甲二苯并[b,f] [1,5]重氮(TBMP,Scheme 1),其结构经1H NMR、13C NMR、HR-MS(ESI)表征。并通过pH滴定实验和DFT理论计算验证了其对pH值变化的检测机理[17-18]。
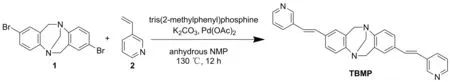
Scheme 1
1 实验部分
1.1 仪器与试剂
Bruker AVANCE 400 MHz型核磁共振仪(TMS为内标);Agilent 6210 ESI/TOF型高分辨质谱仪;DU-730型紫外-可见光分光光度计;Agilent Cary Eclipse型荧光分光光度计;INESA PHS-2S型台式pH计。
1,2按文献[22-23]方法合成;其余所用试剂均为化学纯或分析纯。
1.2 TBMP的合成
在100 mL三口瓶中加入11.9 g(5.0 mmol),22.2 mL(20.0 mmol)、碳酸钾2.8 g(20.0 mmol)、三(2-甲基苯基)磷0.076 g(0.25 mmol)和醋酸钯0.056 g(0.25 mmol),通入氮气,滴加N-甲基吡咯烷酮(NMP)10 mL,于130 ℃反应24 h(TLC检测)。冷却至室温,用二氯甲烷(3×50 mL)萃取,合并有机相,依次用水洗涤,无水硫酸镁干燥,经硅胶柱层析(洗脱剂:二氯甲烷/乙醇=50/1,V/V)纯化得淡黄色粉末TBMP0.84 g,收率39.4%;1H NMR(400 MHz,DMSO-d6)δ:4.18(d,J=16.7 Hz,2H),4.26(s,2H),4.67(d,J=16.7 Hz,2H),7.10(d,J=16.5 Hz,2H),7.15(d,J=8.4 Hz,2H),7.21(s,2H),7.25(d,J=16.5 Hz,2H),7.36(d,J=8.0 Hz,2H),7.41(d,J=9.6 Hz,2H),7.97(d,J=8.0 Hz,2H),8.41(d,J=4.0 Hz,2H),8.69(s,2H);13C NMR(101 MHz,DMSO-d6)δ:58.21,66.26,123.57,123.81,125.07,125.19,125.54,128.38,130.07,132.02,132.51,132.95,148.07,148.14,148.24;HR-MS(ESI)m/z:Calcd for C29H24N4{[M+H]+}429.2074,found 429.2078。
1.2 性能测试
将TBMP溶解于DMSO中,配制为10.0 μM储备液,在测试前稀释储备溶液至1.0 mM。实验中探针TBMP浓度始终为1.0 mM。金属离子分别由KCl,NaCl,CaCl2,MgCl2,FeCl3,ZnCl2,CuCl2·6H2O,MnCl2,CoCl2·6H2O,Cr(NO3)3·9H2O,Cd(NO3)2·4H2O,Ni(NO3)2·6H2O和AlCl3提供。所有溶液在最终光谱测量前均充分摇匀并静置30 min。
2 结果与讨论
2.1 探针TBMP在不同极性溶剂中的光谱学性质
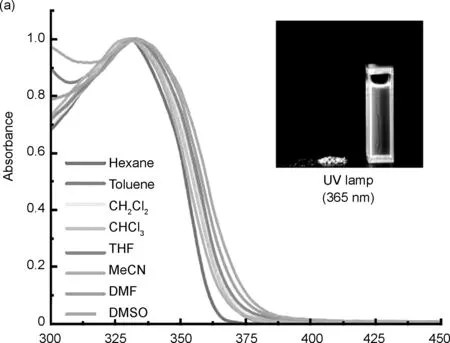
TBMP在溶液中和固态下均呈现出强蓝色荧光发射(图1插图)。TBMP在不同溶剂中的紫外吸收光谱图和荧光发射光谱图见图1a和图1b。由图可知,TBMP的紫外吸收峰位于331~340 nm附近,随着溶剂极性的增加,未观察到明显的紫外吸收峰偏移;而在荧光光谱中,随着溶剂极性的增加,荧光峰的位置从384 nm移动至460 nm,显示出了明显的红移,计算得斯托克斯位移从51 nm增加到127 nm。
λ/nm
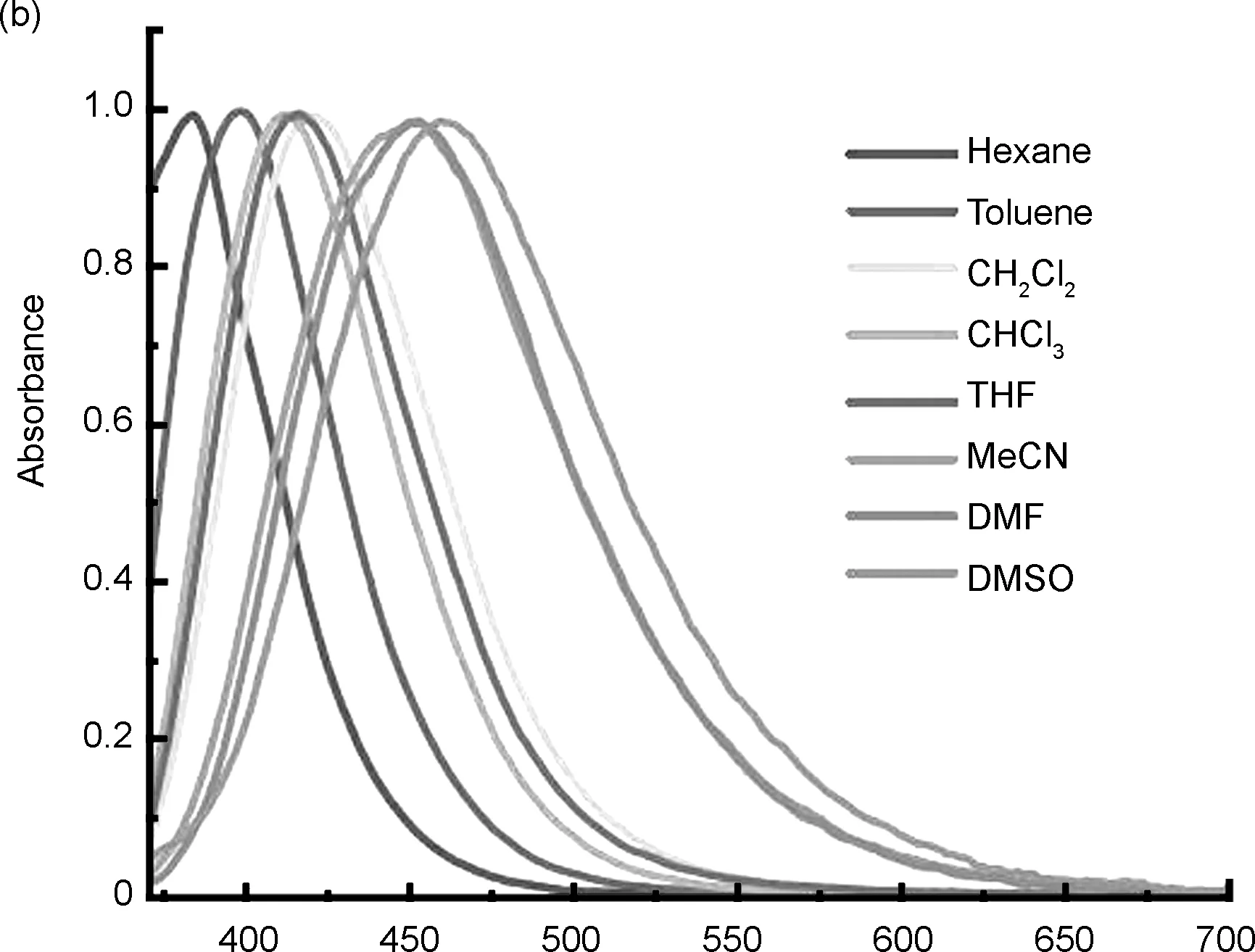
λ/nm图1 TBMP在各溶剂中的紫外吸收光谱(a)和荧光发射光谱(b)Figure 1 Normalized absorption(a) and fluorescent emission(b) spectra of TBMP in various solvents
TBMP在溶液中和固态下观察到的强蓝色荧光可能是由于分子内部的D-π-A电荷转移结构,该结构由TB桥上的胺基作为电子受体(D)以及两翼上的吡啶端基作为电子供体(A)共同构成,并通过电子的推拉相互作用实现有效的分子内电荷转移(ICT)。另一方面,TBMP在荧光光谱中明显的红移现象可能是由于激发态的TBMP分子具有比基态TBMP分子更高的极性,溶质与溶剂之间更强的偶极-偶极相互作用会导致能级显着降低,使得TBMP展现出明显的正溶剂化效应以及显著的红移[24]。TBMP在不同极性溶剂中的光谱学性质与对位和邻位取代的探针TBPP和TBOP相似[17-18],这表明吡啶中氮原子的取代位置对它们在不同极性溶剂中的光谱性质没有明显影响。
λ/nm
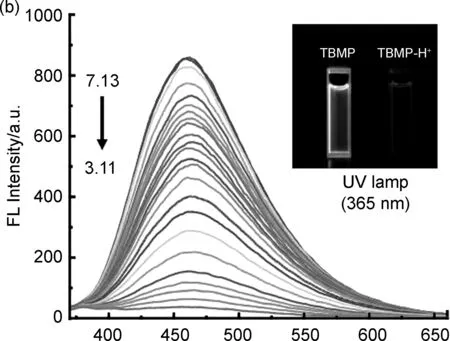
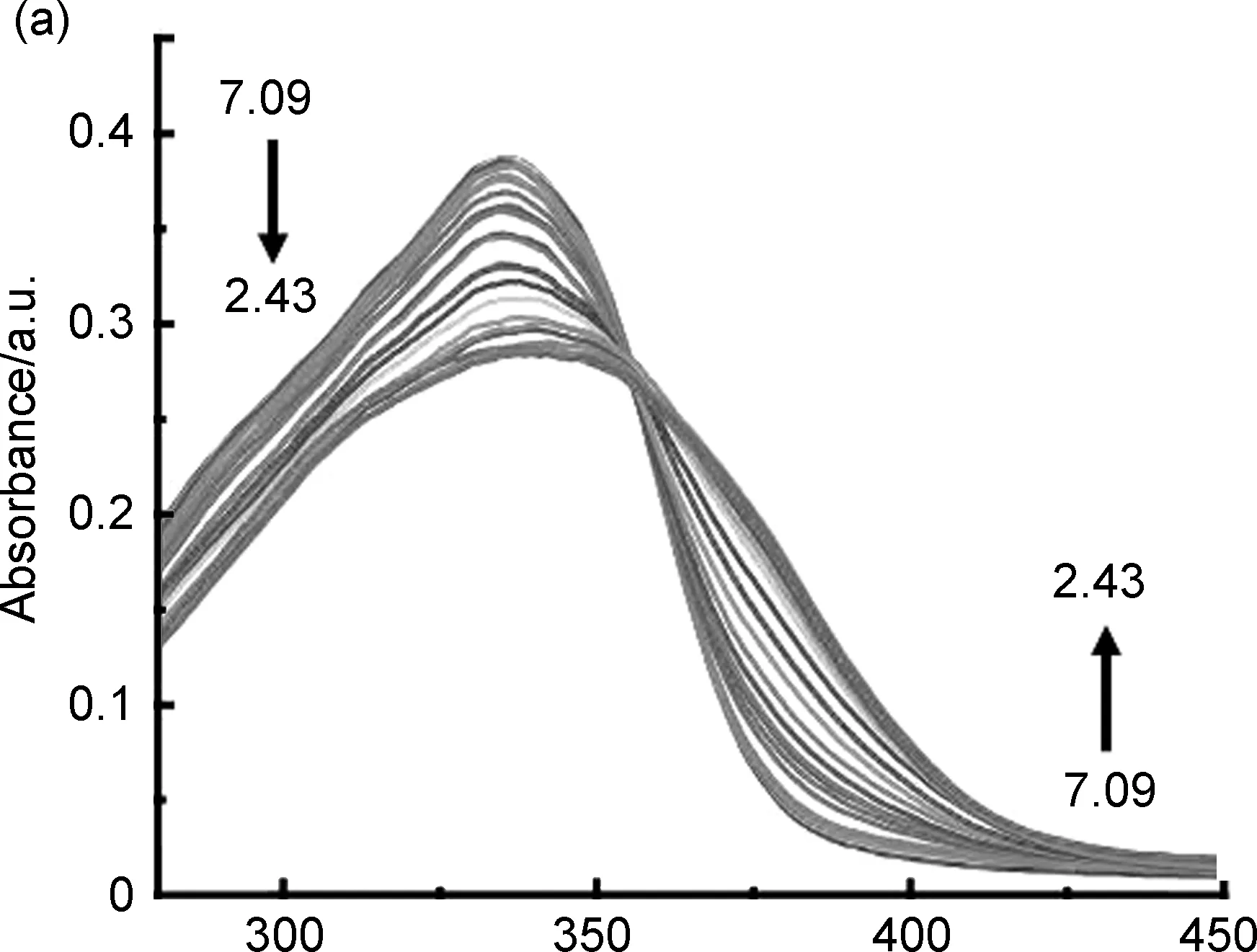
λ/nm图2 TBMP pH滴定实验的紫外光谱(a)和荧光光谱(b)Figure 2 Absorption(a) and fluorescent emission(b) spectra of TBMP in pH titration experiment
2.2 探针TBMP对pH滴定的紫外和荧光响应
图2a为pH紫外吸收滴定实验结果。由图可知,随着质子浓度增加(pH 7.09~2.43),在356 nm处观察到明显的消光点,在335 nm的紫外吸收下降并伴随轻微红移(335 nm至342 nm)。与TBPP和TBOP(均为50 nm左右)相比[17-18],TBMP的红移明显较小,并且未观察到新的吸收峰出现,这是由于吡啶上不同取代位置的氮原子与TB骨架之间不同的协同效应所致[25-26],推测间位取代的氮原子在质子化之后受到ICT效应的影响较小,对LUMO轨道的影响也较小[27]。
在pH荧光滴定实验中(图2b),TBMP在460 nm处具有明显的荧光发射峰,据此可以计算出TBMP具有较大的斯托克斯位移(127 nm),而较大的斯托克斯位移有助于减少分子内的激发相互干扰[11,28]。同时,探针TBMP展现出典型的荧光强度与pH值的关系[29](图3),随着pH值降低(7.13~3.11)时,探针TBMP的荧光强度逐渐减弱直到完全猝灭,使得探针TBMP可以用于检测的pH范围在 6.5~3.11,根据Henderson-Hasselbach方程可以计算得出TBMP的pKa值为3.89。此外,pH滴定过程中没有观察到光谱偏移,表明质子化后的结构(TBMP-H+)在溶液中不发光。图4展现了TBMP、TBMP-H+的结构与pH响应机理。
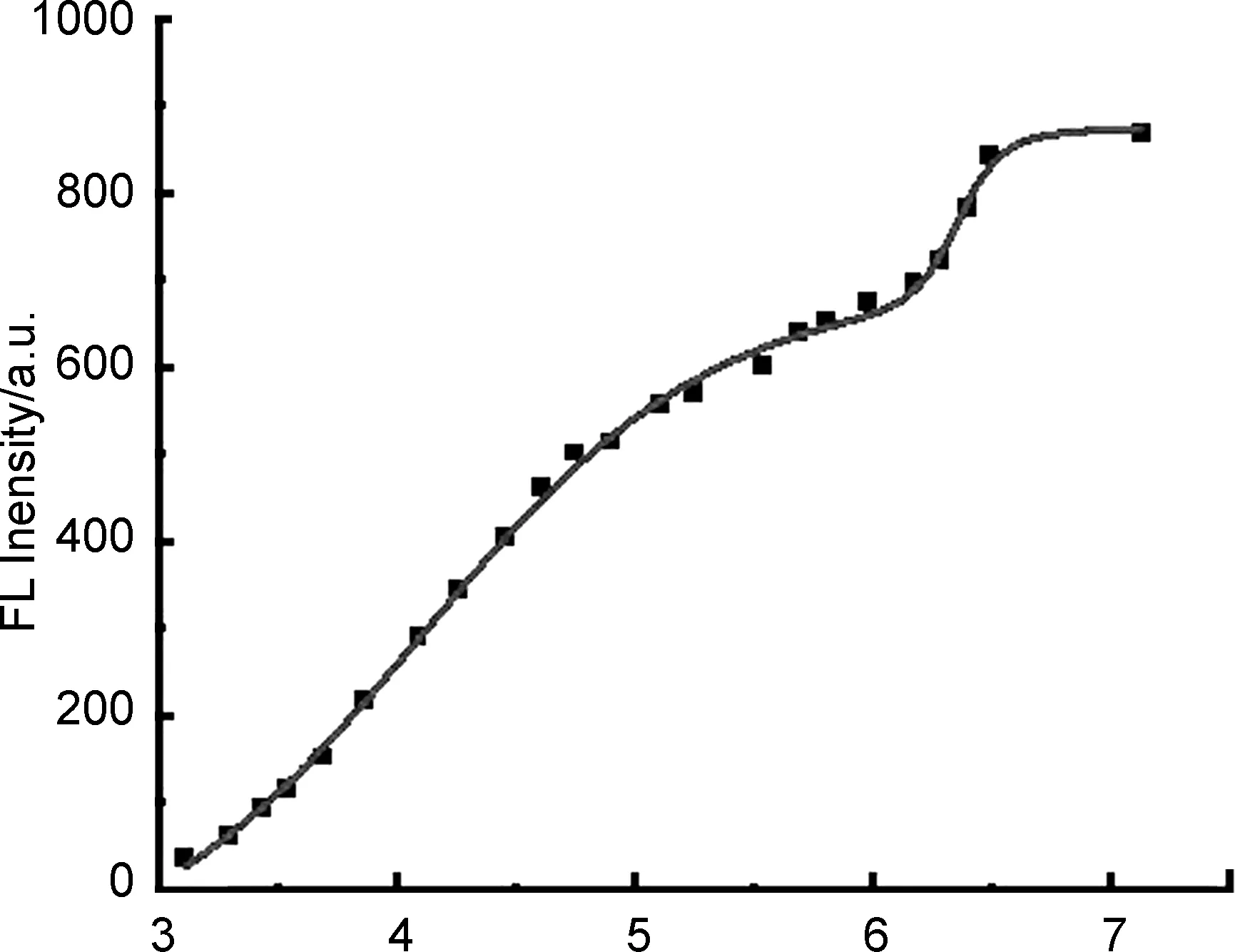
pH图3 TBMP在460 nm处的荧光强度与pH值的关系;激发波长335 nmFigure 3 Fluorescence intensities plot of TBMP vs.pH value at 460 nm;λex=335 nm
2.3 pH检测过程机理探究
为了进一步探索TBMP的检测机理,在TBMP的DMSO-d6溶液中加入不同浓度的稀盐酸,并对样品进行1H NMR检测,结果见图4。由图4可知,随着质子浓度增加,TB骨架的质子特征吸收峰(10-H和11-H)和吡啶端基上质子特征吸收峰(1-H和2-H)逐渐向低场移动,表明TB骨架上的N和吡啶端基上的N都发生了质子化。TBMP的质子化位点与只有吡啶端基发生质子化的TBPP和TBOP有显著不同[17-18]。
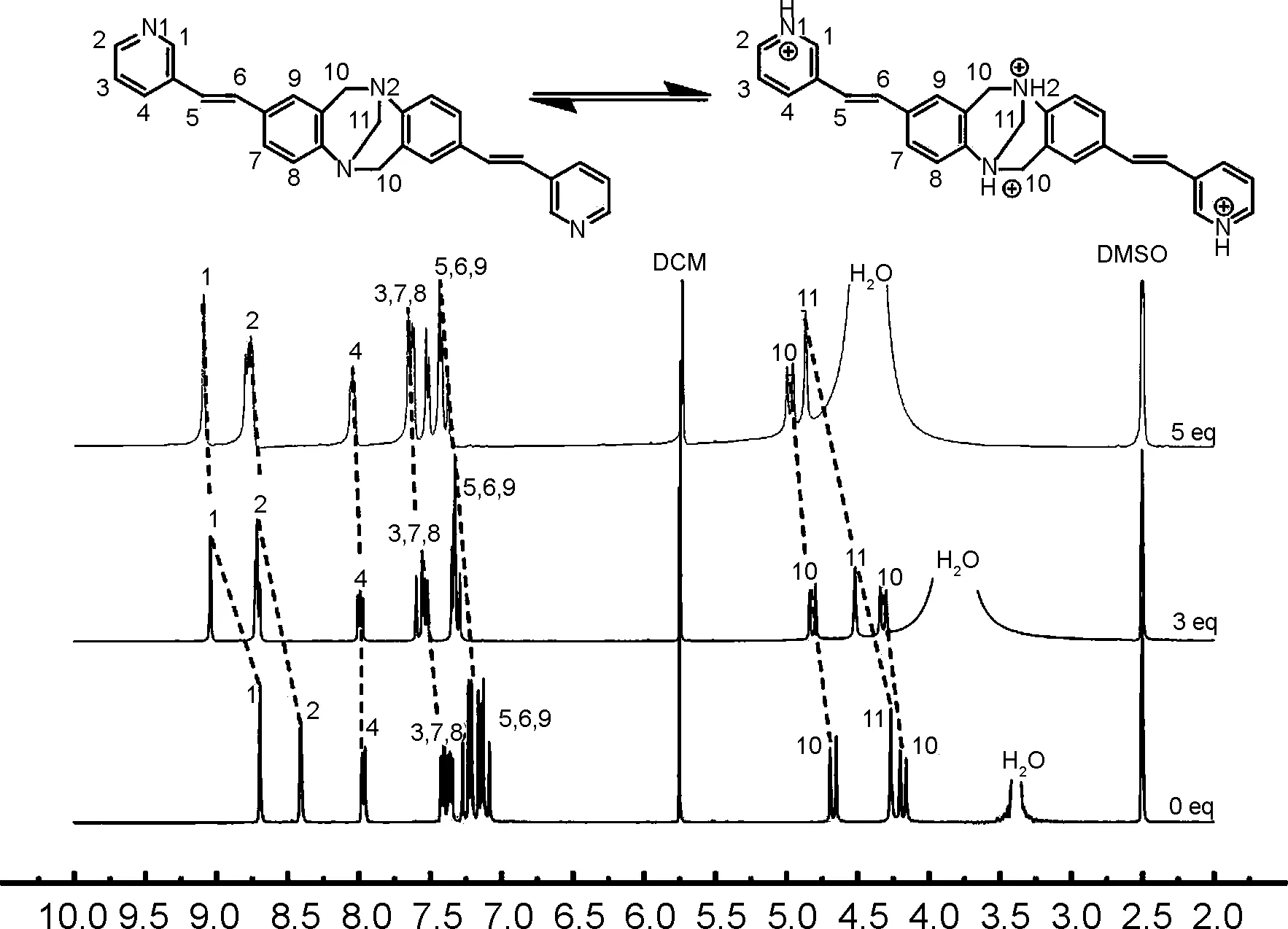
δ图4 探针TBMP逐滴加入等量稀盐酸后的1H NMR谱图Figure 4 1H NMR spectra of probe TBMP in DMSO-d6 by adding equivalent amount of HCl
为了进一步理解TBMP的检测机理,使用Gaussian 09程序以及B3LYP / 6-311G(d)函数对TBMP的LUMO和HOMO进行了密度泛函理论(DFT)计算,TBMP-H+的LUMO-HOMO能隙(1.31 eV)小于TBMP的能隙(3.82 eV),这与紫外吸收光谱中观察到的红移现象相对应。对质子化发生在吡啶端基N1上和质子化发生在TB骨架N2的结构进行了计算,其相对能量分别为0 eV和3.03 eV,表明TBMP的质子化过程倾向于首先发生在吡啶端基上的N1。推测从TBMP到TBMP-H+的质子化过程有两个步骤:首先质子化发生在吡啶端基的N1,然后TB骨架上的N2被质子化。相比之下,TBPP和TBOP的质子化仅发生在吡啶端基[17-18]。这是由于TBPP和TBOP的吡啶氮原子的质子化通过ICT效应降低了TB骨架上N周围的电子密度,使TB骨架上质子化后的结构较不稳定,倾向于丢失质子。然而,在TBMP的双质子化过程中,由于吡啶上间位取代的N具有不同的电子效应和空间位阻效应,两者的协同使得ICT效应不会通过共轭体系传导至TB骨架,因此TB骨架上N质子化后的结构更稳定,从而令TBMP展现出独特的双质子化过程。
Time/min

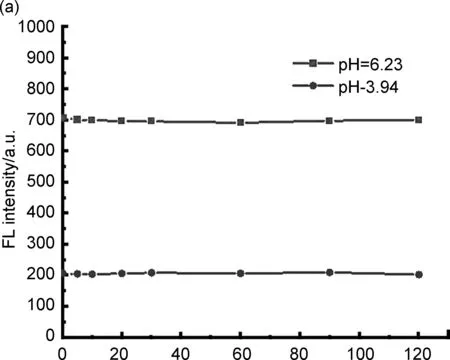
Cycies图5 pH值为6.23和3.94时,探针TBMP在2 h内的荧光强度(460 nm)(a),反复调节pH值时探针TBMP荧光强度(460 nm)(b)Figure 5 Plot of fluorescence intensities(460 nm) of TBMP at pH 6.23 and 3.94 in 2 h(a),plot of fluorescence intensities(460 nm) with reverse pH values(b)
2.4 探针TBMP的稳定性,可逆性和选择性
在实际应用中,稳定性、可逆性和选择性是pH荧光探针的关键指标。检测TBMP溶液在pH值 6.23和3.94条件下2 h内的荧光强度(图5a),TBMP的荧光强度在整个测试过程中几乎保持同一水平。这些表明TBMP对于酸性条件的检测具有优秀的稳定性。此外,为了检验TBMP的可逆性,通过加入微量稀盐酸和氢氧化钠将pH值控制在7.00~2.39,反复调节pH值数次并记录荧光强度(图5b),其荧光强度仍然保持在相同水平,可以用作酸性pH荧光探针。
与此同时,探究含氮有机小分子新型pH荧光探针的选择性对于其在实际情况下的应用至关重要,通过测试TBMP的选择性可以推测出其在不同离子环境下的抗干扰性(图6)。由图可知,金属离子和氨基酸的存在对荧光强度没有明显影响,这表明TBMP在金属离子和氨基酸出现的情况下对H+的具有优秀的选择性。探针TBMP的稳定性、可逆性和选择性实验结果与探针TBPP和TBOP相似[17-18],表明N取代位置效应对探针的稳定性、可逆性和选择性的影响较小。
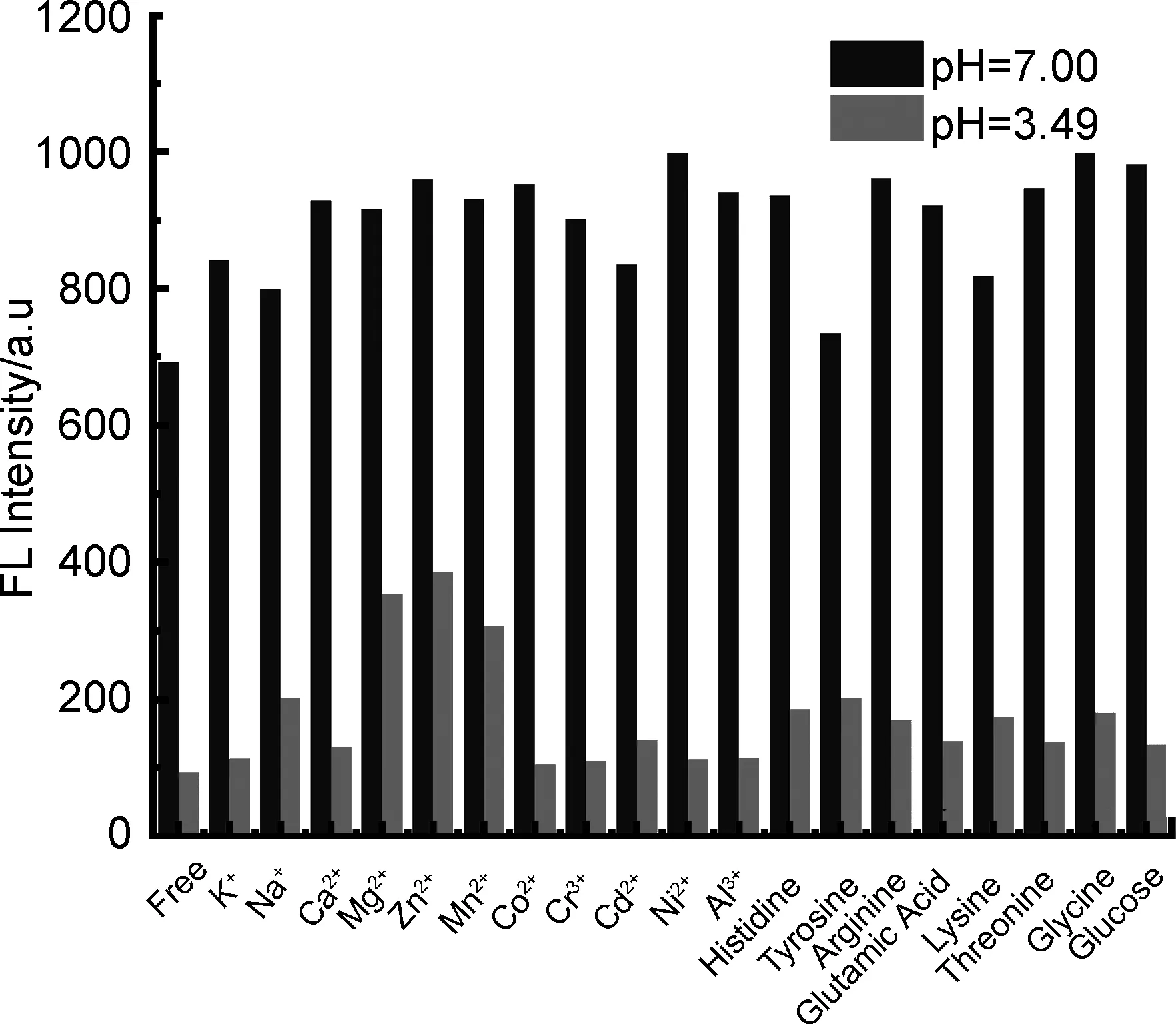
图6 在不同金属离子和氨基酸条件下,探针TBMP在pH 7.00(黑)和pH 3.49(灰)下的荧光强度Figure 6 Fluorescence intensities(460 nm) of TBMP at pH 7.00(black) and 3.49(grey) under the condition with different metal ions and amino acids
设计并合成了基于朝格尔碱骨架和间位取代吡啶端基的新型pH荧光探针TBMP。探针TBMP对于酸性pH变化有明显的荧光响应并具有较大的斯托克斯位移(127 nm)。1H NMR和DFT理论计算揭示了检测机理,其中吡啶端基和TB骨架中的氮相继发生质子化引起了其对pH值变化的光谱学响应。TBMP在pH滴定实验中显示出相对较小的红移,但它仍具有良好的稳定性,灵敏度和选择性,具有在酸性条件下用作pH荧光探针的潜力。在极性不同的溶液中,TBPP、TBOP和TBMP的光物理性质相似;而在滴定实验中,受到在吡啶端基上间位取代氮的取代位置效应的影响,TBMP光谱学性质及其质子化过程与另两种探针有显著的不同。该研究有助于进一步设计和理解具有吡啶端基的新型荧光探针。
