重症超声在脓毒症机械通气患者撤机中的评估价值*
2020-09-09杨晓英顾华杰戴晓勇叶宥文
杨晓英,顾华杰,戴晓勇,叶宥文
同济大学附属杨浦医院急诊科(上海200090)
脓毒症是由于严重感染诱发机体反应失调而导致的多器官功能障碍,一直是ICU的主要死亡原因之一,发病率以每年1%~5%的速度增长,且病死率高达40%[1-2]。脓毒症患者多需接受机械通气(Mechanical ventilation,MV)治疗,但长时间MV易伴发呼吸机相关肺损伤、膈肌功能障碍等多种并发症。因此,能否在MV后适当时机成功撤机直接影响脓毒症患者的预后,也是该领域研究的热点。以往通常采用最大吸气压、浅快呼吸指数(Rapid shallow breathing index,RSBI)等呼吸力学指标预测撤机,但敏感性、特异度不理想,且参考阈值不统一[3]。近年来重症超声以其简便快速、无创可重复、动态监测等优势,已广泛应用于撤机前心肺、膈肌功能的评估[4-5],但对其预测脓毒症患者撤机成败的研究仍较为少见。本研究通过分析心肺、膈肌指标与撤机结局的相关性,探讨重症超声在脓毒症MV患者撤机中的价值。
对象与方法
1 研究对象 回顾性分析2017年6月至2019年6月我院急诊科收治的60例脓毒症患者临床资料。其中男33例,女27例;年龄19~75岁,平均(47.9±4.6)岁;脓毒症48例,脓毒性休克12例;急性生理与慢性健康评分(Acute Physiology and Chronic Health EvaluationⅡ,APACHE Ⅱ)15~26分,平均(23.1±2.5)分;MV时间3.4~8.2 d,平均(5.4±1.6)d。根据撤机是否成功(成功拔除气管插管或脱开呼吸机且自主呼吸>48 h视为撤机成功),分为撤机成功组(41例)和撤机失败组(19例)。病例纳入标准:①均符合《国际严重脓毒症和脓毒症休克指南(2016年)》的诊断标准[6],存在明确感染灶;②年龄18~75岁,MV时间>48 h;③原发病明显好转且无新发疾病,经自主呼吸试验(Spontaneous breathing test,SBT)判定符合撤机标准[7]。排除标准:晚期恶性肿瘤、家属放弃治疗、无法接受超声检查或合并膈肌功能障碍、严重心肝肾功能障碍者。本研究通过伦理委员会审批,患者亲属知情同意并全程配合。
2 研究方法
2.1 一般资料收集:通过病例系统查阅患者基本资料,包括性别、年龄、APACHE Ⅱ评分、序贯器官衰竭(Sequential Organ Failure Assessment,SOFA)评分、MV时间、原发疾病、SBT前心率(Heart rate,HR)、收缩压(Systolic blood pressure,SBP)、舒张压(Diastolic blood pressure,DBP)、平均动脉压(Mean arterial pressure,MAP)、呼吸频率(Respiratory rate,RR)、潮气量(Tidal volume,VT)、氧合指数(PaO2/FiO2)等,并计算RSBI,计算公式为RSBI=RR/VT。
2.2 心功能评估:采用西门子Acuson X300彩色超声诊断仪进行心功能评估,包括左室舒张末内径(Left ventricular end-diastolic diameter,LVED)和左房内径(Left atrial diameter,LAD),并根据公式计算左心室射血分数(Left ventricular ejection fraction,LVEF)。
2.3 肺超声(Lung Utrasonography Score,LUS)评分评估:以腋前线、腋后线为界,将一侧胸壁分为前、侧、后3个区,每个区分上、下部,左、右胸壁各6个区域,合计12个区域。SBT前对各个区域进行肺部超声检查并按照下列标准评分[8]:①0分(正常通气区):存在肺滑动,A线和(或)不超过两条B线;②1分(中度通肺通气减少区):存在多条、分隔B线;③2分(重度通肺通气减少区):存在多条、融合B线;④3分(肺实变区):呈支气管充气征。LUS评分为12个区域评分之和,分值范围0~36分,得分越高提示肺通气功能越差。
2.4 膈肌功能监测:采用西门子Acuson X300超声仪在SBT开始后30 min监测膈肌功能。患者取仰卧位,选用2.5~5.0 MHz超声探头,从双侧腋前线移至肋弓下缘,以肝、脾为膈肌透声窗。切换为M模式,监测膈肌运动,取样线与膈肌垂直,测量膈肌运动范围,即膈肌移动度(Diaphragm mobility, DE)=吸气末膈肌幅度-呼气末膈肌幅度。同时,于腋中线与肋间腋前线处测量吸气末膈肌厚度(Diaphragm thickness at the end of inhalation,DTei)和呼气末膈肌厚度(Diaphragmatic thickness at the end of expiration,DTee)。膈肌增厚率(Diaphragm thickening rate,DTF)=(DTei-DTee)/DTee×100%。所有测量均在一个呼吸周期内,取3次测量平均值,由取得重症超声资质的高年资医师完成。
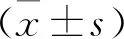
结 果
1 两组患者一般资料比较 与撤机失败组相比,撤机成功组年龄较小,MV时间较短,脓毒症病情较轻,APEACHE Ⅱ评分、SOFA评分、LUS评分、RR、LAD、RSBI较低,LVEF、PaO2/FiO2、DE、DTF较高,差异均有统计学意义(P<0.05)。两组性别、基础疾病、HR、SBP、DBP、MAP、LVED比较,均无统计学差异(P>0.05)。见表1。

表1 两组患者一般资料比较
2 脓毒症MV患者撤机失败的多因素回归分析 将单因素分析有统计学意义的因素纳入逐步非条件Logistic回归分析,结果显示RSBI、LAD、LUS评分是脓毒症MV患者撤机失败的独立危险因素,而DTF则是保护性因素(P<0.05)。见表2。
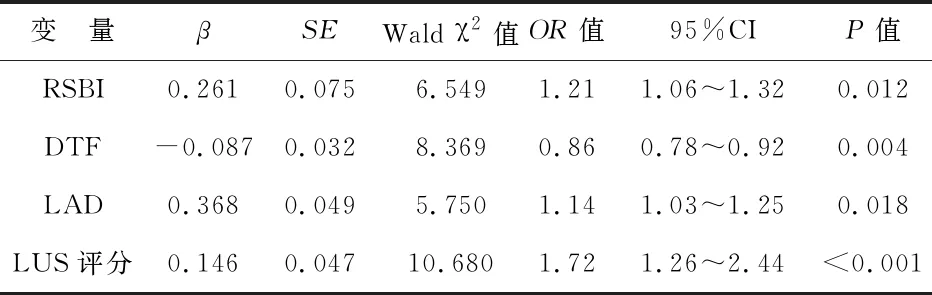
表2 脓毒症MV患者撤机失败的
3 各指标对脓毒症MV患者撤机结局的预测价值 对RSBI、LAD、DTF、LUS评分进行ROC曲线分析,结果显示RSBI、LAD、DTF、LUS评分联合预测脓毒症MV患者撤机失败的AUC为0.956(95% CI:0.920~0.998),灵敏度为94.7%,特异度为97.6%,均显著高于4个指标的单独预测结果(P<0.05)。见表3(图1)。

图1 各指标预测脓毒症MV患者撤机失败的ROC曲线

表3 各指标对脓毒症MV患者撤机结局的预测价值
讨 论
MV撤机与最小化机械通气时程一直是急重症领域研究的热点与难点。众所周知,当接受MV的原发疾病改善,自主呼吸能力可满足通气需求时,应及时撤除MV对呼吸的支持,恢复完全自主通气,但超过20%的危重症患者可能出现撤机失败,从而导致再插管率与病死率升高,脓毒症患者因普遍存在肺功能损伤,撤机问题更为突出[9-10]。Dehghani等[11]研究认为,MV撤机的成败是多因素共同作用的结果,除原发疾病控制不佳外,主要包括呼吸道及肺功能障碍、脑功能障碍、心功能障碍、膈肌功能障碍、内分泌和代谢功能障碍。因此,及时准确地评估相关危险因素并积极干预是提高脓毒症患者撤机成功率的关键。
RSBI既往被视为预测撤机结局的首选指标。Spadaro等[12]研究表明,RSBI>105次/(min·mm)时,对撤机结局预测的灵敏度高达95%,而当RSBI<105次/(min·mm)时,特异度仅为67%,且不同研究报道中RSBI预测撤机的阈值差异较大。本研究结果显示,RSBI是脓毒症MV患者撤机失败的独立危险因素,以RSBI<49.2次/(min·mm)为标准预测撤机成功,灵敏度可达84.2%,但特异度仅为61.0%。由此可见,单纯依靠RSBI无法准确预测撤机结局,假阴性较高。近年来,随着重症超声技术的快速发展,其作为一种重要床旁工具广泛应用于心肺衰竭的重症患者撤机评估,且在膈肌监测方面独具优势[13]。呼吸机相关膈肌功能障碍与MV时程的相关性愈发引起关注,MV 18~24 h即可导致膈肌功能障碍[14]。本研究发现,撤机成功组 DE、DTF较撤机失败组高,尤其是DTF对预测撤机结局的灵敏度和特异度可达89.8%、74.6%,说明DTF作为膈肌厚度动态指标,可更真实地反映膈肌功能,避免SBT期间肋间内肌、外肌等辅助呼吸肌的干扰[15],有效识别并预测撤机失败的高危患者。
由于微循环障碍、组织低灌注,脓毒症患者多合并多器官局部缺血,可导致心脏收缩、舒张功能障碍,其中左心室舒张功能障碍可导致脓毒症患者死亡风险增加[16]。撤机时,患者胸膜腔内压逐渐下降,回心血量、心室跨壁压增加,诱发心脏前、后负荷升高。同时,交感神经兴奋,儿茶酚胺分泌增加,导致心肌氧耗增加,老年脓毒症患者对心功能变化更为敏感。Landesberg等[17]研究认为,心功能不全可影响患者的撤机结局,导致撤机延迟或失败,约占所有撤机失败的87%,同时撤机可能进一步加重心肺功能下降,故脓毒症患者撤机前尤其需要关注心肺功能。本研究中,SBT前LAD、LUS评分与撤机结果密切相关,与姜明明等[18]研究结果一致。LAD是反映左室舒张功能较敏感的指标,而LUS评分是肺通气减少程度的量化评价工具,能够有效反映肺部通气丢失、肺泡塌陷情况。Soummer等[19]发现,当SBT末LUS评分>17分时,拔管后呼吸窘迫风险为85%,而当LUS评分<13分时撤机成功率高。进一步分析发现,上述各指标联合评价对撤机成功率具有更高的敏感性和特异性,从而更加全面地评估撤机条件,以便于及时调整治疗策略,最大限度地改善预后。
综上所述,除RSBI等传统指标外,结合重症超声监测DTF、LAD、LUS评分等指标有助于提高脓毒症MV患者撤机结局预测准确性,从而指导临床治疗。
