西红花苷通过抑制氧化应激和炎症反应对糖尿病大鼠肾脏损伤的保护作用*
2020-09-09邢甜甜
邢甜甜,单 伟
1.锦州医科大学基础医学院解剖学教研室(锦州 121001);2.辽宁省营口市经济技术开发区中心医院(营口 115007)
糖尿病肾病(Diabetic nephropathy,DN)以肾小球基底膜增厚、系膜基质增生等为特征,最终引起尿蛋白增加甚至肾功能衰竭[1-5]。Ye等[6-7]研究发现,氧化应激和炎症改变对DN发展尤为关键。西红花苷为中药西红花的提取物,因其抗炎、抗氧化、抗糖尿病等作用突出而备受关注[8]。研究[9]发现,老年大鼠肾脏病变时,可出现氧化应激和炎症异常,西红花苷腹腔注射给药 4 周后血清肾功能指标、氧化参数、炎症基因表达水平明显下降,治疗效果较好。然而,西红花苷对DN的影响尚不清楚。因此,本研究拟观察西红花苷对DN大鼠肾脏的保护作用并探讨相关机制,为研究DN的治疗方案拓展思路。
材料与方法
1 实验材料
1.1 实验动物:雄性SD大鼠45只,体质量为200~240 g(购自锦州医科大学)。
1.2 主要试剂和仪器:链脲佐菌素(Streptozotocin,STZ);西红花苷(批号:111588-200501);核因子κB(Nuclear factor-κB,NF-κB)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)及白介素-6(Interleukin-6,IL-6)一抗 (英国Abcam公司);HE染色、超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、丙二醛(Malondialdehyde,MDA)试剂盒及Western blot二抗;倒置显微镜(日本Olympus公司);石蜡切片机(德国SLEE公司)。
2 研究方法
2.1 动物分组:取雄性SD大鼠30只,按55 mg/kg一次性腹腔注射STZ,72 h测血糖,将血糖浓度大于16.7 mmol/L的大鼠定为糖尿病模型并随机分成糖尿病组和西红花苷组(30 mg/kg),每组15只。另取15只正常SD大鼠作为对照组。每天给药1次,剂量依据文献[9-10]及预实验确定。12周后进行各项指标的检测。
2.2 样本制备:实验过程中检测大鼠空腹血糖,大鼠处死前取血离心后取上清-20 ℃冻存,待测血尿素氮(Blood urea nitrogen,BUN)、尿白蛋白/肌酐比值(Albumin/creatinine ratio,ACR)、血肌酐(Serum creatinine,Scr)。12周后,每组取5只大鼠,固定后取出肾脏进行石蜡切片,用于HE染色及免疫组化。每组另取5只大鼠活取肾脏,裂解后制备上清,-20 ℃保存,用于进行Western blot。每组另取5只大鼠活取肾脏制备100 g/L匀浆,-20 ℃保存,用于SOD、CAT、MDA含量检测,均采用试剂盒检测。
2.3 HE染色:①经2.2制备的切片脱蜡后PBS洗3次;②苏木素浸染2 min,自来水冲洗;③滴加伊红1 min;④脱水透明后封片,拍照观察。
2.4 免疫组化染色检测大鼠肾脏NF-κB表达:①2.2制备的切片于PBS洗涤4次;②3% H2O2室温12 min,PBS洗涤3次;③3%血清室温下封闭40 min,不洗;④滴加一抗NF-κB(1∶600),4 ℃过夜, PBS洗涤3次;⑤滴加二抗,室温30 min,PBS洗涤3次;⑥滴加链霉亲和素-生物素-酶复合物,室温下30 min,PBS洗涤3次;⑦DAB显色后拍照,Image J软件分析NF-κB表达阳性率。
2.5 Western blot检测NF-κB、TNF-α及IL-6蛋白相对表达:①提取肾脏总蛋白,BCA法测蛋白浓度;②10% SDS-PAGE凝胶电泳后转移至PVDF膜,以含1% BSA的TBST室温封闭3 h;③加一抗4 ℃过夜,TBST洗涤5次;④加入HRP标记的二抗室温2 h,TBST洗涤5次;⑤ECL试剂盒显影,Image J软件分析灰度值。

结 果
1 三组大鼠血糖、BUN、ACR、Scr比较 见表1。与对照组相比,糖尿病组血糖明显升高(P<0.05),BUN、ACR和Scr亦明显升高(P<0.05)。而与糖尿病组相比,西红花苷组血糖、BUN、ACR和Scr均不同程度下降(均P<0.05)。

表1 三组大鼠血糖、BUN、ACR、Scr比较
2 三组大鼠肾组织HE染色结果 见图1。对照组肾组织形态规则。糖尿病组肾组织结构紊乱,肾小球水肿增大。与糖尿病组相比,西红花苷组上述变化均有所改善。
3 三组大鼠肾脏SOD、CAT、MDA比较 见表2。与对照组相比,糖尿病组MDA含量明显升高,SOD、CAT含量明显降低(P<0.05)。而与糖尿病组相比,西红花苷组MDA含量明显降低,SOD、CAT含量明显升高(P<0.05)。

表2 三组大鼠肾脏SOD、CAT和MDA比较
4 三组大鼠肾脏NF-κB蛋白表达比较 见表3(图2)。与对照组相比,糖尿病组NF-κB表达明显增加(P<0.05)。与糖尿病组相比,西红花苷组NF-κB表达明显降低(P<0.05)。
5 Western blot检测结果 见表3(图3)。与对照组相比,糖尿病组NF-κB、TNF-α及IL-6表达明显增加(P<0.05)。与糖尿病组相比,西红花苷组NF-κB、TNF-α及IL-6表达明显降低(P<0.05)。
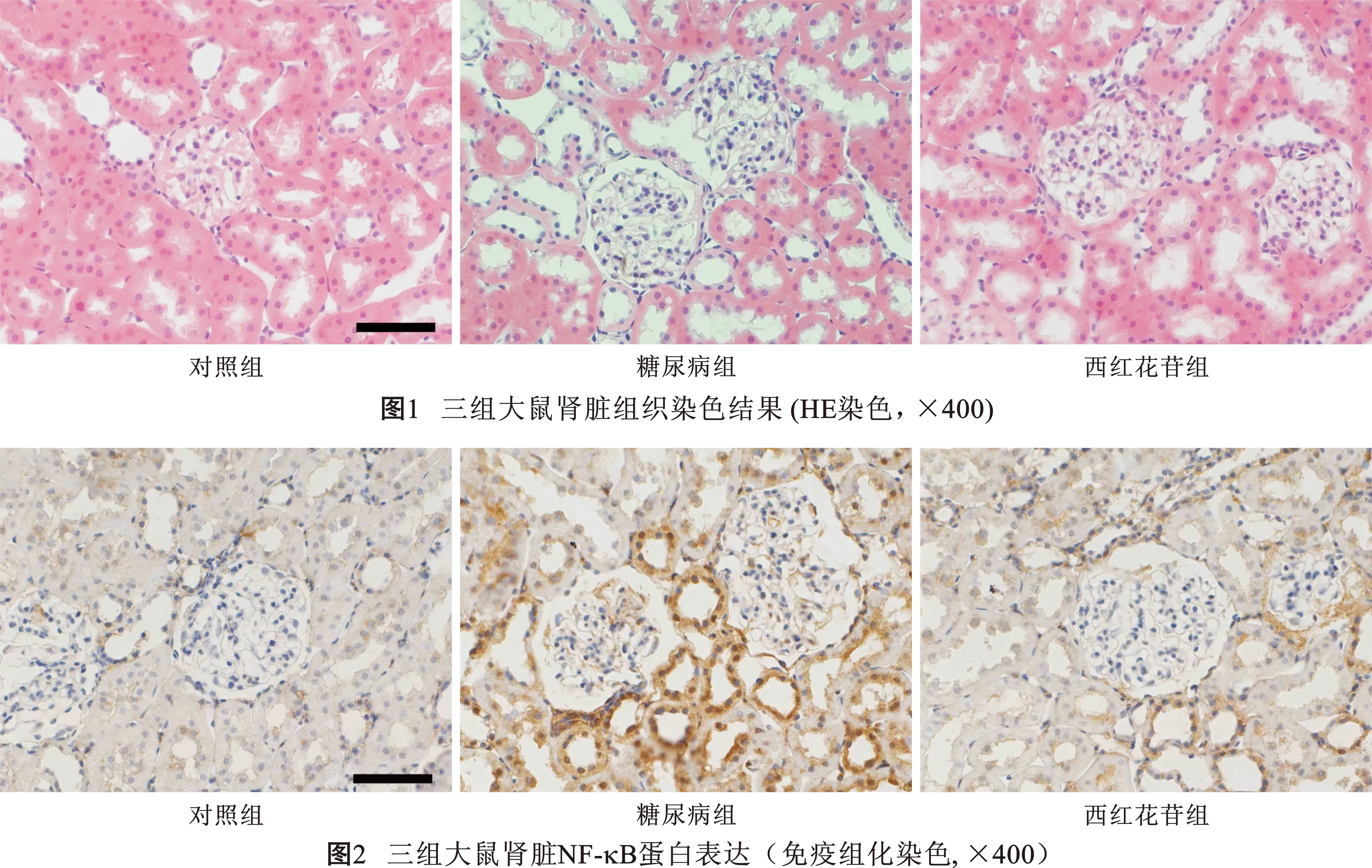

表3 三组大鼠肾脏NF-κB、TNF-α及IL-6蛋白相对表达比较(%)

图3 Western blot检测NF-κB、TNF-α及IL-6蛋白相对表达
讨 论
DN是一种以肾小球系膜和肾间质组织损伤为特征的进行性、不可逆性肾脏疾病。氧化应激和炎症反应为DN发病的中心因素[11-12]。氧化应激失衡时会引起肾脏SOD、CAT和MDA含量的改变[13]。SOD对活性氧的清除只有在CAT的作用下才有效,因为CAT可进一步清除SOD产生的过氧化氢。这些酶之间的平衡对于有效清除细胞内器官中的氧自由基非常重要[14]。
本研究检测了肾脏匀浆中SOD、CAT和MDA的含量,用来评价大鼠肾脏抗氧化平衡。发现糖尿病组肾组织匀浆中MDA含量升高,SOD和CAT含量降低,提示DN状态下肾组织匀浆中的氧化状态失衡。而经过西红花苷治疗后能降低MDA含量,升高SOD和CAT含量,同时血糖、BUN、ACR及Scr等血清学指标均明显下降,说明西红花苷可调节血糖及提高抗氧化能力,发挥对DN大鼠肾脏损伤的保护作用。Jnaneshwari等[15]报道通过对Wistar大鼠腹腔注射环磷酰胺造成内源性ROS升高,引起氧化失衡状态,西红花苷(10 mg/kg)口服给药 6 d 后上述病理学改变可明显改善。Shirali 等[8]应用西红花苷对STZ诱导的 2 型糖尿病大鼠治疗5个月后,发现大鼠状态明显好转,毛色更加洁白光亮,且血糖水平及氧化应激反应明显降低。以上数据均表明西红花苷对糖尿病均有较好的治疗效果,与本研究结果相一致。另有研究[16-17]发现,DN也与促炎细胞因子的增加有关。为了揭示西红花苷抗DN过程中肾损伤的确切机制,我们研究了其对炎症途径的影响。DN过程中肾脏损伤的异常炎症反应导致细胞因子和趋化因子的产生,进而促进了炎症的分子途径[18]。Ayepola等[19]研究表明,在肾损伤疾病中促炎介质的显著增加证明器官损伤和功能障碍的严重程度与促炎介质的水平呈正相关。Malik等[20]发现,DN状态下肾组织中NF-κB、TNF-α、IL-6水平明显升高。然而,应用西红花苷后,炎症因子均明显降低。这说明西红花苷可减轻与DN相关的肾损伤,参与抑制分子炎症途径。结果提示,对DN大鼠给予西红花苷对预防肾功能损伤具有良好的保护作用,至少部分是通过改善炎症信号通路实现的。
综上所述,我们证明西红花苷可有效缓解DN过程中的大鼠肾脏损伤。这种保护作用表现为改善肾脏损伤时血清相关指标、氧化/抗氧化失衡和抑制分子炎症途径。当然,DN发病机制复杂,西红花苷对DN大鼠肾脏损伤的防治效果有待进一步深入探讨。
