牡荆素调节自噬与自噬流介导缺氧复氧大鼠原代心肌细胞的保护作用
2020-09-09胡景春张骏艳董六一
胡景春,唐 虹,薛 威,江 勤,张骏艳,董六一
心血管疾病已成为近年来人类死亡的最主要杀手之一,研究心血管疾病的发病机制与药物开发已成为当前热点课题。在心血管疾病中,心肌缺血再灌注损伤因其具有高发病率、高致死率等而严重影响心血管疾病患者的健康。已有文献报道[1-2],心肌缺血再灌注损伤机制复杂、牵涉途径广,如氧化应激、自噬、凋亡以及能量代谢障碍等。牡荆素是从山楂叶中提取分离的有效单体成分[3],课题组前期研究表明牡荆素具有抗氧化、抑制凋亡和保护心脑缺血等作用[4-5],但其抗缺血再灌注损伤的机制仍不明确。该研究旨在前期研究的基础上通过制备大鼠原代心肌细胞缺氧/复氧(hypoxia/reoxygenntion,H/R)模型,探讨牡荆素是否通过抑制自噬和自噬流途径介导原代心肌细胞缺氧复氧损伤的保护作用,并初步分析牡荆素潜在的抗心肌细胞缺氧复氧损伤的作用机制,为临床应用提供新思路和实验依据。
1 材料与方法
1.1 实验动物SPF级SD大鼠乳鼠(出生24 h)共30只,购自安徽医科大学省级实验动物中心,生产许可证号:SCXK(皖)2017-001。
1.2 药品与试剂牡荆素(冻干粉针剂,30 mg/瓶,批号20171215,纯度99.5%,购自合肥七星医药科技有限公司,常温保存,临用前稀释成所需浓度);DMEM/F12购自美国Gibco公司;Ⅱ型胶原酶购自美国Sigma公司;Cellmax胎牛血清购自北京赛澳美细胞技术有限公司;胰蛋白酶购自美国Gibco公司;细胞裂解液购自江苏碧云天生物技术公司;吐温-20购自美国Sigma公司;青-链霉素(双抗)购自江苏碧云天生物技术公司;磷酸盐缓冲液(phosphate buffered solution,PBS)购自北京中杉金桥有限公司;LDH试剂盒、CCK-8试剂盒和DCFH-DA试剂盒购自凯基生物科技有限公司;RIPA蛋白裂解液、BCA蛋白浓度测定试剂盒和SDS-PAGE蛋白上样缓冲液(5×)购自江苏碧云天生物技术公司;PMSF购自美国Sigma公司;SDS-PAGE凝胶配制试剂盒购自上海雅酶生物科技有限公司;预染蛋白Marker购自美国Thermo Fisher Scientific公司;PVDF膜购自美国Millipore公司;β-actin抗体购自北京中杉金桥生物技术有限公司;LC3B抗体、Beclin1抗体、P62抗体购自英国Abcam公司;辣根酶标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司;自噬双标腺病毒购自上海汉恒生物科技有限公司。
1.3 主要仪器HH-4数据恒温水浴锅购自江苏常州国华电器有限公司;BX-51型荧光正置显微镜购自日本Olympus Corporation 公司;NW10UF超纯水机购自上海康雷分析仪器有限公司;TGL-16R高速冷冻离心机购自珠海黑马医学仪器有限公司;SpectraMax190全波长酶标仪购自美国Molecular Devices 公司;制冰机购自常熟雪科电器有限公司;电泳仪和转移槽购自美国BIO-RAD 公司;JA1203A电子天平购自上海精天电子仪器有限公司;WD-9405B水平摇床购自北京市六一仪器厂; Bioshine ChemiQ4600荧光及化学发光成像系统购自上海欧翔科学仪器公司。
1.4 实验方法
1.4.1大鼠原代心肌细胞培养 取24 h内新出生的SD乳鼠10只,先将乳鼠颈部剪一道小口排出血液(防干扰后续操作);将乳鼠浸于75%的乙醇中约75 s后取出,于超净台中迅速取出乳鼠心脏置于装有D-Hank液的培养皿中,此操作在冰浴上进行;将剪下的乳鼠心脏在D-Hank液中清洗2~3次并剪去多余的组织,然后将其转移至青霉素瓶中剪碎,大小约为1 mm×1 mm×1 mm;加入适量的D-Hank液洗去残留的血液,静置弃去上清液;加入适量的混合酶,将组织块转移至15 ml的离心管中,置于37 ℃的水浴锅中水浴消化15 min;待消化结束后取出离心管,弃去上清液,加入适量的完全培养基吹打混匀,静置,将上清液转移至干净的离心管中;加入适量的D-Hank液吹打混匀后静置弃去上清液;重复上述操作步骤两次;将3次消化后得到的上清液用200目的细胞筛过滤,将过滤后的上清液置于培养皿中于5% CO237 ℃恒温培养箱中差速贴壁培养1.5 h;待培养结束后,取出培养皿,将上清液转移至培养瓶中,加入终浓度为0.1 mmol/L 5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyUridine,Brdu)溶液抑制成纤维细胞的生长,再置于 5% CO237 ℃恒温培养箱中培养,24 h后进行首次换液。
1.4.2H/R模型的建立 将细胞接种在培养瓶中待其生长至90%左右时,按照分组加入含有合适浓度药物的培养基,然后置于5% CO237 ℃恒温培养箱中培养1 h;待培养结束后取出培养瓶,弃去含药培养基,用PBS清洗1次,再加入预先配制好的缺氧液,再将其放入含95% N2和5% CO2的三气培养箱中进行缺氧5 h,缺氧时间结束后将缺氧液换成正常的完全培养基再置于 5% CO237 ℃恒温培养箱中培养1 h。
1.4.3CCK-8检测原代大鼠心肌细胞活力 用胰酶消化收集对数生长时期的细胞悬液,取合适浓度的细胞悬液加入96孔板中,每孔加入200 μl,待其长至90%左右后造模;结束后向每孔加入10 μl CCK-8溶液;将培养板在培养箱内孵育1~4 h;用酶标仪测定在450 nm处的吸光度。
1.4.4LDH检测 用胰酶消化收集对数生长时期的细胞悬液,取合适浓度的细胞悬液加入96孔板中,每孔加入200 μl,每组设置6个复孔,待其长至90%左右后造模,结束后吸取每孔上清液液进行LDH测定。
1.4.5DCFH-DA检测细胞内活性氧(reactive oxygen species,ROS)水平 用胰酶消化收集对数生长时期的细胞悬液,取合适浓度的细胞悬液加入24孔板中,每孔加入500 μl;待其长至90%左右造模,结束后加入DCFH-DA溶液,孵育0.5 h后拍照观察。
1.4.6自噬双标腺病毒转染原代心肌细胞 将生长状态良好的原代心肌细胞接种到24孔板中,并且使细胞浓度在1×105/ml左右,待其长至50%~70%时,加入mRFP-GFP-LC3,感染2 h时后将培养基换成正常的培养基继续培养,待病毒感染24 h后可以观察到GFP以及RFP的表达情况。48 h后先用药物孵育1 h后再进行H/R模型的建立,待造模结束后将细胞进行固定以及封片),最后进行拍照分析。
1.4.7Western blot检测相关蛋白表达水平 采用Western blot分别检测大鼠缺血再灌注损伤心脏中LC3BⅡ/Ⅰ、Beclin 1与P62蛋白表达的变化。用Bioshine ChemiQ 4600荧光及化学发光成像系统显影,用Image J图像分析软件分析,计算蛋白条带的灰度值。
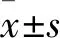
2 结果
2.1 牡荆素对大鼠原代心肌细胞活力的影响对原代心肌细胞正常培养后,观察不同浓度牡荆素(1、3、10、30、50、100、300、500 μmol/L)对其细胞活力的影响,结果显示,不同浓度的牡荆素与心肌细胞共同培养24 h后,3、10、30 μmol/L牡荆素可提高心肌细胞的活力,随着牡荆素浓度的增加心肌细胞活力降低,但与正常对照组比较差异无统计学意义,结果见图1。
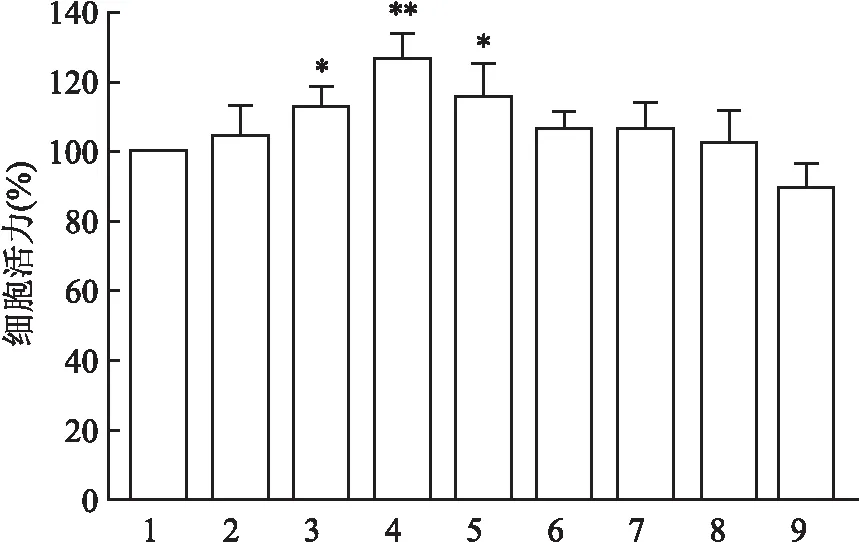
图1 牡荆素对正常培养大鼠原代心肌细胞活力的影响(n=6)
2.2 牡荆素对H/R损伤心肌细胞活力和LDH释放量的影响与正常对照组比较,H/R组原代心肌细胞活力降低为(58.02±6.71)%(F=20.91,P<0.01),LDH释放量增多为(0.81±0.06)(F=53.62,P<0.01),提示心肌细胞损伤加重;与H/R组比较,牡荆素3、10 μmol/L给药组可明显提高H/R后心肌细胞活力,抑制心肌细胞LDH的释放。结果见图2。
2.3 牡荆素对H/R损伤心肌细胞内ROS水平的影响DCFH-DA检测结果显示,与正常对照组比较,缺氧复氧诱导后H/R组心肌细胞内ROS水平明显上升,其相对荧光密度值为(3.28±0.45)(F=63.97,P<0.01);与H/R组比较,牡荆素3、10 μmol/L给药组可明显抑制H/R后心肌细胞内ROS的产生。结果见图3。
2.4 牡荆素对H/R损伤后心肌细胞自噬及自噬流的影响mRFP-GFP-LC3结果显示,与正常对照组比较,缺氧复氧诱导后H/R组心肌细胞出现明显的自噬和自噬流增强,并且心肌细胞LC3Ⅱ蛋白表达增加(F=16.11,P<0.01),LC3Ⅱ/Ⅰ比值增大,提示H/R后心肌细胞中自噬小体累积增加,自噬溶酶体随之增多;而牡荆素各剂量组可抑制H/R后心肌细胞的自噬和自噬流增强,LC3Ⅱ蛋白表达减少,LC3Ⅱ/Ⅰ比值减小,心肌细胞内自噬小体的累积受抑制。结果见图4。
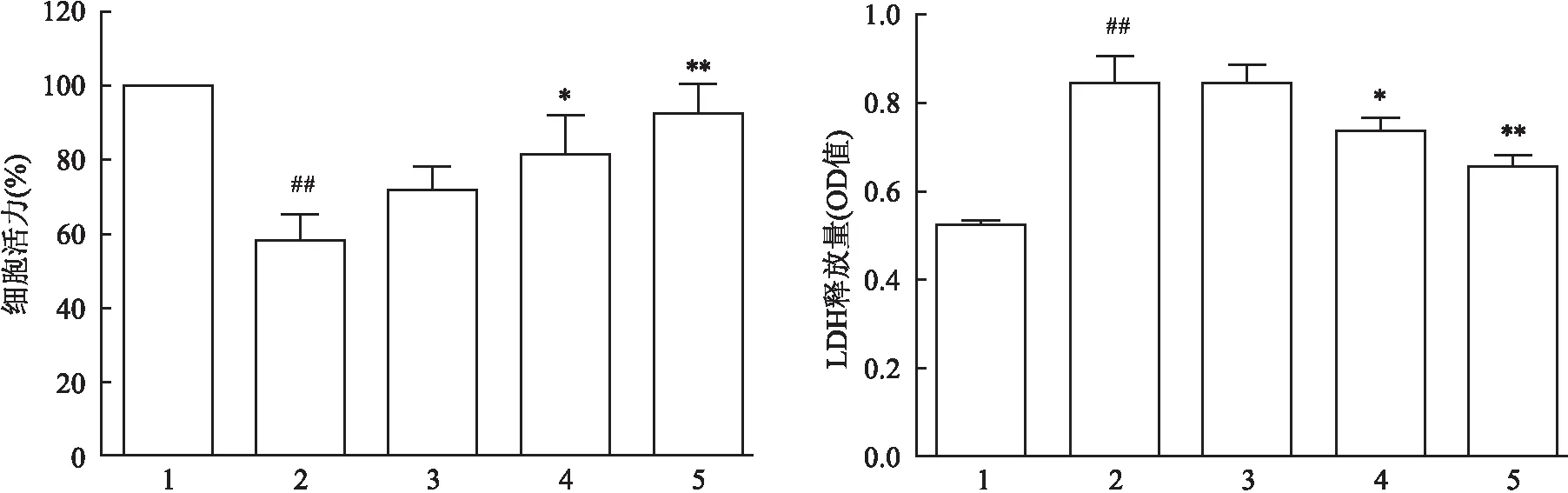
图2 牡荆素对H/R损伤心肌细胞活力和LDH释放量的影响(n=6)
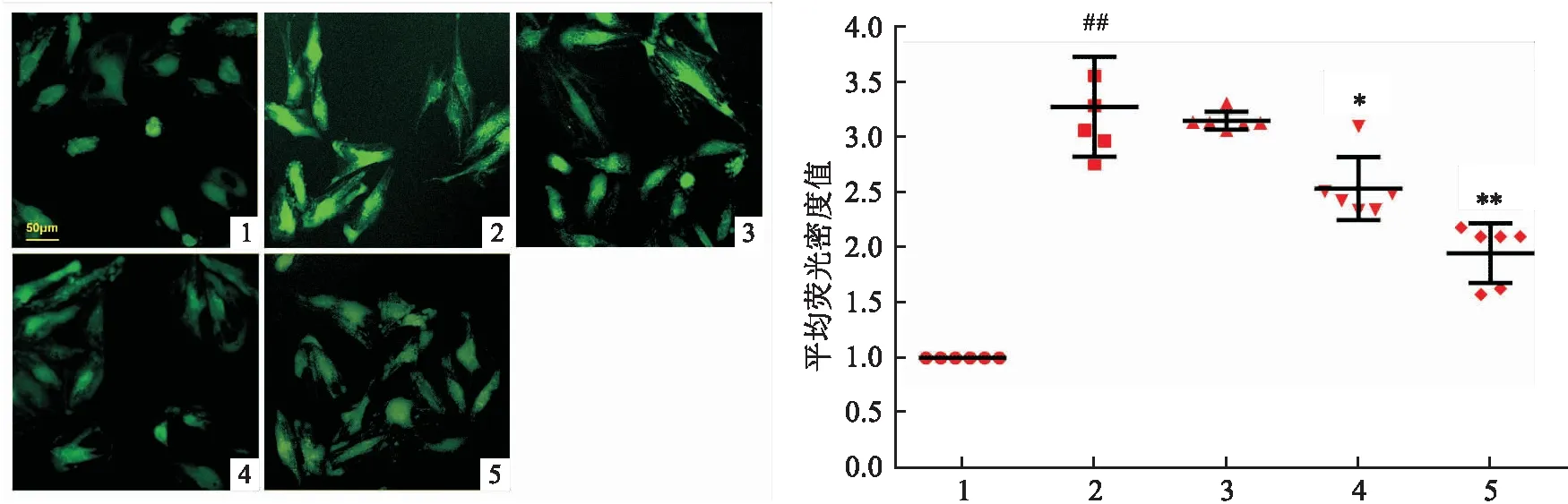
图3 牡荆素对H/R损伤心肌细胞内ROS水平的影响(n=6)
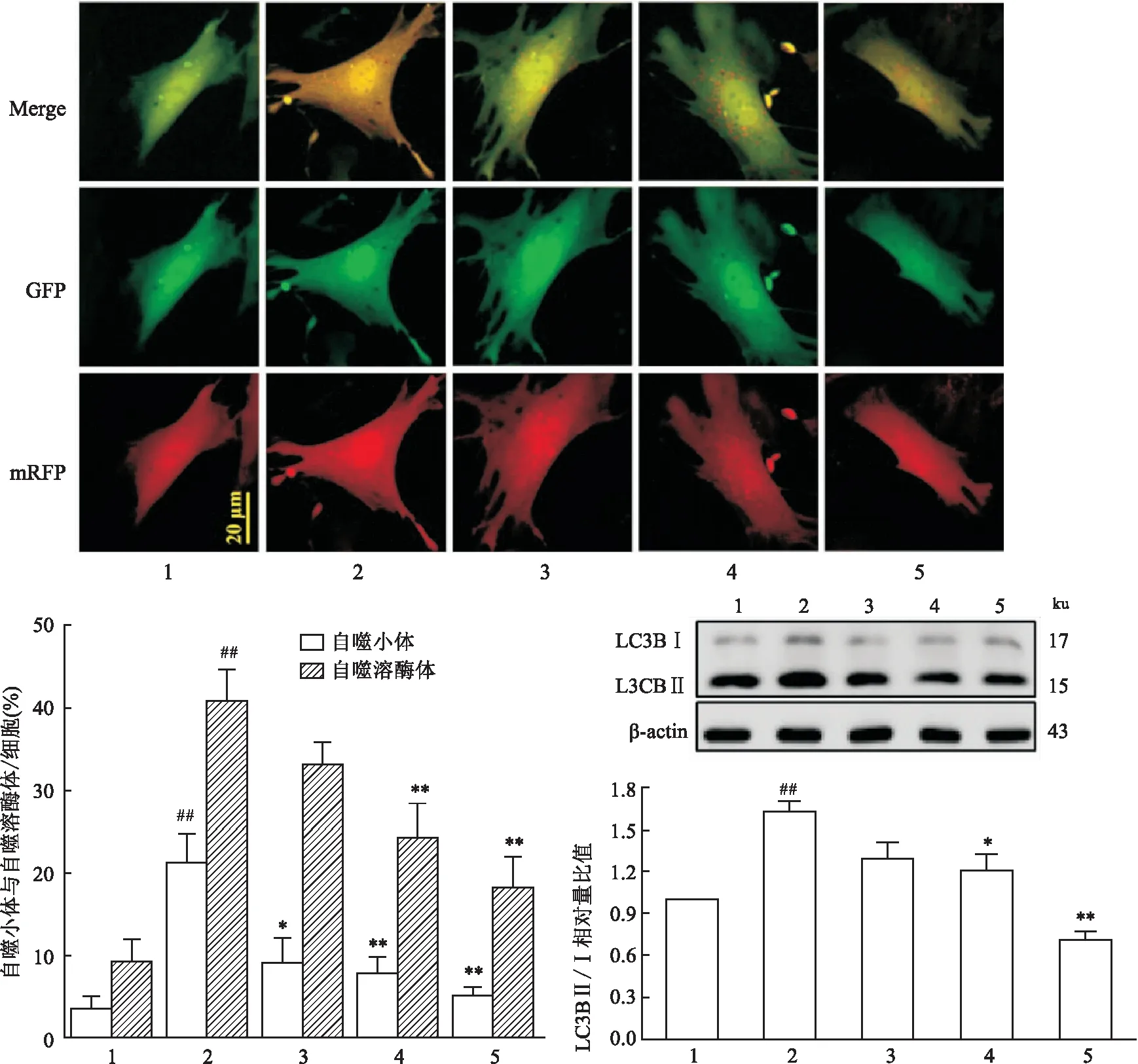
图4 牡荆素对H/R损伤后心肌细胞自噬及自噬流的影响(n=4)
2.5 牡荆素对H/R损伤后心肌细胞自噬相关蛋白表达的影响Western blot结果显示,与正常对照组比较,缺氧复氧诱导后H/R组心肌细胞中自噬蛋白Beclin 1上调(F=9.14,P<0.01)、而P62蛋白表达降低(F=10.96,P<0.01),与H/R组比较,牡荆素给药组可抑制H/R后心肌细胞Beclin 1蛋白表达,同时上调P62蛋白表达,结果见图5。
3 讨论
心血管疾病是当今严重威胁人类健康的主要杀手,其发病率和死亡率均占据首位[6]。深入研究其病理生理机制以及寻找有效的防治药物是一项紧迫的课题。牡荆素是一种天然的类黄酮化合物,是从干燥的山楂叶中提取分离的有效单体成分,具有许多重要的生物学活性[7-8]。我们课题组前期研究发现牡荆素对心脑血管具有保护作用[4-5,9],但对其保护作用机制仍不清楚。本实验在前期研究基础上进一步探讨牡荆素对心肌细胞缺氧复氧损伤的潜在作用机制。心肌缺氧复氧时内源性ROS产生过度蓄积可导致细胞脂质过氧化损伤,细胞膜和线粒体受损破坏,细胞自噬增强,进一步导致细胞凋亡、坏死。本实验结果发现,在原代心肌细胞H/R模型上,缺氧复氧诱导后心肌细胞活力下降、LDH释放增多,ROS水平升高,而牡荆素可提高缺氧复氧心肌细胞活力,抑制LDH的释放,同时可抑制心肌细胞ROS的产生。
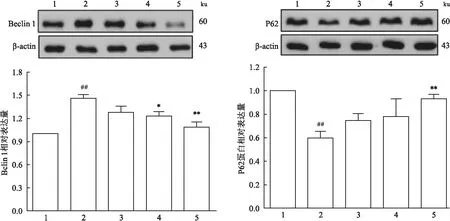
图5 牡荆素对H/R损伤后心肌细胞自噬相关蛋白表达的影响(n=4)
自噬是细胞一种自我调节胞内代谢的过程,以实现细胞自我更新、促进生存和应对轻微应激,但过度应激可导致自噬增强,自噬体累积,并产生过度自噬而引发细胞自我消化死亡[10-11]。Beclin1是自噬起始阶段的关键调控蛋白,可促进自噬体膜形成,诱导自噬发生[12-13]。LC3B是一种特殊的蛋白质,其表达增加与自噬诱导有关,是自噬体形成的重要标志。P62蛋白反映自噬活性,其可与自噬小体内膜上LC3Ⅱ形成复合物,被自噬溶酶体降解。过度自噬时P62蛋白不断被降解,自噬减弱时,P62蛋白降解减少,胞质中蓄积增多。心肌缺血再灌注损伤是一种强应激反应,可能导致心肌细胞自噬增强,自噬体累积,自噬相关蛋白Beclin1、LC3B表达增加而产生过度自噬,导致细胞死亡[14-15]。本研究结果显示,心肌细胞H/R后出现明显的自噬和自噬流增强,并且心肌细胞LC3Ⅱ蛋白表达增加,LC3Ⅱ/Ⅰ比值增大,Beclin1蛋白表达上调,P62蛋白表达降低,提示H/R后心肌细胞中自噬体累积增多,自噬溶酶体增加,加重细胞损伤。牡荆素可抑制H/R后心肌细胞的自噬和自噬流增强,LC3Ⅱ蛋白表达减少,LC3Ⅱ/Ⅰ比值减小,Beclin1蛋白表达减少,P62蛋白表达增加,从而抑制心肌细胞内自噬体的累积,减轻心肌细胞的损伤。
