猪流行性腹泻病毒电化学发光免疫传感器研制
2020-09-08李晓彤王艳春张晓蕾金文杰杨功俊
李晓彤, 王艳春, 高 叶, 张晓蕾, 丁 娅, 金文杰*, 杨功俊*
(1. 中国药科大学药学院, 南京 211198; 2. 扬州大学兽医学院, 江苏 扬州 225002)
猪流行性腹泻是一种以呕吐、腹泻和脱水为主要症状的常见猪肠道性疾病.猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)是引起猪病毒性腹泻的常见病原之一.自2010年以来, 猪流行性腹泻病的暴发造成了巨大的经济损失,因此,对PEDV的定期监测具有重大意义[1].目前猪腹泻病毒的常用检测方法有酶联免疫法(enzyme-linked immunosorbent assay, ELISA)[2],逆转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)[3], 逆转录环介导等温扩增(reverse transcription-loop mediated isothermal amplification, RT-LAMP)[4]和免疫层析法(immunochromatography assay, ICA)[5]等.电化学发光(electrochemiluminescence, ECL)技术由于快速、灵敏等优点在免疫分析中的应用日益广泛[6].其中, 无标记电化学发光免疫传感器具有操作步骤少, 时间短等优点,为蛋白质检测提供更为简便的检测方法[7].半导体纳米材料以其独特的量子尺寸效应、表面效应和介电性质等优点引起了众多研究者的关注.目前已有许多半导体纳米材料如CdS[8], CdSe[9]和Fe2O3[10]等成功合成并应用于ECL免疫传感器的研究, 其中硫化镉纳米晶体(CdS NCs)是电化学发光免疫中最常用的纳米材料之一[11-12].本文采用氨水处理CdS纳米晶体(CdS-NH3NCs)制备无标记型电化学发光免疫传感器,并成功用于实际样品中PEDV的检测.
1 实验部分
1.1 仪器与试剂
电化学实验在CHI 660E型电化学工作站(上海辰华仪器公司)进行;电化学发光实验在MPI-E型电化学发光分析仪(西安瑞迈分析仪器有限责任公司)进行, 实验均采用三电极体系:玻碳电极(GCE, 直径3 mm)及其修饰电极为工作电极,铂丝电极为对电极,饱和甘汞电极(SCE)为参比电极.透射电子显微镜Tecnai 12 G2F30 S-Twin(FEI公司, 美国)对CdS-NH3进行表征和元素分析.
PEDV抗原和PEDV-2C11抗体由扬州大学兽医学院提供; 五水氯化镉、硫化钠(上海阿拉丁有限公司); 氨水(南京化学试剂股份有限公司).其他试剂均为分析纯,所有溶液均由二次蒸馏水配制.
1.2 硫化镉的制备
硫化镉纳米晶体按照文献[13]报道的方法进行制备.步骤如下: 将0.11 g五水氯化镉溶于60 mL 70 ℃二次蒸馏水中搅拌30 min, 然后加入0.59 g硫化钠, 得到淡黄色溶液.在回流条件下继续搅拌3 h, 冷却至室温.将所得产物用二次蒸馏水和乙醇交替洗涤3次, 离心收集得到CdS NCs并分散于10 mL的二次蒸馏水中备用.
1.3 硫化镉-氨水复合材料的制备
硫化镉-氨水复合物按照文献[14]报道的方法进行制备.步骤如下: 将1 mL 25%氨水与10 mL新制CdS NCs溶液混合并稀释至30 mL, 在70 ℃下回流并剧烈搅拌3 h后, 成功制得CdS-NH3NCs.
1.4 修饰电极的制备
实验前, 用0.05 μm的Al2O3悬浮液将玻碳电极抛光成镜面, 并用硝酸(φ=50%)溶液、无水乙醇、超纯水依次超声清洗.将10 μL CdS-NH3溶液滴涂于电极表面, 并在空气中自然晾干(记为CdS-NH3/GCE).然后将CdS-NH3/GCE置于φ=1%戊二醛(GA)溶液中浸泡20 min, 用0.1 mol·L-1PBS(pH=7.0)洗去未结合的戊二醛(记为GA/CdS-NH3/GCE).随后, 将10 μL一定浓度的PEDV-2C11抗体溶液滴于电极表面并置于4 ℃下孵育12 h(记为PEDV-2C11/GA/CdS-NH3/GCE).用0.1 mol·L-1PBS(pH=7.0)洗去未结合的抗体分子, 并用10 g·L-1牛血清白蛋白溶液(BSA)封闭电极表面的非特异性吸附位点(记为BSA/PEDV-2C11/GA/CdS-NH3/GCE).电化学发光免疫传感器制备过程见图1.
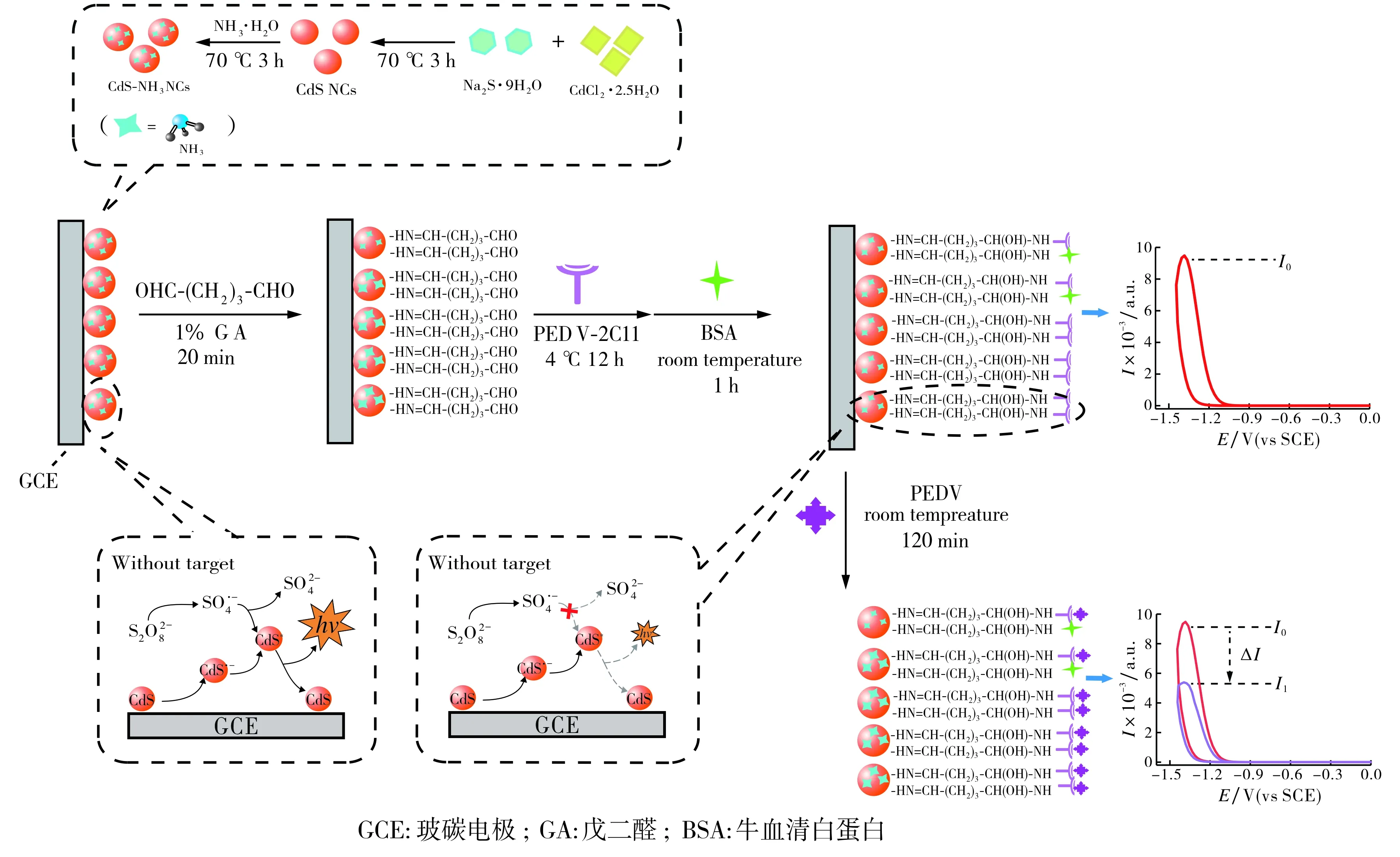
图1 CdS-NH3的合成过程及免疫传感器的制备Fig.1 The synthesis procedure of the CdS-NH3 and the schematic illustration of the electrochemiluminescent immunosensor
1.5 猪腹泻病毒的电化学发光测定方法
将制得的免疫传感器先与不同浓度PEDV室温下孵育一定时间, 然后用0.1 mol·L-1PBS(pH=7.0)充分清洗以除去非特异性吸附的PEDV.将传感器置于含0.12 mol·L-1Na2S2O8的0.1 mol·L-1PBS(pH=7.4)溶液中进行电化学发光检测.
1.6 实际样品制备
加标样品按照文献[15]报道的方法进行制备.称取3份0.5 g猪粪样品分别置于离心管中并加入4 mL 0.1 mol·L-1PBS(pH=7.4).然后,以已知的PEDV浓度水平加入PEDV样品, 使其浓度分别为1.65,1.65×102, 1.65×104TCID50·mL-1.将所得混合物旋涡10 min,然后以10 000 r·min-1离心15 min, 静置15 min后收集上层清液, 4 ℃下保存备用.
2 结果与讨论
2.1 CdS-NH3纳米复合材料的表征
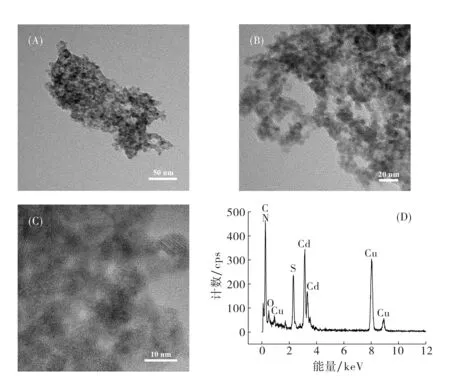
图2 CdS-NH3的HRTEM图(A,B,C)及EDX图谱(D) Fig.2 HRTEM image (A, B and C) and EDX spectrum (D) of CdS-NH3
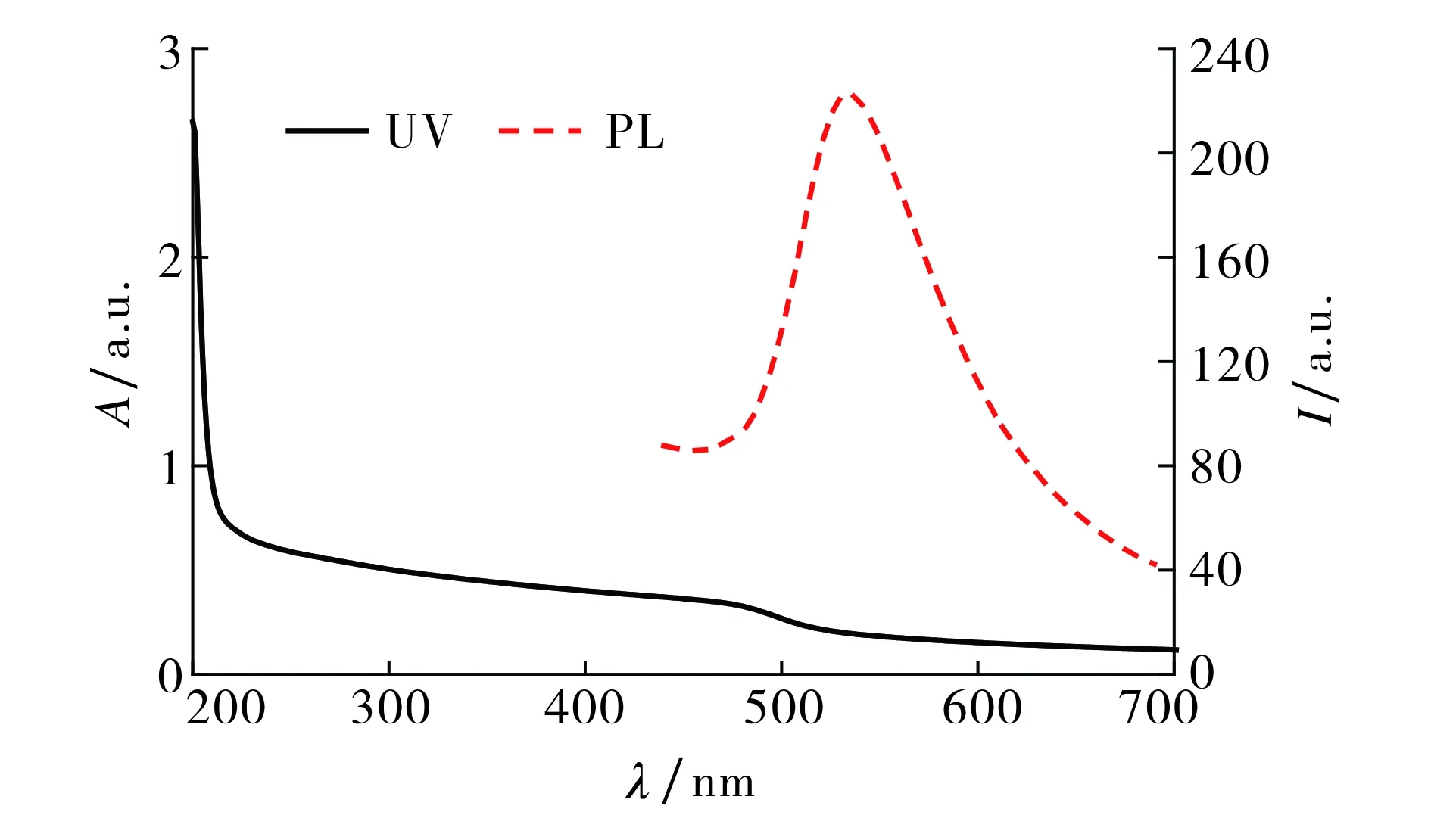
图3 CdS-NH3的紫外-可见吸收光谱和荧光光谱(λex=380 nm)Fig.3 UV-vis absorption spectra and PL spectra of CdS-NH3
采用高分辨透射电镜(HRTEM)对制备的CdS-NH3NCs的形貌进行了表征,结果如图2(A~C)所示.由电镜图可见,制备得到了粒径约为5~10 nm球形结构的CdS-NH3NCs.图2(D)是CdS-NH3NCs的元素分析结果.结果表明该材料中含有Cd、S、N、C和O等几种元素.
图3为CdS-NH3的紫外可见吸收光谱和荧光光谱.紫外可见吸收光谱在480 nm处吸收峰较宽, 说明样品中纳米粒子的粒径不是很均匀.在380 nm激发波长下, 荧光光谱在544 nm处出现一个较大的峰, 表明合成的纳米颗粒结晶度好,表面缺陷少[11].
2.2 修饰电极的电化学表征
电化学阻抗谱可用于表征免疫传感器的制备过程.图4(A)给出了不同电极在含0.1 mol·L-1KCl的5.0 mmol·L-1[Fe(CN)6]3-/4-溶液中的阻抗图谱.与裸电极相比(曲线a), CdS-NH3/GCE的电化学反应阻抗(Ret)明显增加(曲线b), 这是由于CdS-NH3纳米粒子阻碍了电子向电极表面的转移.PEDV-2C11抗体和BSA分别固定在修饰电极表面后,Ret进一步增加(曲线c,d), 其原因是抗体和BSA作为非导电生物分子进一步阻碍了电子转移.最后, PEDV与电极表面的PEDV-2C11发生免疫反应后,Ret明显增加(曲线e).图4(B)显示了不同修饰电极的发光强度. 结果表明, CdS-NH3的ECL发光强度也随着层层修饰后发光强度逐渐降低.综上所述, 采用CdS-NH3NCs和固定方法可成功制备电化学发光免疫传感器.
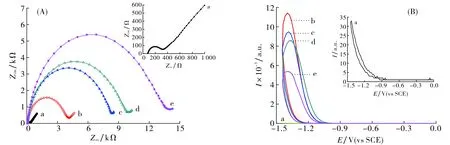
a. GCE; b. CdS-NH3/GCE; c. PEDV-2C11/GA/CdS-NH3/GCE; d. BSA/PEDV-2C11/GA/CdS-NH3/GCE; e. PEDV/BSA/PEDV-2C11/GA/CdS-NH3/GCE图4 (A)不同修饰电极的阻抗交流图谱; (B) 不同修饰电极的发光图谱Fig.4 (A) Nyquist plot of the A.C. impendence of immune process; (B) ECL intensity of immune process at different modified electrodes
2.3 条件优化
图5(A)为不同浓度Na2S2O8对CdS-NH3/GCE的发光强度的影响.结果显示, 当Na2S2O8的浓度达到0.10 mol·L-1时, ECL强度基本稳定, 故本文选择Na2S2O8浓度为0.12 mol·L-1.
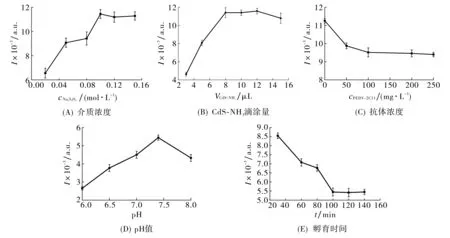
图5 (A) 介质浓度, (B) CdS-NH3滴涂量, (C) 抗体浓度, (D) pH值, (E) 孵育时间对免疫传感器发光强度的影响Fig.5 The effect of (A) medium concentration, (B) dropping amount of CdS-NH3, (C) concentration of antibody, (D) pH and (E) incubation time on the ECL intensity of the developed immunosensor
图5(B)是CdS-NH3滴涂量对电化学发光强度的影响.当滴涂的CdS-NH3溶液体积超过8 μL时, ECL强度基本稳定, 故选择CdS-NH3的滴涂量为10 μL.
图5(C)是抗体浓度对电化学发光强度的影响.由图5(C)可以看出,当抗体浓度到达0.10 g·L-1时, ECL降低的强度基本保持不变, 这是由于免疫传感器表面上用于抗原反应的活性位点的限制使其基本饱和, 故选择抗体的浓度为0.20 g·L-1.
图5(D)给出了在825 TCID50·mL-1的PEDV浓度下, ECL免疫传感器浸入含0.12 mol·L-1Na2S2O8不同pH值的PBS溶液中电化学发光强度的变化.当pH为7.4时发光强度变化达到最大, 因此选择介质的pH 值为7.4.
为了选择最佳的免疫反应时间, 将修饰电极孵育于825 TCID50·mL-1PEDV中, 观察ECL强度变化, 结果如图5(E)所示.由图5(E)可以看出, 当孵育时间达到100 min时, ECL强度的降低基本保持不变, 因此选择120 min作为免疫反应的最佳孵育时间.
2.4 线性范围和检测限
在最佳检测条件下记录了不同PEDV浓度下的ECL响应(见图6(A)).电化学发光强度的变化与PEDV浓度在1.65~1.65×105TCID50·mL-1范围内呈线性关系(见图6(B)), 线性回归方程为ΔI=1 070.2lg(c/(TCID50·mL-1))-51.39, 其中ΔI为空白溶液的ECL强度(I0)与特定浓度PEDV下ECL强度(I1)的差值, 检测限(LOD)为1.65 TCID50·mL-1.与先前文献报道的分析方法相比[13],该方法具有更低的检测限.
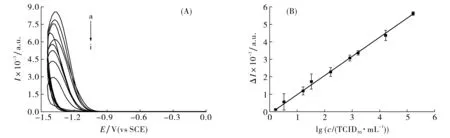
曲线a~i cPEDV/(TCID50·mL-1): 1.65, 3.30, 16.5, 33.0, 1.65×102, 8.25×102, 1.65×103, 1.65×104,1.65×105图6 (A) 不同浓度的PEDV的电化学发光强度曲线; (B) 发光强度与浓度的线性关系Fig.6 (A) Electrochemiluminescence intensity of the immunosensor incubated with different concentrations of PEDV,(B) calibration curve
2.5 电极的重复性、稳定性和选择性研究
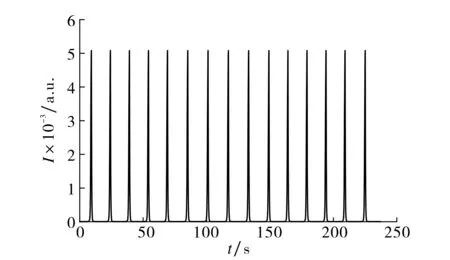
图7 在1.65×103 TCID50·mL-1浓度下连续扫描的电化学发光强度Fig.7 Continuous cyclic potential scans of the proposed immunosensor at cPEDV=1.65×103 TCID50·mL-1
图7给出了在最佳实验条件下含1.65×103TCID50·mL-1和0.1 mol·L-1Na2S2O8的0.1 mol·L-1PBS(pH=7.4)中连续扫描15个循环的发光响应,可见免疫传感器的发光强度基本稳定.发光强度的相对标准偏差(RSD)为5.2%;采用相同的方法制备5支免疫传感器,其发光强度的RSD为5.2%,表明该传感器具有良好的重复性和重现性.将免疫传感器在4 ℃下放置2周后, 发光强度为初始值的91%, 说明该传感器具有良好的稳定性.
为了评价ECL免疫传感器的特异性,将其与一些可能的干扰蛋白(如沙门氏菌,空肠弯曲杆菌和大肠杆菌)共同孵育,检测其发光强度,并与仅含PEDV的发光强度进行比较,得到干扰蛋白引起的发光强度变化小于5%, 说明该免疫传感器具有良好的选择性.
3 实际样品测定
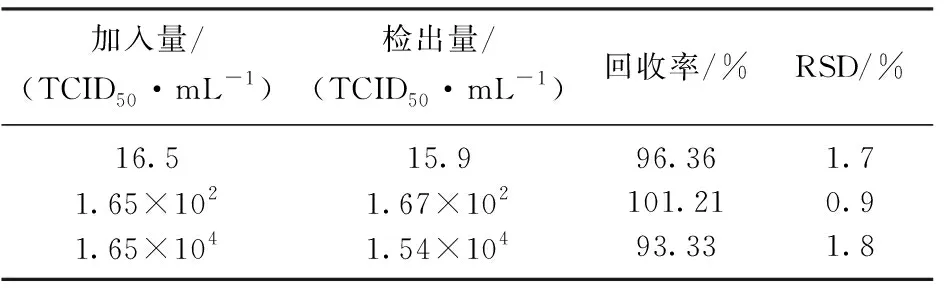
表1 样品中PEDV回收率的测定
按照1.6的方法对样品进行前处理后, 在最佳实验条件下,对样品溶液重复进行6次测定,结果如表1所示.从表1可以看出,该方法的回收率在93.33%至101.21%之间,相对标准偏差(RSD)小于2.0%, 表明该方法具有良好的准确性,有望应用于实际样品中PEDV的检测.
