多种动物源A型产气荚膜梭菌的分离鉴定及生物学特性
2020-09-07吴允正韩春生戴益民王林康王婧祺张锦华
吴允正,韩春生,戴益民,2,王林康,王婧祺,张锦华,2*
(1.江西农业大学 动物科学技术学院,江西 南昌 330045;2.江西省畜禽疫病诊断与防控重点实验室,江西 南昌 330045)
【研究意义】产气荚膜梭菌(Clostridium perfringens,Cp)是一种革兰氏阳性产芽胞的厌氧性梭菌,广泛存在于自然界的土壤、水源及人和动物肠道中[1]。该菌可引起人类及动物多种疾病,从坏死性肠炎到危及生命的气性坏疽。Cp的毒力与其产生的毒素有关,根据产生的致死性毒素α,β,ε和ι,通常将Cp分为A、B、C、D、E 五型[2]。A-E 型菌株均可产生α 毒素,而β 毒素存在于B 型和C 型中,ε 毒素由B 型和D 型产生,ι 毒素仅由E 型产生[3]。其他毒素基因,如肠毒素,与特定菌株无关,但与整体毒力有关,且在不同的菌株之间表现不同[4]。近来有学者提出新的分型方案,即增加了F型(α、cpe)和G 型(α、NetB)[5]。A 型Cp(CpA)能引起多种肠道腹泻性疾病:人的食物中毒和传染性腹泻,羊、牛、马、猪、犬等动物的肠毒血症,禽坏死性肠炎[6]。【前人研究进展】Cp也同样存在于健康动物的肠道,其中CpA 是分布最广泛的型[7]。α 毒素为其主要致病因子,α 毒素的本质为磷脂酶C,它具有细胞毒性、溶血活性、致死性、皮肤坏死性、血小板聚集和增加血管渗透性等多种特性[8-9]。CpA 除产生对畜禽及人有致病性的α 毒素外,有些菌株还产生β2毒素和肠毒素。β2毒素由cpb2基因编码,是Cp产生的另一种致死性毒素[10]。Waters等[11]对猪胃肠道所分离的Cp菌株携带cpb2基因的分析结果表明,β2毒素与猪腹泻和肠黏膜出血显著相关。cpb2基因分为典型和非典型2种,与最初鉴定的猪源cpb2高度同源(一般96%以上)的基因定义为典型cpb2基因,而一些同源性较低的cpb2基因(一般为60%~70%)为非典型cpb2基因[12]。猪源CpA通常携带的是典型的cpb2 基因,有研究表明,携带典型cpb2 基因的CpA 菌株与猪、马、牛、狗等多种动物的肠道疾病密切相关[13]。【本研究切入点】韩春生等[14]通过利用荧光定量PCR 技术,测定了江西地区仔猪粪便总DNA 中的CpA菌数,比较健康与腹泻仔猪肠道内Cp菌数的差异,从而推断是否由携带毒素基因的改变或菌数差异导致疾病发生。在前期的研究发现,江西地区猪源CpAcpb2 基因携带率较其它地区所报道高,达到99.5%[15],因而,对该地区其它动物源CpA 进行相关的研究。【拟解决的关键问题】本试验在猪源CpA 研究的基础上,通过选择性培养方法分离和多重PCR 鉴定获得本地区其它动物源CpA,分别对不同动物源CpA 菌株的培养形态和cpb2基因携带、溶血特性情况进行分析比较,以期为研究CpA 在动物体内致病机制差异及CpA菌株地区特异性提供参考。
1 材料与方法
1.1 样品来源与菌株
猪源CpA 菌株为本实验室分离保存,并进行了全基因测序的JXJA17 菌株(携带cpb2 基因,Genbank登录号:CP028149.1);羊源样品采集于南昌市某养殖户健康波尔羊新鲜粪便样;鸡源样品采集于南昌市某养殖户健康肉鸡的新鲜粪便样;牛源样品采集于南昌市某农户饲养的健康青年牛的新鲜粪便样;犬源样品采集于南昌市某养殖基地健康犬的新鲜粪便样;鱼源样品采集于南昌市某水产养殖户饲养健康鱼的新鲜粪便样。多重PCR参考菌株购自中国兽医药品鉴察所,A型产气荚膜梭菌(CVCC2020)、B型产气荚膜梭菌(CVCC55)、C型产气荚膜梭菌(CVCC2041)、D型产气荚膜梭菌(CVCC82)。
1.2 主要试剂
胰胨-亚硫酸盐-环丝氨酸琼脂培养基(TSC)、液体硫乙醇酸盐培养基(FTG)、D-环丝氨酸、含铁牛奶培养基均购自青岛海博生物技术有限公司,DNA 聚合酶、dNTP Mixture、DL2000 DNA marker、PMD18-T、SolutionI 购自TaKaRa 公司,TOP10 感受态细胞购自北京天根生化科技有限公司,细菌基因组DNA 提取试剂盒、胶回收纯化试剂盒均购自上海生工生物工程股份有限公司。
1.3 方法
1.3.1 细菌的分离纯化及生化鉴定 参照猪源CpA 分离的方法,分别取少量牛、羊、鸡、犬、鱼粪便样品于2 mL的EP管(含1 mL生理盐水)中,混匀,瞬离10 s后,取100µL上清至4%D-环丝氨酸FTG中,45 ℃恒温培养10 h后接种于TSC固体培养基中,挑取灰白色、扁平圆形菌落进行革兰氏染色,镜检观察形态。参照《常见细菌系统鉴定手册》[16]和《伯杰细菌鉴定手册》[17]的方法,利用生化微量反应管对分离菌株进行生化鉴定,将分离菌株分别接种于相应的微量生化鉴定管中,置于37 ℃恒温培养箱,24 h 后观察记录结果;并将分离菌株接种于含铁牛乳培养基中,10 h后观察反应结果。
1.3.2 分离菌株的16S rDNA 鉴定 按照磁珠法细菌基因组DNA 标准抽提步骤,提取分离菌株及标准菌株的DNA。参照文献[18],采用细菌16S rDNA 通用引物(由上海生工生物工程技术服务有限公司合成)进行PCR 扩增后,1%琼脂糖凝胶电泳30 min,并回收目的条带,连接至PMD18-T,转化后,挑取阳性克隆由上海生物工程股份有限公司测序。PCR 体系:采用25 µL 反应体系,混合引物2 µL(上、下游引物各1 µL),蒸馏水8 µL,DNA 模板2.5 µL,Mix DNA 聚合酶12.5 µL;PCR 程序:95 ℃预变性5 min,94 ℃变性1 min,58 ℃退火1 min,72 ℃延伸2 min,进行38个循环,最后72 ℃延伸10 min。
1.3.3 分离菌株多重PCR 毒素基因分型及β2 毒素基因检测 参照文献[19-20],采用多重PCR 的方法对分离到的Cp 菌进行毒素分型,多重PCR 体系为25 µL 反应体系:10×PCR buffer 2.5 µL,1.25 µmol/L dNTP 1 µL,混合引物2 µL(α、β、ε、ι 4 对毒素基因特异性引物各0.5 µL,引物序列见表1),蒸馏水16.75 µL,DNA 模板2.5 µL,Taq DNA 聚合酶0.25 µL;反应条件:95 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,进行38 个循环,最后72 ℃延伸10 min。取PCR 扩增产物10 µL,于15 g/L 琼脂糖凝胶中电泳。取PCR 扩增产物10 µL,于琼脂糖凝胶中电泳并参照DL2000 DNA Marker观察并分析结果。然后采用β2 毒素基因引物(表1)对分离到的6 株CpA 进行β2 毒素基因检测,PCR产物经15 g/L 琼脂糖凝胶电泳分析结果。
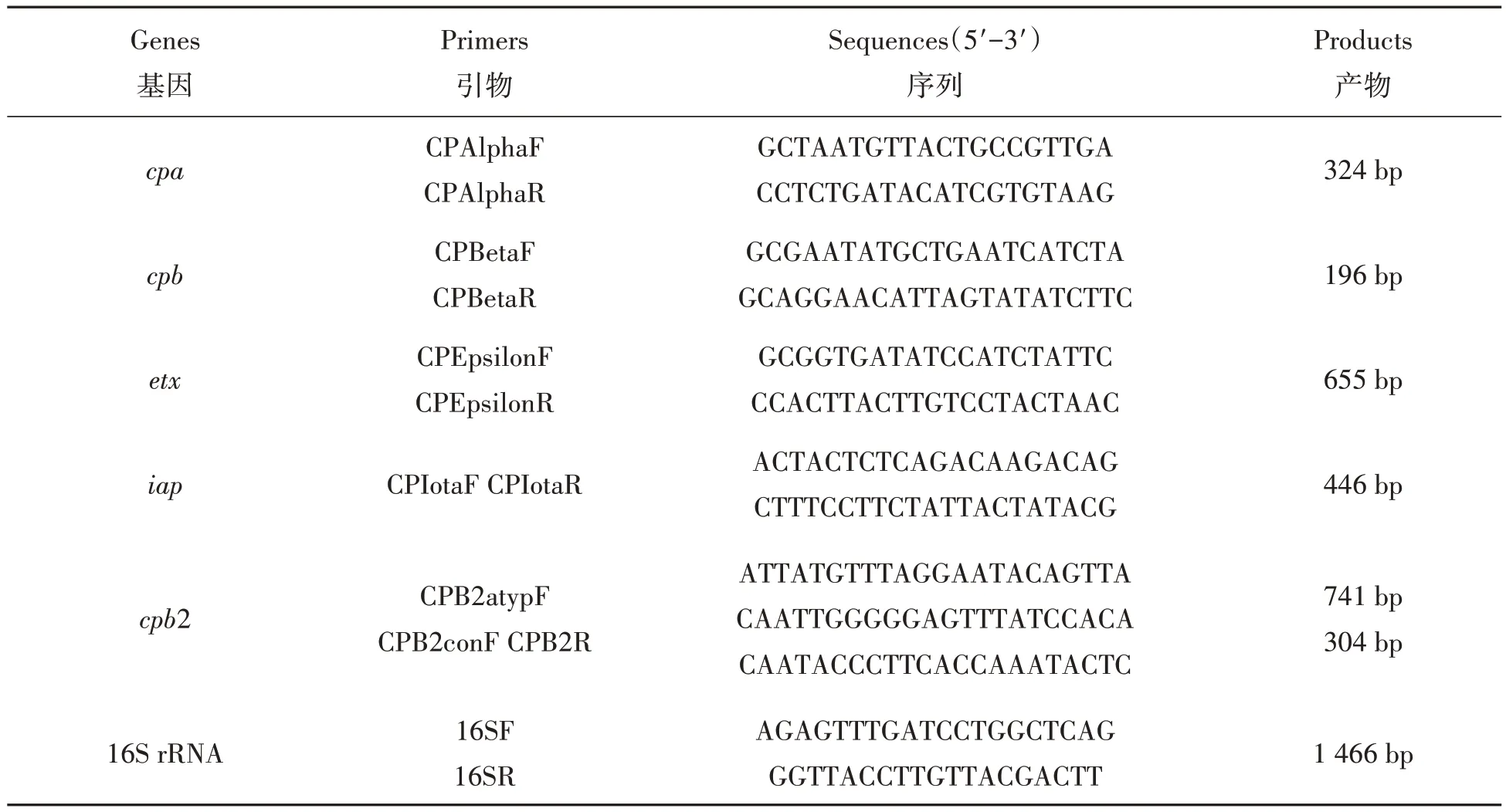
表1 PCR扩增引物序列Tab.1 PCR amplified primer sequence
1.3.4 多种动物源CpA 同源性分析 多种动物源CpA 菌株各挑选1株,共6株,将测得的16S rDNA 序列用DNAStar 分析软件进行数据处理,运用NCBI(http://www.ncbi.nlm.nih.gov)中Blast工具软件在GenBank中搜索同源DNA 序列并进行比较分析,利用MEGA X 软件中的邻位加入法(neighbor-joining,NJ)构建系统发育树,根据同源性大小和系统发育关系,确定待测菌株的种类归属。
1.3.5 多种动物源CpA 菌株溶血试验 挑取6 株不同动物源CpA 进行溶血试验,采用点种法,即分别吸取过夜培养的菌液2.5µL 点种至血平板,放置45 ℃恒温箱培养,每2 h 观察记录各菌株溶血现象及在血平板上的溶血圈直径,直至溶血圈直径达到最大。
2 结果与分析
2.1 菌株的分离纯化及16S rDNA分子鉴定结果
收集到的牛、羊、鸡、犬、鱼粪便样品,在TSC平板上培养均可形成扁平灰白色、周围伴有浅白色浊环的圆形菌落(图1A),细菌纯化后经革兰氏染色镜检,可见菌体粗短、两端钝圆的革兰氏阳性直杆菌,无鞭毛(图1B)。所分离到的不同动物源的分离株均能发酵葡萄糖、麦芽糖、乳糖和蔗糖,产酸产气,不发酵甘露醇、液化明胶,产生硫化氢,吲哚阴性;分离菌株在含铁牛乳中呈暴烈发酵(图1C),除菌落特征和菌体形态与猪源CpA略有差别外,均符合Cp的生物特征。
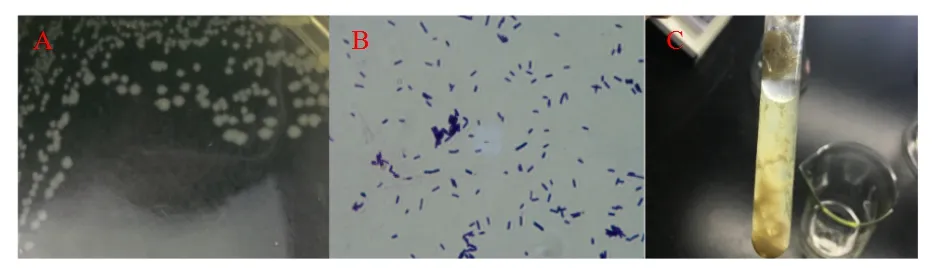
图1 Cp在TSC培养的菌落形态(A)、革兰氏染色(×1 000)(B)与“爆裂发酵”现象(C)Fig.1 Results of individual morphological characteristics medium of Clostridium perfringensin TSC(A),Gram-stained(×1 000)(B)and the phenomenon of“burst fermentation”(C)
分别挑选来源于不同动物源分离菌株(将羊源、鸡源、猪源、牛源、鱼源、犬源分离菌株分别命名为C1、C2、C3、C4、C5、C6)提取DNA,利用16S rDNA 引物经PCR 扩增后均获得预期大小的片段,约为1 500 bp。通过对各分离菌株的16S rDNA 序列的BLAST 在线比对,各菌株与Clostridium perfringens(Gen Bank 登录号为CP028149.1、CP010993.1、FJ215334.1等)同源性达98%~99%,进而确定各分离菌株为Cp。
2.2 分离菌株多重PCR毒素分型及CpA同源性分析
通过与参考标准菌株比较,多重PCR 毒素基因分型结果显示:各动物源均分离到了CpA(图2)。用MEGAX软件构建的CpA种内系统发育树(图3)显示,猪源CpA、羊源CpA、狗源CpA、牛源CpA、鸡源CpA的序列聚集在同一个分支上;而鱼源CpA序列处于另一分支上,与其他动物源CpA亲源关系较远。
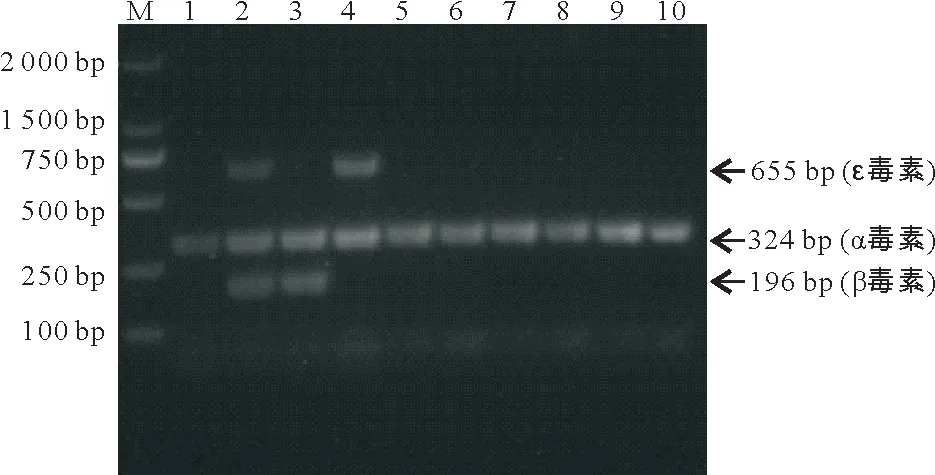
图2 多重PCR分型结果Fig.2 Results of multiple PCR typing
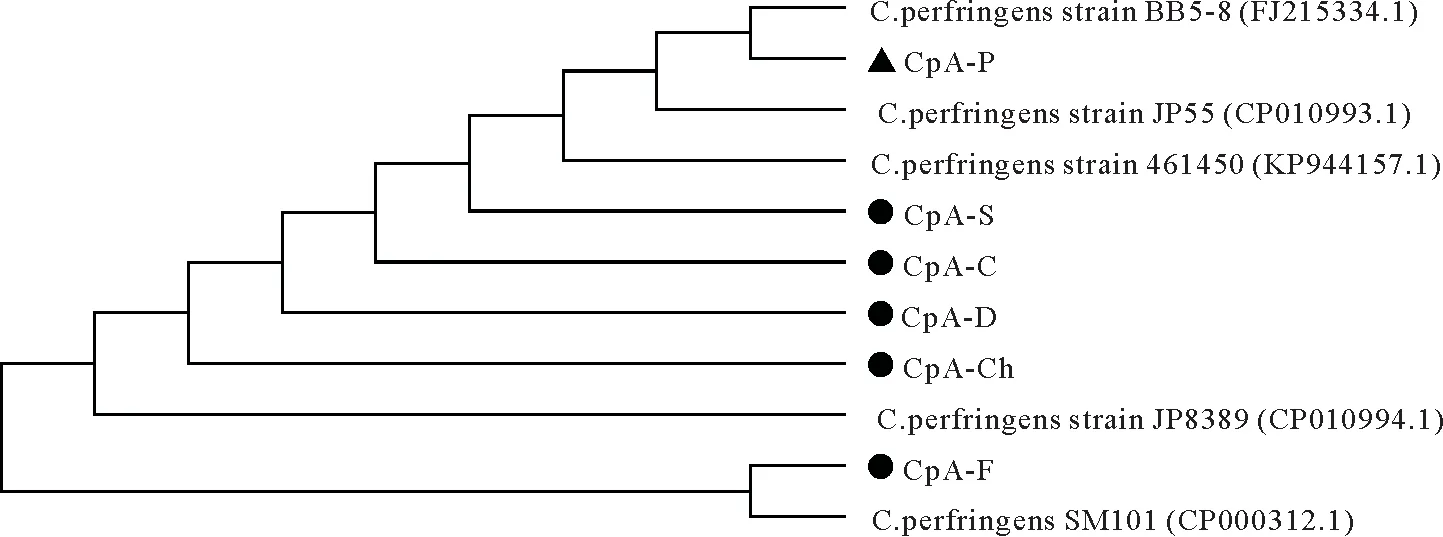
图3 基于16S rDNA序列建立的系统发育树Fig.3 Phylogenetic tree of the isolated strains based on 16S rDNA gene nucleotide sequences
2.3 多种动物源CpA的β2毒素基因检测结果
将本试验分离到的羊源、鸡源、牛源、鱼源、犬源CpA分别暂命名为CpA-S、CpA-Ch、CpA-C、CpA-F、CpA-D,猪源JXJA17 菌株命名为CpA-P。除CpA-D 外,其中5 株CpA 携带β2 毒素基因;携带β2 毒素基因的CpA 菌株中,猪源(CpA-P)、牛源(CpA-C)、鱼源(CpA-F)的CpA 携带典型的β2 毒素基因,分离自羊源(CpA-S)、鸡源(CpA-Ch)的CpA携带非典型的β2毒素基因(图4)。
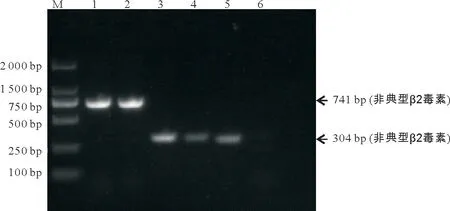
图4 β2毒素基因检测结果Fig.4 β2 toxin gene detection
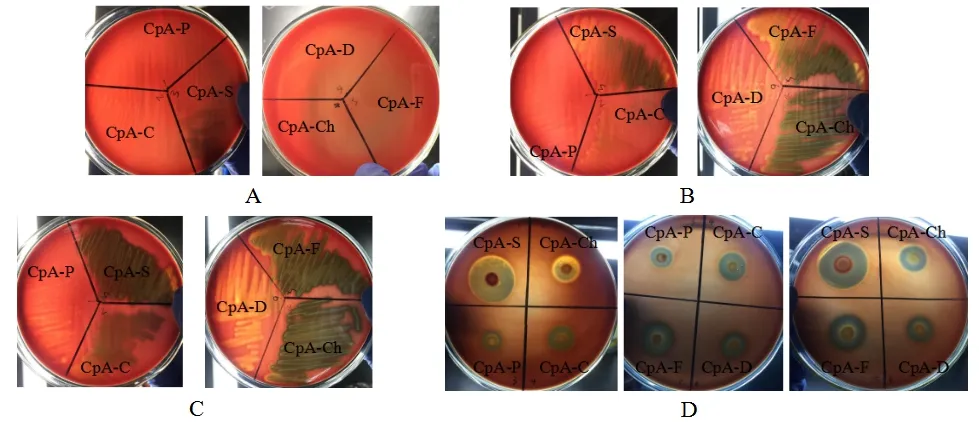
图5 各CpA分离株溶血现象Fig.5 Results of hemolysis of the isolates
2.4 多种动物源CpA溶血试验结果
6株CpA在血平板上培养4 h后,CpA-S(羊源)开始出现明显的溶血现象(图5A);培养5 h后,CpA-C(牛源)、CpA-Ch(鸡源)、CpA-F(鱼源)、CpA-D(犬源)在血平板上出现溶血现象(图5B),CpA-P 在血平板培养6 h后,开始出现溶血现象(图5C)。6株CpA 在血平板上培养24 h后,溶血圈直径均达最大,继续培养无变化,CpA-S 达30 mm,CpA-Ch、CpA-C、CpA-F 溶血圈直平均径均为20 mm,CpA-D 溶血圈平均直径为16 mm,CpA-P溶血圈平均直径为14 mm(图5D)。
3 讨论
CpA 是畜禽肠毒血症、坏死性肠炎的主要病原菌之一,对我国养殖业的发展带来了一定的危害[21]。本研究团队[15]前期研究也发现CpA 在仔猪肠炎致病过程中起着一定的作用,而CpA 又正常存在于健康动物的肠道,且江西地区健康和肠炎的仔猪肠道CpA 分离率和β2 毒素基因携带率均较高,其他动物未有报道。本试验参照猪源CpA研究方法,应用了选择培养、革兰氏染色镜检、“爆裂发酵试验”、16S rRNA基因测序和多重PCR 等方法,从其它5 种健康动物粪便样品中均分离到了CpA,说明CpA 广泛存在于健康动物的肠道中,其对动物健康和公共卫生的影响值得进一步关注。
CpA 在不同的动物体内产毒不同,致病强度也不同。CpA 对宿主健康的影响除与α 毒素相关外,β2毒素也起着非常重要的作用。本试验对江西南昌周边地区不同动物源6 株CpA 进行了cpb2 基因的检测,有5 株含有cpb2 基因,高于Álvarez 等[22]报道的cpb2 基因检出率,在一定程度上说明该地区其它动物源cpb2携带率也和猪源cpb2一样较高。Tolooe等[23]检测健康鸡源CpA携带cpb2基因的比例为97.7%,NE鸡源的CpA 菌株携带cpb2 基因的比例为94.4%;Chon 等[24]在腹泻犬源CpA 中检测出的cpb2 基因携带率(83.9%)明显高于健康犬源CpA 的cpb2 基因携带率(61.9%),本试验在健康犬源CpA 中未检测出cpb2 基因;在牛源CpA 中检测到典型cpb2基因,相比于德艳艳等[13]报道的携带非典型cpb2基因的牛源CpA 有所不同。本试验未对其它动物源CpA 和cpb2 携带率进行统计,但从随机取样的CpA 分离和cpb2 的检测结果从一定程度上说明本地区其它动物源携带率也较高,由于样本数量较少,尚有待进一步研究确定。
CpA 的致病性与其产生的毒素和溶血素有直接关系,本试验分离到的羊源CpA 在血平板出现溶血现象最快,溶血情况最为明显,是否与羊在感染Cp 后,相比于其他动物,是最容易导致疾病产生的动物之一有关,需要进一步研究。在羊群养殖过程中,应该多加注意防范产气荚膜梭菌病的发生与传播。6 种动物源CpA中,猪源CpA在血平板出现溶血现象最慢,溶血圈直径最小,这可能与猪源CpA对猪的致病性相对较弱有一定的关系,不同动物源CpA 的毒性存在着一定的差异。CpA 普遍存在环境与动物的肠道中,细菌间基因水平转移、毒素基因富集等现象[25],警示动物源CpA 也是一种不可忽视的潜在病原菌,特别是在抗生素后时代,饲料中禁抗后,养殖业尤其需要重视CpA可能带来的危害。
