GLP-1RA CVOT结局与法规解读
2020-09-07陈峰霍丽朱超母义明
陈峰,霍丽,朱超,母义明
1.南京医科大学公共卫生学院,江苏 南京 211166;2.礼来苏州制药有限公司医学部,上海 200041;3.中国人民解放军总医院内分泌科,北京 100853
改善糖尿病患者心血管结局是糖尿病管理关注的焦点。糖尿病患者发生心血管事件(cardiovascular event,CVE)风险显著升高(为非糖尿病患者的2~4倍),近半数患者死于心血管疾病(cardiovascular disease,CVD)[1]。然而,研究发现,单纯降糖治疗并未降低CVE发生风险[2-3]。在发现罗格列酮增加CVE发生风险[4]后,美国食品药品监督管理局(U.S.Food and Drug Administration,FDA)规定降糖新药申办方须提供药物心血管安全性证据[5],该项规定进一步提高了糖尿病药物审批标准。新型降糖药的心血管结局试验(cardiovascular outcome trial,CVOT)结果的发布,不仅提供了新上市降糖药物心血管安全性证据,同时也驱动了糖尿病治疗模式和流程改变。多项针对胰高糖素样肽-1受体激动剂(glucagonlike peptide-1 receptor agonist,GLP-1RA)的CVOT结果表明,GLP-1RA对2型糖尿病(type 2 diabetes mellitus,T2DM)患者心血管不仅具有安全性,部分GLP-1RA还显示出了心血管获益。
1 CVOT:强制性事件推动FDA/EMA法规修订
控制糖尿病患者心血管风险行动(Action to Control Cardiovascular Risk in Diabetes,ACCORD)[2]和退伍军人糖尿病研究(Veterans Affairs Diabetes Trial,VADT)[3]等大型临床研究结果表明,强化降糖并未给患者带来心血管获益。而2007年发表于新英格兰杂志的一项Meta分析[4]指出罗格列酮治疗可能增加T2DM患者CVE的发生风险,该结果的披露成为了降糖药物心血管安全性评估被提到监管日程的导火索。2008年FDA颁布了《2型糖尿病治疗药物心血管疾病风险评估指南》[5],要求在T2DM新药上市前充分评估其心血管安全性:①在新药研究计划阶段:要求预先成立独立委员会,对所有Ⅱ/Ⅲ期研究中发生的CVE进行盲法裁定,其中心血管死亡、心肌梗死和卒中是必须考察的CVE。为获得足够的心血管终点事件以便进行风险评估,研究需纳入心血管高危患者,并且提供长期心血管风险的研究数据(如至少2年)。②在完成临床研究,提交新药申请(new drug application,NDA)或生物制品许可申请(biologics license application,BLA)前:对所有已完成的Ⅱ/Ⅲ期研究进行Meta分析,综合比较试验组和对照组间的主要CVE发生率,要求所估计风险比(hazard ratio,HR)的双侧95%置信区间(confidence interval,CI)上限<1.8,否则应额外进行大规模安全性研究,证实95%CI上限<1.8后才能提交NDA/BLA。如95%CI上限介于1.3~1.8且总体风险-获益支持批准,则需上市后进行CVOT以证实95%CI上限<1.3。如95%CI上限<1.3且总体风险-获益支持批准,则通常不需要进行上市后的CVOT。2012年欧洲药品管理局(European Medicines Agency,EMA)《糖尿病防治药物临床研究指南》[6]也规定,在药物批准上市前,申请人应提交充分有力的心血管安全性评估(如以心血管结局为主要终点的研究)及针对心血管安全性的Meta分析结果。
2 GLP-1 RACVOT异同及获批心血管适应证解读
继2008年F D A新规出台,迄今为止,已完成了7项GLP-1RA CVOT。以FDA指导原则为基础,各CVOT在研究目的、试验设计、纳入人群等方面均存在异同。对这些异同的分析比较将有助于对研究结果进行合理解读,也会进一步促进对GLP- 1RA类药物心血管适应证获批情况不尽相同原因的理解。
2.1 多维度洞悉G L P-1R A C V O T的异同针对G L P-1R A类药物的各项C V O T为达到不同试验目的,采用了不尽相同的统计检验策略,见表 1[7-13]。①仅为证明药物的心血管安全性,即与安慰剂相比,药物不增加主要心血管不良事件(major adverse cardiovascular event,MACE)发生风险,统计方法上给予非劣效检验,即证实HR的95%CI上限<预设非劣效界值,如SUSTAIN-6;②在证明药物安全性的基础上,进一步探索药物是否具有心血管获益,即与安慰剂相比,可否降低MACE风险,则统计方法上给予非劣效检验达成后转优效检验,如ELIXA、LEADER、EXSCEL、Harmony Outcomes和PIONEER-6;③直接证明药物具有心血管获益,统计方法上给予优效检验,即证实HR的95%CI上限<1.0,如REWIND研究。CVOT需明确一类错误消耗策略,预设所有需要检验终点的顺序,若某一个检验未通过预设检验水平则停止,后续检验无论其结果如何均视为探索性分析,以达到控制假阳性。未进行假阳性控制的检验,即使其结果显示有所谓的“统计学意义”,也仅能作为探索性分析。
CVOT的统计学检验效能由MACE事件数驱动。统计检验策略的不同决定了预设事件数的不同,从而各个研究所需样本量及随访时间也不同。因此,为在短期内得到足够多的心血管终点事件,大多数CVOT主要选择了合并CVD病史的高危人群。然而,在临床实践中,仅有约32.2%的T2DM成年患者患有CVD[14],更多患者仅合并心血管危险因素。7项GLP-1RA CVOT中,REWIND研究男女纳入比例相当,确诊CVD的患者比例最接近临床,随访时间最长[15],见表2[7-13]。
基于不同的研究目的,采用不同的试验设计,得出的研究结果也不同。7项CVOT中,ELIXA、EXSCEL和PIONEER-6研究仅证实了GLP-1RA类药物长期的心血管安全性;LEADER、HarmonyOutcomes和REWIND研究证实了GLP-1RA类药物不仅具有心血管安全性,还具有心血管获益。其中,LEADER和Harmony Outcomes研究在证明其非劣效后进一步证明了优效于标准治疗,而REWIND研究直接证明了药物的心血管获益。此外,值得注意的是,SUSTAIN-6研究虽在数值上达成优效,但由于研究并未预设优效性检验,所以统计学上不能做出优效达成的结论,见表3[7-13]。
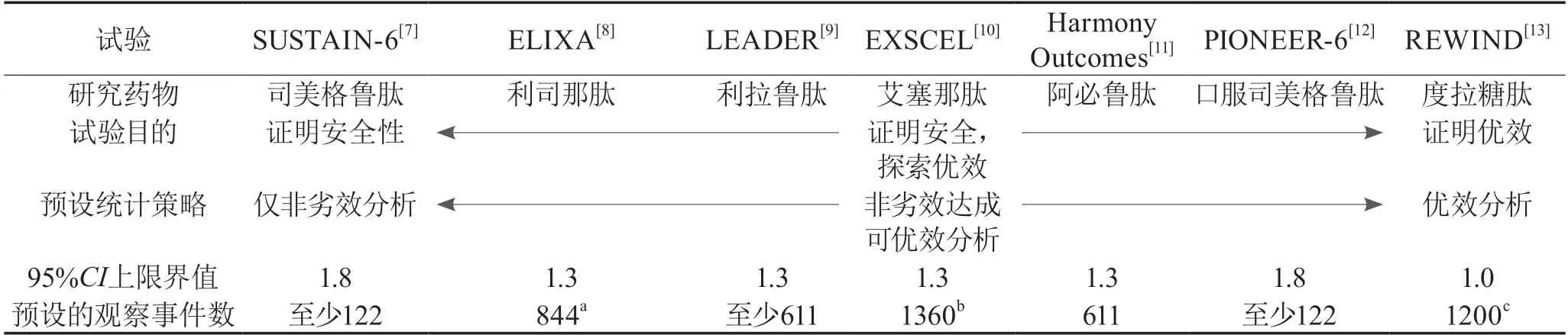
表1 GLP-1 RA CVOT试验设计
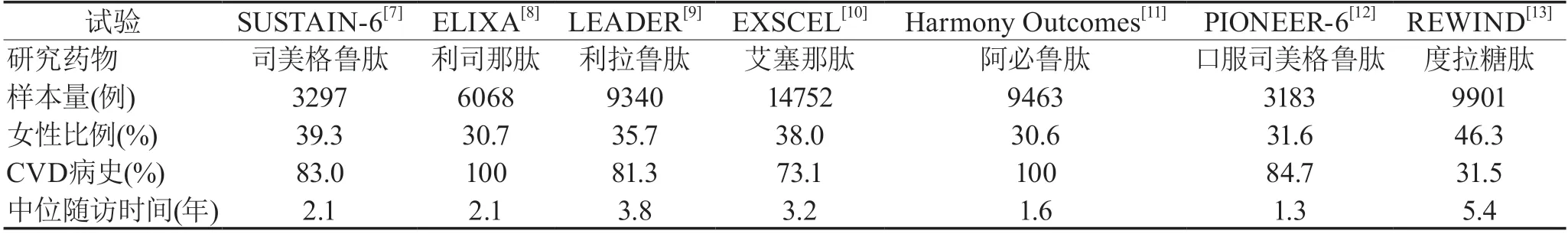
表2 GLP-1RAC VOT纳入人群特征
2.2 GLP-1RA降低T2DM心血管事件适应证获批在证实心血管安全性的前提下,各GLP-1RA目前均获批用于辅助饮食控制和运动,以改善T2DM患者的血糖控制。对于已合并CVD的T2DM患者,GLP-1RA的使用属于对心血管结局的二级预防;对于仅具有CVD高危/极高危因素的T2DM患者,具有心血管获益药物的使用属于对心血管结局的一级预防。基于司美格鲁肽、利拉鲁肽、阿必鲁肽和度拉糖肽心血管获益的证据,FDA批准了其中3种GLP-1RA的新适应证,并在临床数据部分对相应的CVOT进行了描述;EMA也在欧洲产品特征概要(European Summary of Product Characteristics,EU SmPC)的临床部分对相应CVOT进行了更新,见表3。
由于REWIND研究证实了度拉糖肽在合并CVD或具有CVD高风险因素的T2DM人群中具有心血管获益,度拉糖肽成为首个也是唯一一个被FDA批准用于降低合并CVD或具有心血管危险因素的T2DM患者主要心血管事件风险的GLP-1RA。
3 循证证据驱动下GLP-1RA的临床转化
3.1 基于GLP-1RA CVOT的临床用药指导GLP-1RA新型降糖药物在心血管安全性甚至心血管获益方面不断被披露的循证证据,驱动了降糖药物标准从心血管疾病预防角度的重新定义,助力了药物说明书的更新和适应证的扩展,从而帮助临床医生更好地理解产品,为患者制定适合的治疗方案。同时,CVOT循证证据也推动了糖尿病管理临床决策、诊疗思路及权威指南等的更新[16-19]。在降糖药物选择上,推荐首先根据糖尿病患者心血管风险评估结果来进行临床决策[16]。无论患者血糖是否达标,对于那些有C V D或高危/极高危因素的患者可尽早起始具有心血管获益证据的药物[19]。2019欧洲心脏病学学会(European Society of Cardiology,ESC)/欧洲糖尿病研究协会(European Association for the Study of Diabetes,EASD)联合制订的糖尿病、糖尿病前期及心血管疾病指南则将钠-葡萄糖协同转运蛋白2抑制剂(sodium-glucose cotransporters-2 inhibitor,SGLT-2i)或GLP-1RA取代二甲双胍作为T2DM合并动脉粥样硬化性心血管疾病及心血管风险高危或极高危患者的一线降糖药物[16]。
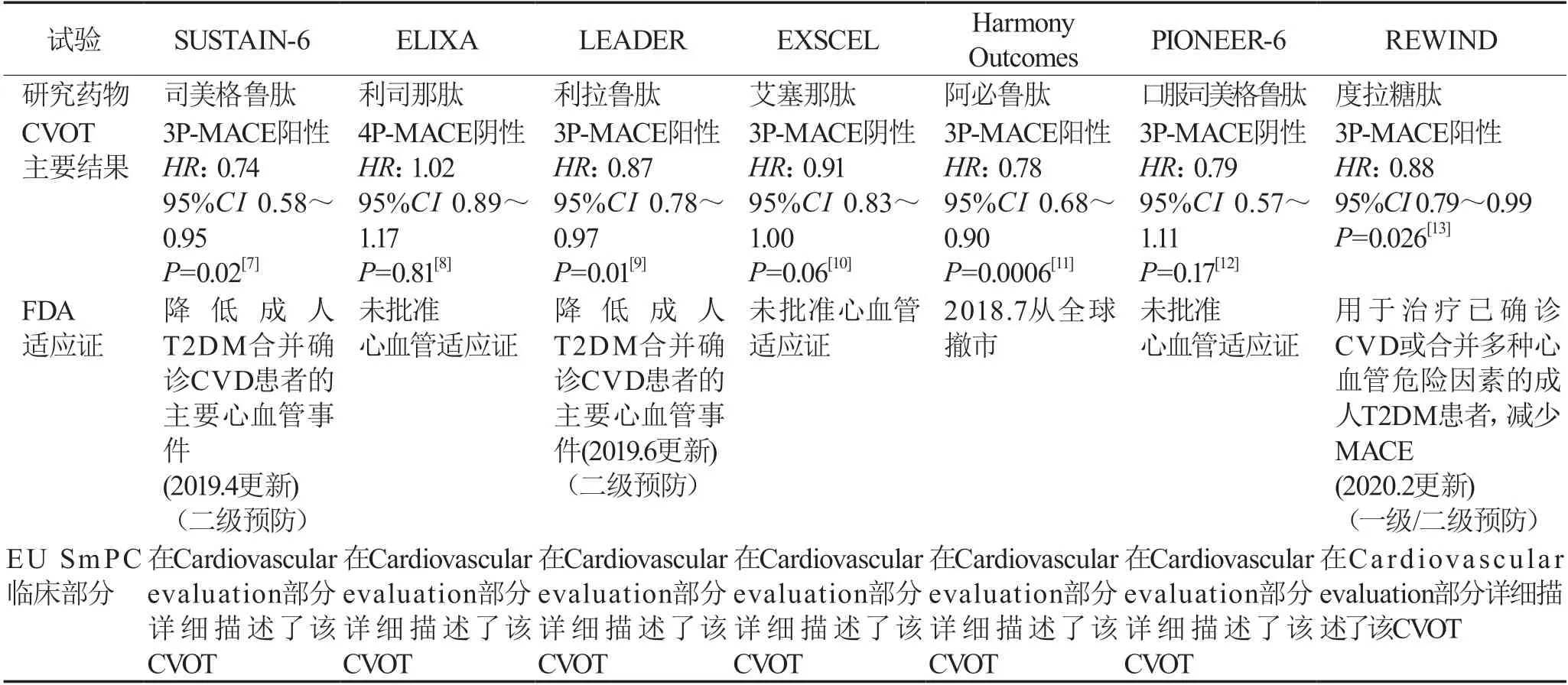
表3 FDA及EMA对GLP-1RA降低T2DM心血管事件适应证的批准情况
3.2 新草案下降糖新药CVOT开展的新思路2008年FDA法规颁布至今,尚无一项已完成的CVOT表明降糖药物导致CVE风险增加,部分降糖药物还被证明具有心血管获益。2020年3月10日FDA发布了《2型糖尿病:用于改善血糖控制新药的安全性评价行业指南》草案[20],不再无差异地要求申请人开展糖尿病新药缺血性心血管事件风险分层评估,不再包含设定的心血管风险阈值,对安全性数据库的规模以及入组患者的特征有了更细化的要求。该草案建议招募适当比例患有CVD、慢性肾病和老龄的T2DM患者,以期能更贴近临床实践。新草案的提出为降糖新药安全性评价提供了参考,使CVOT更易于临床转化,从而提供更全面、更有价值的安全性信息。
4 小结
根据法规的要求,降糖新药不仅要有降糖疗效,还要具备心血管安全性,这无疑提高了其上市的门槛,但与此同时,也给患者和临床医生的安全性用药提供了更多保障。目前已完成的GLP-1RA CVOT证实了该类药物具有长期的心血管安全性,部分GLP-1RA还显示出对心血管具有保护作用。不断披露的循证证据推动了说明书的完善和适应证的扩展,FDA评审草案也对降糖新药的安全性评价提出了更细化的要求。临床医生有望在不远的将来为T2DM患者提供更优选的治疗方案,并使其从中获益。
