肝细胞癌组织离体后室温放置时间与RNA 稳定性及碱基质量的关系
2020-09-05何璟荣李近都黄浩莫以帅廖迎阳朱少亮彭宁福通讯作者
何璟荣 李近都 黄浩 莫以帅 廖迎阳 朱少亮 彭宁福(通讯作者)
(广西医科大学附属肿瘤医院 广西 南宁 530021)
转录组高通量测序实验必须用未发生核糖核酸(Ribonucleic Acid,简称RNA)降解的组织标本,才能保障实验数据的保真性[1],肝组织内RNA 降解酶含量较其它组织丰富[2],因此肝癌标本体外留置的保鲜期备受关注。本研究对不同体外留置时间的肝癌标本分别建立基因文库,观察RNA 的稳定性及其测序质量。
1.资料与方法
1.1 标本来源、采集、分组、RNA 提取和质量检测
本研究经广西医科大肿瘤医院伦理委员会审理符合伦理规范,并取得知情同意后,随机选取5 例(男3、女2)肝细胞癌患者在广西医科大学附属肿瘤医院行根治性部分肝切除术后的肝癌组织标本,25℃室温体外留置。按体外留置时间分为10、20、30、40 和50min,共5 组。采用MQ-Gene1000-96 通量全自动核酸提取仪,配套石蜡包埋组织基因组RNA 提取试剂盒提取RNA;UV-1900 紫外分光光度计和安捷伦UniCel DxI800 全自动免疫分析仪行稳定性质量检测;Tru Seq Small RNA Sample Prep Kits 构建文库;Ion Torrent 基因组测序仪、Fast QC software检测测序数据质量。
1.2 RNA 质量评价方法
参照文献[3-4]综合评价。(1)杂质比率:A260、A280 和A230 分别代表核酸、蛋白质和有机溶剂的含量。A260/A230 比值评估RNA 标本有机溶剂残留,比值≥1.5 为RNA 杂质比合格。A260A/280 比值评估RNA 标本蛋白质污染,比值在1.8 ~2.1 之间为合格。(2)稳定性比率:5S、18S 和28S 分别代表120、1900 和4700 个核苷酸的核糖体(rRNA)含量,28s/18s 比值在1.8 ~2.0 间为RNA 稳定比合格。(3)完整性指数(RIN:RNA Integrity Number):综合计算总RNA 比例18S 和28S 曲线下总面积率、28S 峰度、5S 和18S 曲线下总面积率和标记峰的高度4个参数,RIN ≥6 为RNA 完整度合格。(4)碱基质量:将短序列的每个碱基标注其准确度的值(Q 值),Q <20 为碱基正确率达99%,错误率为1.0%,Q ≥20 为碱基质量合格。(5)CG 含量:要求样本序列CG 含量的分布与理论含量的分布一致性相关≤15%,亦可用CG 含量≥48%评价CG 含量合格。(6)短序列匹配率:RNA 质量与短序列匹配率相关。在同一批实验中,匹配率和单一匹配率明显低的标本,判定为RNA 质量不合格。
1.3 统计学方法
应用SPSS21.0 软件进行统计分析,计量资料采用均数和标准差(±s)表示,多组资料比较用F 检验,两两比较用Q 检验,P<0.05 为差异有统计学意义。
2.结果
2.1 肝癌标本体外不同留置时间与RNA 纯度、稳定性及完整性的比较
体外留置50 min 组的A260/A280 比值不如留置≤40min 组(P<0.01),提示放置时间在50min 内各组标本提取RNA 的蛋白质杂质含量纯度仍符合最低要求。留置≥40min 组其A260/A230、28S/18S 和RIN 均不如留置≤30min 组(P<0.01),提示标本放置时间在30min 内,其RNA 的酚类化合物比例和大、小分子RNA 的比例与完整性仍然符合最低要求,放置时间≥40min的标本,其酚类化合物比例、大、小分子RNA 比例及RNA 完整性未达到最低要求(见表1、图1)。
表1 肝癌标本体外不同留置时间与RNA 纯度、稳定性及完整性比较(±s,N=5)
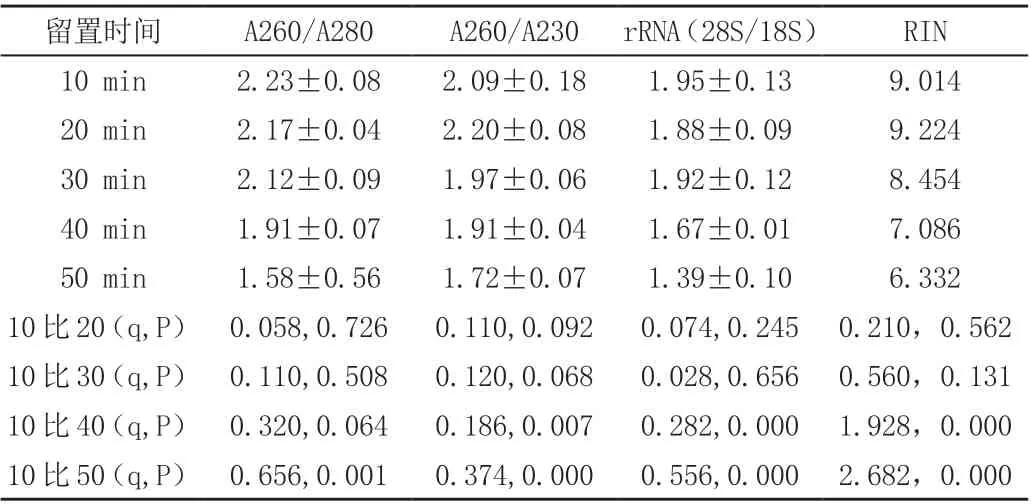
表1 肝癌标本体外不同留置时间与RNA 纯度、稳定性及完整性比较(±s,N=5)
留置时间 A260/A280 A260/A230 rRNA(28S/18S) RIN 10 min 2.23±0.08 2.09±0.18 1.95±0.13 9.014 20 min 2.17±0.04 2.20±0.08 1.88±0.09 9.224 30 min 2.12±0.09 1.97±0.06 1.92±0.12 8.454 40 min 1.91±0.07 1.91±0.04 1.67±0.01 7.086 50 min 1.58±0.56 1.72±0.07 1.39±0.10 6.332 10 比20(q,P) 0.058,0.726 0.110,0.092 0.074,0.245 0.210,0.562 10 比30(q,P) 0.110,0.508 0.120,0.068 0.028,0.656 0.560,0.131 10 比40(q,P) 0.320,0.064 0.186,0.007 0.282,0.000 1.928,0.000 10 比50(q,P) 0.656,0.001 0.374,0.000 0.556,0.000 2.682,0.000

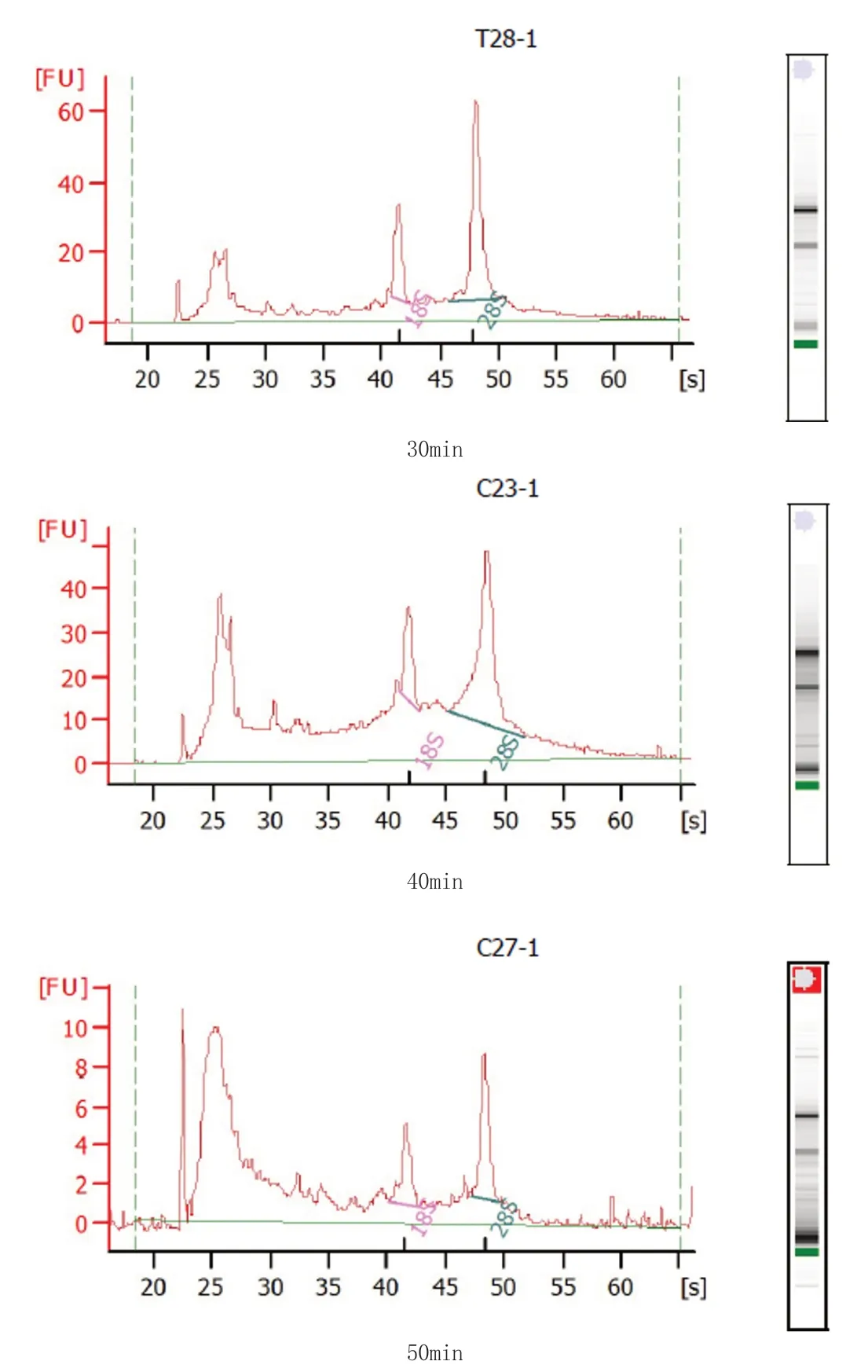
图1 肝癌标本不同放置时间RNA 纯度稳定性及完整性的检测峰图与电泳胶图变化情况
2.2 肝癌标本体外不同留置时间与碱基质量、CG 含量及短序列匹配率比较
体外留置50min 组的碱基质量不如留置≤40min 组(P<0.05),提示标本RNA 的稳定性质量符合最低要求。留置≥40min 组的碱基CG 含量、短序列匹配率和单一短序列匹配率不如留置≤30min 组(P<0.01),提示留置≥40min 组RNA 稳定性未达到最低要求(见表2,图2)。
表2 肝细胞癌标本不同放置时间与碱基质量、CG 含量及映射读序率的关系(±s,,N=5)
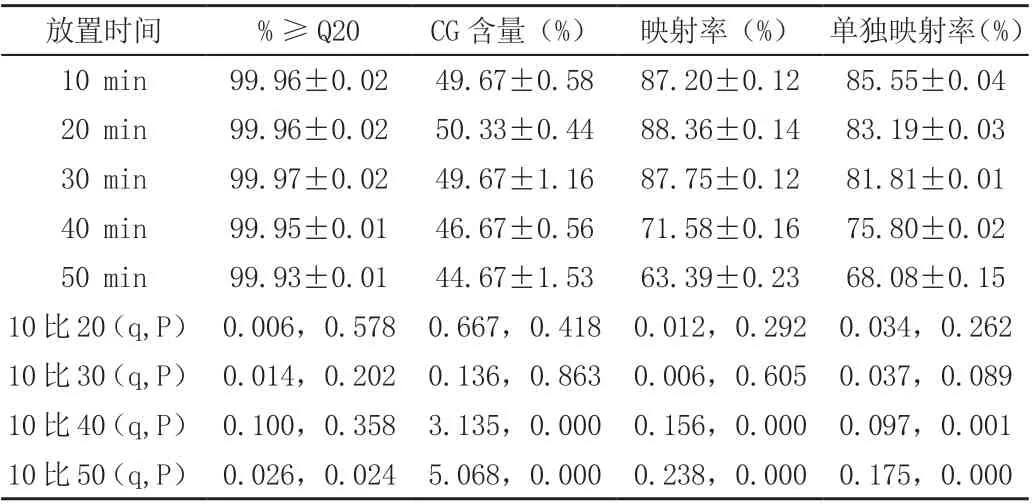
表2 肝细胞癌标本不同放置时间与碱基质量、CG 含量及映射读序率的关系(±s,,N=5)
放置时间 %≥Q20 CG 含量(%) 映射率(%) 单独映射率(%)10 min 99.96±0.02 49.67±0.58 87.20±0.12 85.55±0.04 20 min 99.96±0.02 50.33±0.44 88.36±0.14 83.19±0.03 30 min 99.97±0.02 49.67±1.16 87.75±0.12 81.81±0.01 40 min 99.95±0.01 46.67±0.56 71.58±0.16 75.80±0.02 50 min 99.93±0.01 44.67±1.53 63.39±0.23 68.08±0.15 10 比20(q,P) 0.006,0.578 0.667,0.418 0.012,0.292 0.034,0.262 10 比30(q,P) 0.014,0.202 0.136,0.863 0.006,0.605 0.037,0.089 10 比40(q,P) 0.100,0.358 3.135,0.000 0.156,0.000 0.097,0.001 10 比50(q,P) 0.026,0.024 5.068,0.000 0.238,0.000 0.175,0.000

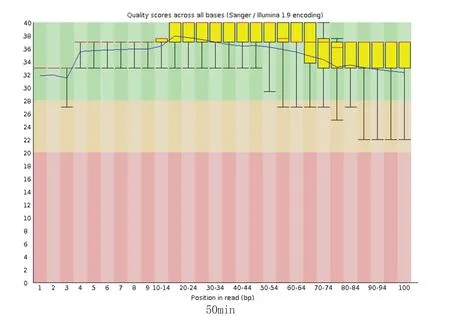
图2 肝癌标本不同放置时间测序读序碱基Q 值变化情况
3.讨论
转录组学对RNA 样本的稳定要求比较高,因此严格处置标本,对保障RNA 样本质量在转录组学研究中具有重要意义。RNA稳定性包括纯度与完整性两方面。RNA 纯度与提取RNA 的试剂、方法及样品稀释度有关。RNA 完整性与其降解相关,样品一旦发生RNA 降解,其相继的实验研究结果将出现系统性偏差。研究表明标本离体后,其RNA 稳定性的影响因素较多,如标本储存环境、细胞裂解、RNA 分离方法、内源核糖核酸酶(RNase)激活、环境RNase 污染、低浓度RNA 的沉淀、提取后的RNA 储存、源自富含降解酶的器官样品等均可影响RNA 稳定性[5]。目前,多数采用核糖体(rRNA)28S 及18S 的吸收峰值来评价RNA 完整性,通常认为一旦降解酶发生作用,每个基因降解水平均相同,参考基因在完整及降解样品中的稳定性则有差别;同时,28S 和18S 条带比率具有一定的组织及细胞特异性。因此,基因表达差异的探索中,应将样品与同标本来源的完整对照样品比较,尽量避免完整样品与降解样品的相互比较[6]。本研究表明,肝癌组织标本离体后,在25℃环境下放置30min内处置,提取RNA的稳定性尚有质量保障;离体40min 后处置,其RNA 已有一定降解。因此,对于转录组研究所采用的肝癌标本,为保障标本RNA 纯度及完整性、保障后续研究质量,应在离体后30min 内用快速冻存等方法处置。
