肺多发磨玻璃结节的诊治策略
2020-09-04刘宝东
刘宝东
1 总论
1.1 肺磨玻璃结节 1996年Fleischner学会提出肺磨玻璃结节(ground-glass nodule, GGN)的概念[1]。根据GGN内部是否含有实性成分,分为纯磨玻璃结节(pure GGN, pGGN)和部分实性结节(part-solid nodule, PSN),而pGGN及PSN又称为亚实性结节(sub-solid nodule, SSN)[2-4]。与实性结节相比,GGN与肺腺癌的关系较为密切,后者包括原位腺癌(adenocarcinomain situ, AIS)、微浸润腺癌(minimally invasive adenocarcinoma, MIA)和浸润性腺癌[5]。
有研究[6]发现,GGN大小与肺癌存在相关性,<6 mm的恶性概率为1%(1/136),6 mm-10 mm的恶性概率为20%(14/70),11 mm-20 mm的恶性概率为45%(10/22),>20 mm的恶性概率为80%(4/5);GGN密度也与肺癌存在相关性,实性结节的恶性概率仅为7%(14/89),PSN的恶性概率为63%(10/16),pGGN的恶性概率为18%(5/28)。≤10 mm的pGGN大约有25%的概率是AIS和小于5%的概率是浸润性腺癌;>10 mm的pGGN大约有40%的概率是AIS和20%的概率是浸润性腺癌;≤10 mm的PSN大约有50%的概率是AIS和25%的概率是浸润性腺癌;>10 mm的PSN大约有50%的概率是浸润性腺癌。另外,GGN在随访期间大约有20%-30%的概率进展,多是AIS,很少有浸润性腺癌。大小有缩小不意味着不需要关注,除非明显缩小或多次随访[7]。
意大利胸外科学会(Italian Society of Thoracic Surgery,SICT)发表了160位成员关于GGN的调查结果[8]:高分辨率计算机横断层扫描(high resolution computed tomography,HRCT)检查用于GGN的诊断,但是40%的受访者也支持常规使用正电子发射计算机横断层扫描(positron emission tomography-CT, PET-CT),即使是pGGN也是如此。约50%的受访者支持经皮肺穿刺活检,尤其是>1 cm且持续存在或PSN。在初次随访后,对持续性或不断增长的PSN应行手术切除,但对持续存在的pGGN是否进行手术仍存在分歧。对实性成分<50%的c-I GGN,亚肺叶切除术优于肺叶切除术,楔形切除还是肺段切除以及淋巴结清扫仍存在分歧。 对实性成分>50%的c-I GGN,亚肺叶切除术劣于肺叶切除术,同时进行淋巴结清扫。尽管96.2%的受访者认为电视辅助胸腔镜手术(video-assisted thoracoscopic surgery,VATS)可用于治疗pGGN,但68%的受访者认为VATS仅适用于部分可术中定位的病例。尽管68%的受访者建议对<5 mm的pGGN进行影像学随访,但对CT扫描随访时间和间隔仍存在分歧。
1.2 肺多发磨玻璃结节 近年来,肺多发GGN的诊断越来越频繁,大约20%-30%切除的GGN病变伴有其他多发较小的肺内GGN病变[9]。Hattori等[10]研究提示,肺多发GGN手术切除的病灶多数为腺癌或者癌前病变(占98.9%),生物学行为属于惰性。但是不应低估pGGN,因为有高达40%的病例与浸润性腺癌相对应[9,11]。
对国际肺癌研究学会(International Association for the Study of Lung Cancer, IASLC)221位跨学科成员进行了关于肺多发GGN处理的问卷调查[12]:63%建议术前获得多个病灶病理,66%建议做基因检测,以评估其组织学和基因一致性。63%推荐手术切除(其他18%不建议手术,19%不确定),81%的外科医生倾向手术切除,明显高于肿瘤内科医生的54%、肺科医生的66%和放射肿瘤医生的45%(P=0.003,9);术式以肺叶切除(针对主要病灶)和各种联合肺段切除(针对次要病灶)为主。
虽然已经发布了一些关于肺多发GGN的指南,但多是基于CT影像的随访标准,对临床工作几乎没有指导意义,因为临床更关注GGN的随访间隔与时限、主病灶和次要病灶的关系、穿刺活检、基因检测、治疗和残留结节随访等。
2 诊断
2.1 随访间隔与时限 研究[13,14]发现30%-90%的pGGN后在随访3个月后消失,且可以新发50%的pGGN,这些消失的pGGN考虑是炎症。在新型冠状病毒肺炎(corona virus disease 2019, COVID-19)疫情严重的今天,更应该加以重视鉴别诊断。所以临床上一般认为随访3个月大小和形状仍没有变化的GGN不除外肺癌的可能。Fleischner学会指南建议对所有多发GGN的病例在3个月-6个月内复查CT,至少1个GGN>6 mm,考虑为多原发肺腺癌[3]。
日本一项对78例肺多发GGN患者进行随访的研究[15],中位随访时间为45.5个月,随访期内37%增大,其中大多数在36个月内出现,因此建议对肺多发GGN患者的最佳观察时限为36个月。
2.2 影像学检查 ①PET-CT:pGGN病变标准化摄取值(standardized uptake value, SUV)较低,PET-CT检查价值有限,一般不推荐。PET-CT检查主要用于实性或部分实性结节(实性成分>10 mm)[16-18];②胸部CT增强扫描:pGGN病变原则上不需要做CT增强扫描;但部分实性结节、病灶与肺血管关系密切或者怀疑淋巴结转移者可行胸部CT增强扫描。通过人工智能(artificial intelligence, AI)辅助诊断系统,从CT等医学影像图像分析肿瘤生物学特征和影像学特征之间的定量关系,从而构建肿瘤的诊断、疗效评价及预测等模型;③分期检查:一般不必做骨扫描、头颅MRI检查和腹部超声等分期检查[19]。
2.3 病理检查 ①经皮肺穿刺(transthoracic needle aspiration, TTNA)活检:Fleischner学会推荐实性成分≥5 mm做TTNA或手术。活检的原因是无法手术切除或决定手术术式。但是易出血、易气腔内播散、易发生空气栓塞。SSN活检的敏感性为64.6%-96.8%,与实性成分相关[20-24];②经气管镜肺穿刺活检:可以经过电磁导航支气管镜(electromagnetic navigation bronchoscopy, ENB)、支气管超声导向鞘(endobronchial ultrasonography with a guide sheath, EBUS-GS)、虚拟支气管镜导航(virtual bronchoscopy navigation, VBN)及衍生出的经肺实质结节隧道(bronchoscopic transparenchymal nodule access, BTNA)穿刺活检。敏感性70%左右,并发症发生率低。
2.4 基因检测 基因检测的目的不是为了治疗,而是为了诊断。有研究[25]显示,多发GGN在基因和肿瘤发生上具有巨大的异质性,也就是说均为独立发展的病灶,病灶之间的基因变异差异很大,可以肯定是多原发而不是转移。如果仅计算表皮生长因子受体(epidermal growth factor receptor,EGFR),则在整个人群中,驱动基因突变的不一致率是80%左右[26,27]。驱动基因突变进化树显示:不同区域肿瘤呈现分支进化,解剖学位置相距较远的肿瘤间突变特征差异更明显。在同一信号通路上的驱动事件呈异质性,但在生物学功能上是趋同的。肿瘤形成过程积累突变不同,进化压力对基因的多样性兼具扩展和约束的机制[25]。
3 治疗
根据GGN的解剖位置、大小和数量,可以考虑亚肺叶切除和肺叶切除,双侧病变可以考虑同期或分期手术。肿瘤热消融是肺多发GGN的治疗方法之一。
3.1 适应证 ①高危因素:中老年人(55岁-74岁)、既往恶性肿瘤病史、家族史、长期吸烟史(>30年,或戒烟年限<15年)、或特殊职业接触史(石棉)等情况;②影像学上恶性征象:毛刺征、分叶征、胸膜凹陷、部分实性;动态观察发现GGN增大、实性成分增加;贴近脏层胸膜的周围型GGN可局部切除。主病灶最大径和肿瘤实性成分比值(consolidation tumor ratio, CTR)是医师判断结节良恶性和手术时机的参考依据;③患者极度焦虑,无法缓解。
3.2 术前辅助定位 ①术前定位技术:CT引导下经皮肺穿刺注射医用胶、亚甲蓝、吲哚菁绿(ICG)等液体材料,或放置微弹簧圈、Hook-wire等辅助定位;经电磁导航支气管镜或虚拟支气管镜导航注入染料等定位[28];②术中定位技术:术中B超定位、术中立体解剖定位。
3.3 胸腔镜手术 (1)切口选择:GGN首选治疗方式是胸腔镜手术,包括单孔胸腔镜、二孔胸腔镜、三孔胸腔镜、剑突下胸腔镜等;(2)手术原则:①主病灶优先,兼顾次病灶;②同一肺叶双原发或多原发结节:同期手术多采用肺叶切除;③同侧不同肺叶单发病灶:若患者肺功能允许,可采取同期手术,一般较大病灶所在的肺叶行肺叶切除术,小病灶采取肺楔形切除;若两病灶较小,可采用不同肺叶的亚肺叶切除;④当病灶分别位于两侧肺叶时,选择分期切除的手术原则是:a.先切除中心型、进展较快、病灶较大或伴有纵隔、肺门淋巴结转移的主病灶,后切除周围型、进展较慢、病灶较小或无淋巴结转移的其他病灶;b.先切除对预后影响较大的病灶:如病灶较大、密度较高、实性成分较大、恶性征象明显、分期较晚的病灶;c.两次手术间隔时间太短不利于患者初次手术后的恢复,增加二次手术的风险;而间隔时间太长又会增加未切除侧病灶进展和转移的风险,一般两次手术的时间间隔应在4周-6周;⑤选择同期切除遵循的手术原则是:a.安全:先进行切除范围小的一侧,确保对侧手术安全;b.不安全:先切除主病灶,二期对侧手术;⑥关于淋巴结清扫:CTR是淋巴结转移的重要预测因素,回顾性研究[29,30]发现,CTR<0.5的肿瘤没有肺门或纵隔淋巴结转移,CTR≥0.5的肿瘤中有10%发生了转移。Ye等[31]回顾性研究发现,55例pGGN没有淋巴结转移,292例PSN有6例发生了N1淋巴结转移,3例发生了N2淋巴结转移。AAH、AIS、MIA、贴壁为主型腺癌和浸润性黏液腺癌没有淋巴结转移。无论采取何种手术方式,系统淋巴结采样都是必要的,它对延长肿瘤局部控制时间、提高治愈率及完善诊断分期均具有重要意义[32,33]。
多灶性GGN/贴壁生长肿瘤切除术后5年生存率在90%以上,即使是亚肺叶切除也不影响预后[17]。
3.4 肿瘤热消融 Kodama等[34]回顾性评价了射频消融治疗33例患者的42个GGN优势(≥50.0%)肺腺癌的临床结果,平均随访42个月,局部进展率14.3%(6/42),6例中的4例再次消融,除1例脑出血死亡以外,均存活,1年总生存率和肿瘤特异性生存率分别为100.0%和100.0%,3年分别为96.4%(95%CI: 77.5%-99.5%)和100.0%,5年分别为96.4%(95%CI: 77.5%-99.5%)和100.0%。Iguchi等[35]回顾性评价了射频消融治疗16例患者的17个表现为GGN为主(≥50.0%)肺癌的临床结果,中位肿瘤随访61.5个月,首次和二次技术效率1年分别为100.0%和100.0%,2年分别为93.3%和100.0%,3年分别为78.3%和92.3%;中位患者随访65.6个月,1例患者11.7个月因其他癌症复发而死亡,其余16例均存活,1年总生存率和肿瘤特异性生存率分别为93.3%和100.0%,5年分别为93.3%和100.0%。Yang等[36]回顾性分析了微波消融治疗肺部周围型磨玻璃密度影(ground-glass opacity, GGO)(腺癌)的初步结果,51例肺部GGO患者经微波消融治疗后3年的无局部复发生存率、肿瘤特异性生存率和总生存率分别为98.0%、100.0%和96.0%。
3.5 术后处理 多数GGN术后病理提示早期肺腺癌的不需要化疗和放疗。只有极少数部分实性结节,如果病灶较大,或者合并淋巴结转移才需要化疗。目前研究还没有证实分子靶向药物治疗对GGN患者有好处,除非因为肺功能低下而无法切除时,才建议患者做基因检测,以防将来复发时考虑靶向治疗。同期多数原发GGN如因肺功能因素无法行根治性切除时,可考虑化疗。
3.6 残留病灶 肺多发GGN的每个病灶都是独立的,有观点认为主病灶影响预后,也有观点认为不仅要看主病灶,还要看其他病灶的大小和实性成分,尤其是实性成分的改变。日本的一项研究[16]发现,如果主病灶实性成分为主或>25 mm,则其预后(5年OS)较GGN为主且大小≤25 mm者差。国际肺癌研究协会(International Association for the Study of Lung Cancer, IASLC)分期委员会对CT上表现肺多发GGN病变的腺癌亚型进行了综述[17],尽管该综述的重点是组织学证实为腺癌的患者,而不是筛查检查到的肺多发GGN,但得到了类似的结论,即多灶性GGN/贴壁生长肿瘤的预后很大程度上取决于主病灶在肿瘤原发灶-淋巴结-转移(tumor-node-metastasis, TNM)分期系统中最高T分期。但是,日本针对246例多发GGN患者的研究发现,主病灶和其他病灶都会影响生存率[18]。Shimada等[37]对67例肺多发GGN手术切除(39例完全切除)的回顾性研究发现:未切除GGN仅8%变化,23%患者出现新发病灶;多因素分析发现主病灶大小和实性成分与预后相关,次要或残留病灶及是否生长、新发不影响预后。其他研究[38-40]也证实,当切除主病灶后,无论其他病灶继续生长,还是出现新的病灶,或剩余病灶未予处理,都不会影响患者的OS。
总之,肺GGN中约30%为多发性的,且至少需要随访3个月,大小没有变化或增大才需要干预,不接受干预者至少随访3年,对部分缩小者也不能掉以轻心。基因检测发现各个病灶间存在明显的基因异质性,证实肺多发GGN是多原发肿瘤而不是转移。肺多发GGN的手术切除效果非常好,但是受到肿瘤热消融技术的挑战(图1)。
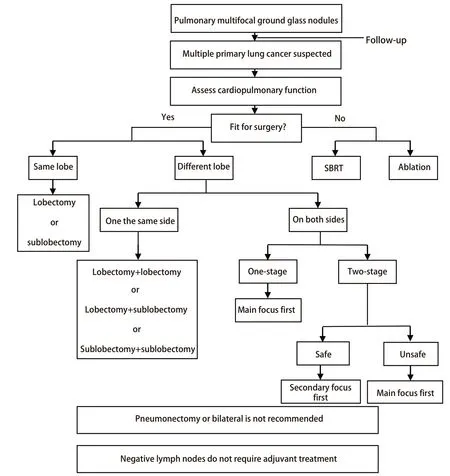
图 1 肺多发磨玻璃结节诊治流程Fig 1 Flow chart of diagnosis and treatment of pulmonary multifocal ground glass nodules.SRBT: stereotactic radiotherapy.
