铁对厌氧氨氧化过程及其微生物群落的影响
2020-09-04何莹莹张艺蝶
谢 丽,何莹莹,陆 熙,卜 凡,张艺蝶
(1.同济大学长江水环境教育部重点实验室,上海200092;2.同济大学环境科学与工程学院,上海200092)
水体中过量的氮元素将导致富营养化,从而造成生态失衡,影响人类的身体健康。随着环境保护观念的深入,含氮废水处理受到了广泛关注[1]。城市污水处理厂中的高浓度氨氮废水的处理成为水污染治理的关键。传统的硝化反硝化脱氮工艺需要曝气或外加碳源,造成能源消耗。近年来,厌氧氨氧化(anaerobic ammonium oxidation,缩写为anammox)作为一种经济高效、能耗低且脱氮效能高的新型工艺,已逐步应用于实际废水处理。厌氧氨氧化是指在厌氧或者缺氧的条件下,以碳酸盐作为碳源,以氨氮(NH4+-N)作为电子供体,与亚硝酸盐(NO2--N)反应生成氮气(N2)的过程[2]。此过程化学反应式如下:
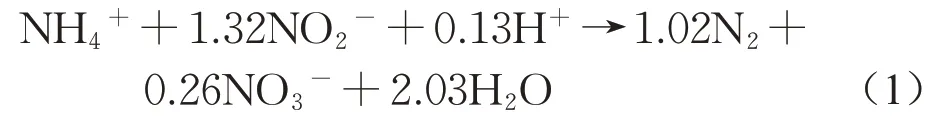
但是anammox工艺的成功运行面临许多挑战,例如反应条件较为苛刻、菌种世代周期长、反应器启动时间长等[3]。随着研究者对anammox过程的反应机制及代谢机理研究,发现很多物质(例如含氧阴离子、过渡金属以及有机质等)在厌氧条件下都可以作为电子受体与NH4+进行反应,包括三价铁离子(Fe(III))[4]、四价态锰离子(Mn4+)[5]、硫酸根(SO42-)[6]和有机酸[7]等,anammox菌只能利用NO2-作为电子受体导致厌氧氨氧化工艺的应用受到严重制约,这些电子受体的发现使厌氧氨氧化受到更加广泛的应用。
铁元素是地球上含量较多的元素之一,目前不少研究均围绕铁的厌氧氨氧化展开。由于铁的形态有不同的形式,如Fe(0)、Fe(II)、Fe(III)、纳米铁、铁氧化物等,涉及到不同的厌氧氨氧化反应机制,对氮的利用和转化也会存在差异,对控制条件也有不同要求[8-9]。2019年,吕冉等探讨过铁对废水微生物脱氮的影响,总结硝化、反硝化、同步硝化反硝化以及厌氧氨氧化等多个方面,但单独针对厌氧氨氧化的总结较少[10]。钟小娟等则从铁氨氧化(ferric ammonium oxidation,Feammox)的角度综述了其发展进程、发生机制和生态意义。因此本文从厌氧氨氧化的角度出发,综述铁对厌氧氨氧化的反应机理、微生物、颗粒化过程、条件控制的变化,并探讨其对N2O排放的影响,从而为以后铁强化厌氧氨氧化提供理论依据和技术支撑。
1 铁对厌氧氨氧化反应的电子传递机制
研究推断,厌氧氨氧化菌体内存在铁蛋白,铁蛋白可作为储存颗粒为血红素提供铁,血红素作为细胞的电子传递中心,因此铁在电子传递链中起到重要作用[11-12]。铁作为厌氧氨氧化过程中电子传递载体的活性中心,可通过还原态Fe(0)、还原态Fe(II)、氧化态Fe(III)的氧化还原过程以及氧化态Fe(III)直接替代厌氧氨氧化反应电子受体来实现电子的传递,促进厌氧氨氧化反应进程(图1)。铁元素的加入产生了新的反应过程,如Feammox、硝酸盐依赖型亚铁氧化反应(nitrate-dependent ferrous iron oxidation,NAFO),对N2O的排放产生不同的影响,改变原来厌氧氨氧化的电子传递机制。同时研究利用15N同位素示踪法探索铁在厌氧氨氧化过程中氮元素的反应途径[8,13-14],为厌氧氨氧化的电子传递过程提供依据。
1.1 Fe(III)及其氧化物作为电子受体在厌氧氨氧化过程中的作用
2006年,Sawayama首次提出铁氨氧化Feammox的概念,Fe(III)还原菌利用碳酸根为碳源,以Fe(III)-EDTA作为电子受体,氧化氨氮生成亚硝酸盐[15]。铁氨氧化现象在河岸湿地土壤[13]、热带旱地土壤[16]、水稻田[17]均有发现。相较于厌氧氨氧化过程,Feammox过程减少了N2O的排放,并且拓宽了胞外电子传递领域[18]。Zhou等研究发现Feammox过程中以蒽醌-2,6-二磺酸酯(anthraquinone-2,6-disulfonate,AQDS)为电子穿梭体能同时促进氨氮的转化和铁离子的循环[19]。Yang等同样发现AQDS-Fe2O3体系的脱氮效率(82.6%)高 于 不 添 加AQDS的Fe2O3体 系[20]。ADQS作为Feammox菌的电子穿梭体,通过还原体和氧化体的变化传递电子,促进Feammox的反应进程(图2)[18-19]。
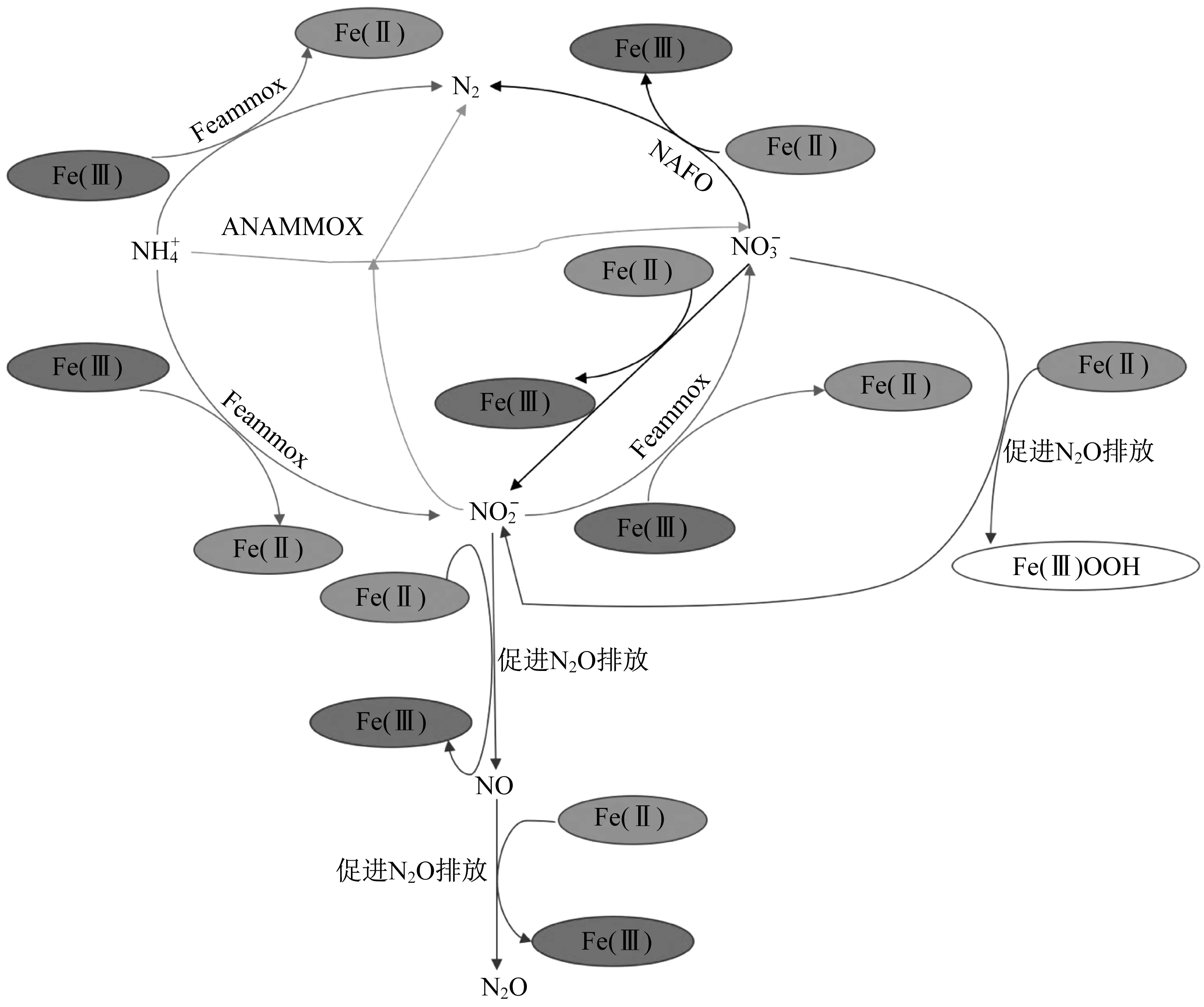
图1 N-Fe反应循环Fig.1 N-Fe reaction cycle
氧化态Fe(III)不但可以直接代替亚硝酸盐氮进行Feammox过程[4,21],也可以氧化氨氮生成亚硝酸盐氮进行厌氧氨氧化过程,可表示为式(2)[4]。
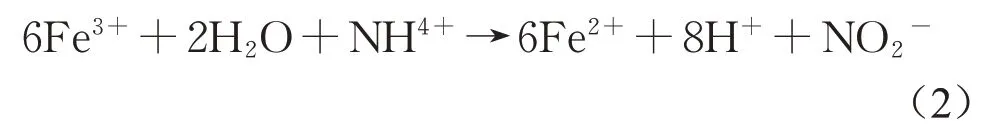
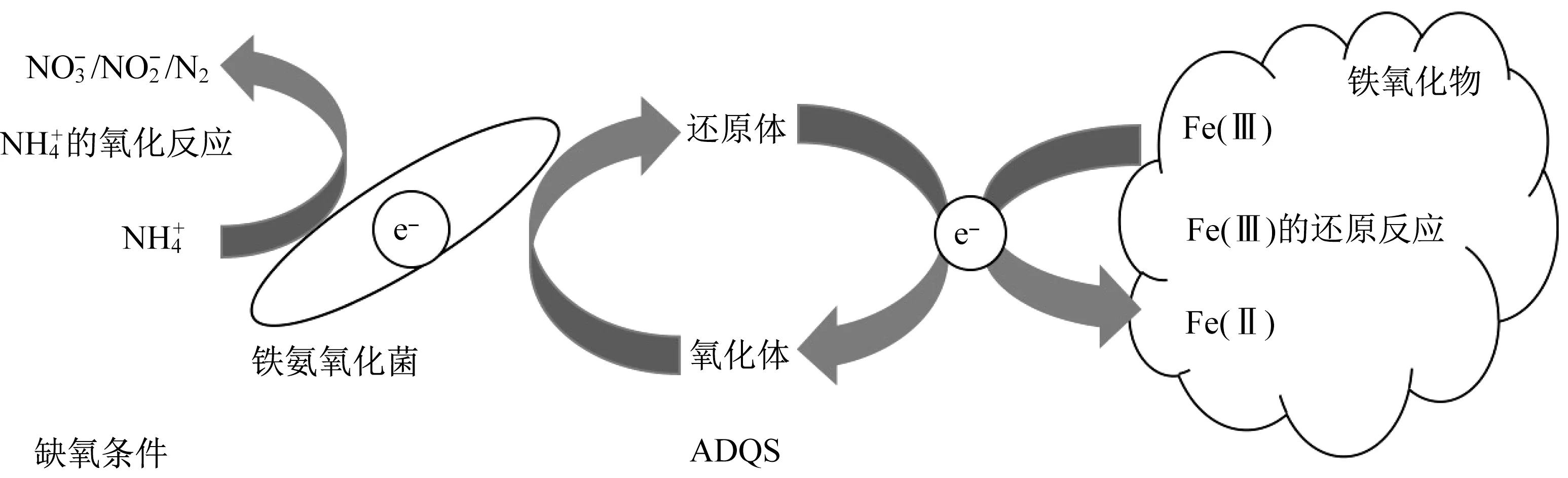
图2 铁氨氧化胞外电子传递模型[18]Fig.2 Model of extracellular electron transport for Feammox[18]
1.2 Fe(II)作为电子供体在厌氧氨氧化过程中的作用
Fe(II)作为电子供体,可以在anammox菌作用下,将硝酸盐还原为亚硝酸盐,称为NAFO反应。NAFO很早以前在水稻田[22]、活性污泥[23]等不同地方均有被发现,其对环境中的N和铁循环都有影响。研究证明,anammox菌可利用Fe(II)和硝酸盐氮生成Fe(III)和氮气[14],Shu等研究发现还原态Fe(II)利用硝酸盐氮生成亚硝酸盐氮或Fe(III),为厌氧氨氧化和铁氨氧化过程提供充足的底物,可表示为式(3)[24]。另外有研究者们发现,在Fe(II)存在且亚硝酸盐氮浓度升高的系统中,铁的化学氧化可能是N2O形成的重要原因[24-25]。其反应方程式如下:
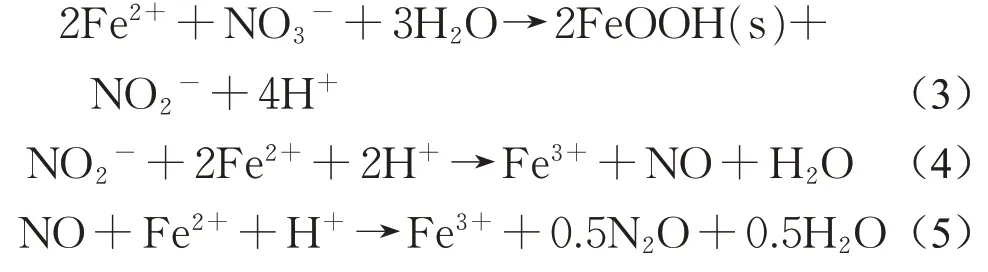
因此Fe(II)的加入将导致N2O的排放量增加。Zhang等进一步研究知,在anammox反应器中N2O排放量与注入Fe(II)浓度呈正相关。适量Fe(II)应控制在0.25mL·L-1(约0.5mg·L-1)以下能保证N2O的排放量不再增加。通过计算推测,至少60%的N2O排放来自其他来源,Nitrosomonas sp.ENI-11可能就是N2O产生另一个原因[26]。目前关于铁对N2O的排放研究较少,关于其促进N2O的排放的原因有待进一步探讨。
1.3 Fe(0)作为电子供体在厌氧氨氧化过程中的作用
Fe(0)具有很强的还原性,在非生物环境下,硝酸盐可以被Fe(0)还原成亚硝酸盐,最终还原成氨氮,可表示为式(6)[27]。

同时在生物环境下,细菌可以通过硝化氮异化还 原 成 铵(dissimilatory nitrate reduction to Ammonia,DNRA)将硝酸盐转为氨氮[28]。周健等在anammox菌利用Fe(0)还原硝酸盐脱氮的研究中,发现反应器中氨氮和亚硝酸盐的积累基本很难被检测到,推测Fe(0)通过化学还原反应生成亚硝酸盐和氨氮,从而厌氧氨氧化菌利用亚硝酸盐和氨氮为底物生成氮气[29]。Bi等人利用测定DNRA过程的功能基因nrfA,更加确定硝酸盐可以通过生物异化作用和化学还原作用2条路径生成氨氮,最后可以通过厌氧氨氧化反应生成氮气,完成脱氮过程(图3)[30]。
近年来,纳米Fe(0)在废水处理中的应用日益广泛[31]。纳米Fe(0)具有更小的粒径和更大的比表面积,容易扩散到细胞之间。但是由于独特的大小形状使其对细菌可能产生毒性,包括蛋白质失活、DNA破坏等[32-33]。研究发现,纳米Fe(0)对厌氧氨氧化过程中的作用机制与Fe(0)并无太大差别[34],但是由于纳米Fe(0)具有更强的还原性,因此降低硝酸盐氮和亚硝酸盐氮的效果更佳[35-36]。
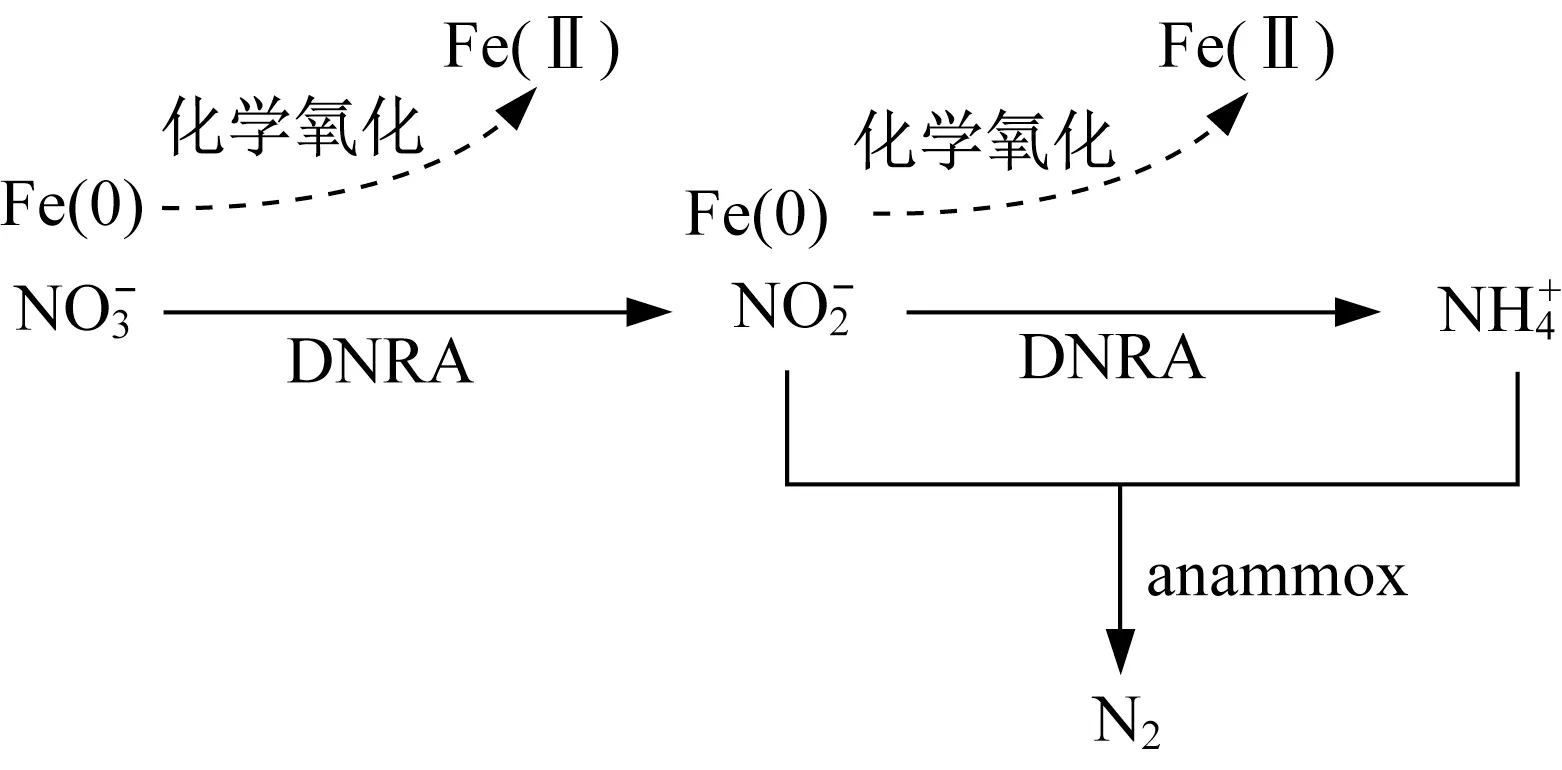
图3 厌氧氨氧化菌微生物利用零价铁还原硝酸盐为氮气体系元素转化推测[30]Fig.3 Deduced nitrate transformation pathway in reaction between nitrate and ZVI driven by anammox microbes[30]
2 铁对厌氧氨氧化微生物的影响
微生物是厌氧氨氧化过程的重要部分,大量的研究者们从微生物及其酶的改变出发,探索铁对厌氧氨氧化微生物的影响,结合定量PCR(quantitative PCR,qPCR)[37-38]、实时荧光定量PCR[39]、荧光原位杂交技术(fluorescence in situ hybridization,FISH)[4]、高通量测序[40]等研究技术,研究厌氧氨氧化微生物的群落结构、基因组和细胞色素c等。铁作为微生物生长的重要元素,可以促进功能微生物群落的富集,提高微生物的脱氮能力。同时铁作为血红素c的组成部分,有利于功能酶的形成,但是关于酶的研究目前还较少。最后,铁也积极影响微生物颗粒化,加速颗粒污泥的形成,调整颗粒污泥的粒径,促进整个厌氧氨氧化反应。
2.1 铁对厌氧氨氧化体系中微生物活动的影响
Erdim等发现投加纳米Fe(0)后,anammox菌占细 菌 总 数 的91%~92%,说 明 纳 米Fe(0)对anammox菌的生长有促进作用[35]。Guo等研究也发现,Fe(0)(1 000mg·L-1)的加入可以释放Fe(II)和Fe(III)离子,降低水中溶解氧(0.1~0.3mg·L-1)和氧化还原电位(75~176mV),调节生境pH值,抑制亚硝酸盐氧化菌(nitrite oxidizing bacteria,NOB)的生长,并有利于anammox菌和氨氮化菌(ammonia oxidizing bacteria,AOB)的活性,1 000mg Fe(0)·L-1的实验组中anammox菌量增加了约54%[8]。李健敏等发现投加Fe(II)或Fe(III)均可提高厌氧氨氧化菌和反硝化菌丰度,并降低NOB的丰度,但与Guo等的研究不同的是,实验结果表明Fe(II)或Fe(III)会抑制AOB的活性[39],因此可以看出铁的投加对AOB的效果还不确定,跟AOB的种类有关。
Tao和同事研究证明加入Fe(III)(0.04mmol·L-1)后,anammox菌的活性略有提高(12%),但在高浓度(0.3mmol·L-1)的Fe(III)时,活性受到严重抑制(61%)[41]。Zhang等研究也发现,Fe(II)1~5mg·L-1对厌氧氨氧化活动有明显的促进作用,但当逐渐增 加Fe(II)浓 度 从10mg·L-1到50mg·L-1时,anammox菌的相对丰度从最初的35.46%下降到11.04%,经过长期驯化后逐渐回升到19.39%,证明高浓度的Fe(II)对厌氧氨氧化体系有可逆的抑制作用 ,不 可 逆 抑 制 阈 值 为 50mg·L-1,CandidatusKuenenia是主要的anammox菌[42]。因此适宜的铁离子浓度有利于anammox菌的活动,Gao等研究证明合理的Fe(II)/Fe(III)浓度维持较高聚集酰基高丝氨酸内酯(AHLs),在anammox菌细菌中,诱导信号阈值可以快速传递,加强细菌活性[43]。
2.2 铁对厌氧氨氧化体系中酶的影响
血红素c是anammox菌中某些功能酶的重要组成部分,如肼合成酶(hydrazine synthesis,HZS)、肼脱氢酶(hydrazine dehydrogenase,HDH)等,见图4(图中Nir,为亚硝酸盐还原酶,Nar为硝酸盐氧化还原酶)[44],而厌氧氨氧化菌吸收铁离子合成血红素c[45],因此铁对厌氧氨氨氧化的酶系统有重要影响。Liu和Ni研究表明,当Fe(II)浓度从0.03mmol·L-1增加到0.09 mmol·L-1,有利于促进anammox菌的生长速率和血红素c的合成,anammox菌的比生长率从0.118d-1增长到0.172 d-1[46]。张黎等也发现,当Fe(II)浓度为0.085mmol·L-1时,样品中的亚铁血红素 含 量 达 到0.143μmol·mg-1,是 对 照 组 的2.04倍[47]。Bi和他们的团队通过多次研究均发现适当增加Fe(II)有利于血红素c的合成,提高HDH的活性。在Fe(II)浓度为0.09mmol·L-1时,HDH的活性分别是0.03mmol·L-1和0.06mmol·L-1的1.42倍和1.20倍[48]。Zhang等在新型铁电极anammox反应器强化脱氮的研究中发现,Fe(II)作为铁阳极腐蚀的产物,促进了血红素c的合成,加强了脱氮酶系统的作用[49]。因此Fe(II)被认为是加速anammox工艺启动周期的内在因素。但是当Fe(II)浓度升高到0.18mmol·L-1时,会对anammox细菌造成不良影响,进一步恶化脱氮性能[38]。因此适宜的Fe(II)浓度才能有利于厌氧氨氧化过程的进行。
2.3 铁对厌氧氨氧化体系中微生物颗粒化的影响
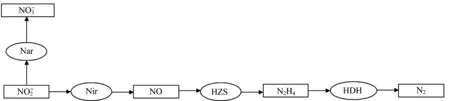
图4 厌氧氨氧化的代谢途径[44]Fig.4 Metabolic pathways of anammox bacteria[44]
颗粒污泥因其优良的沉降能力和生化反应性能,广泛地应用于厌氧系统。目前关于厌氧氨氧化颗粒污泥的研究很多,与絮状污泥和生物膜比较,颗粒污泥的平均脱氮效率最高,达到81.1%,絮状污泥脱氮效率最低,为74.1%[50]。因此颗粒污泥的粒径大小、微生物群落沿内核的分布等均成为决定厌氧氨氧化工艺成败的关键[51]。研究人员发现,铁对微生物颗粒化的作用在以下几个方面。
(1)促进胞外聚合物质分泌。Ni等认为,大量胞外聚合物质(EPS)在anammox细菌的快速颗粒化中起着重要作用[52]。Ren等研究发现,使用纳米Fe(0)可能有利于分泌胞外聚合物质(EPS),从而增强厌氧氨氧化细菌的颗粒化[34]。Zhang等也研究发现纳米磁铁矿与EPS官能团的相互作用可能有也助于anammox絮体的粒化[40]。
(2)抑制丝状菌的生长。Gao等研究发现,ZVI粉和Fe3O4通过抑制丝状菌的生长,提高颗粒污泥的沉降性能,改善颗粒形状,有利于氮气的释放[43]。
(3)利用盐桥效应。负电荷anammox细菌细胞可以聚集在铁离子(Fe(II)、Fe(III))周围,使anammox细菌凝聚到铁离子上形成新的颗粒,有利于anammox细菌的颗粒化[43,53]。
Gao等在研究铁对微生物颗粒化的影响时提出不同价态铁投加下的颗粒污泥形成过程(图5)。从图5a可以看出,胞外聚合物(EPS)通过改变细菌表面的负电荷,使2个相邻的细菌相互连接,同时细菌分泌更多的胞外聚合物,形成更大的anammox颗粒。但anammox细菌被胞外聚合物和丝状细菌包围,使颗粒过于致密,导致anammox颗粒产生的氮气不能释放,从而形成气体空腔甚至颗粒爆裂,与上文的胞外聚合物质(EPS)增强厌氧氨氧化细菌的颗粒化不同,因此适当分泌的胞外聚合物才会对颗粒化有积极影响,具体的需要研究者进一步探索。而加入Fe(0)与Fe3O4后,两者均可以通过氧化或者电离生成Fe(II)、Fe(III),然后anammox细菌通过盐桥效应聚集在铁离子周围,且细菌周围未发现丝状细菌,有利于颗粒內产生的氮气释放(图5b、5c)[43]。铁的投加在促进厌氧氨氧化过程中的微生物颗粒化的同时,也促进生成最优粒径范围的颗粒。李津青等研究得到颗粒污泥在0.5~1.0mm的粒径范围内活性最高[54]。Fu等研究表明在Fe(III)浓度是0.06mmol·L-1的时候,微生物颗粒粒径在1mm左右,生长周期较于对照组变短,anammox活性最高,颗粒性能最好[55]。Gao等研究发现,Fe3O4-anammox颗粒的粒径在第72d达到988.5μm,活性最高[43]。
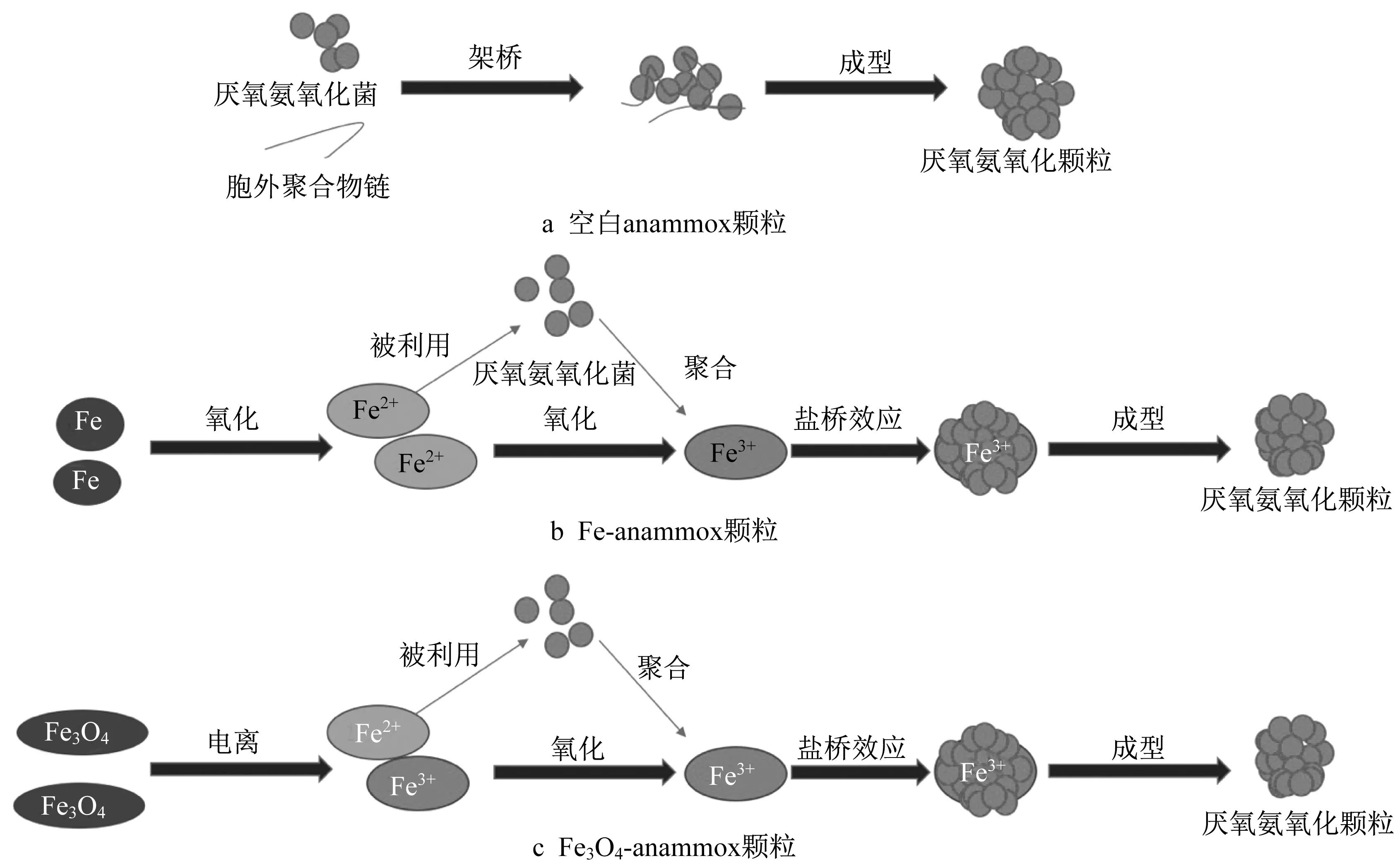
图5 三种anammox颗粒的形成机理[43]Fig.5 Forming mechanism of three anammox granules[43]
3 铁-厌氧氨氧化工艺的影响因素研究进展
不同的条件控制是造成厌氧氨氧化菌群落结构差异和多样性的主要原因。厌氧氨氧化菌对温度和pH的要求比较严格,铁与微生物脱氮系统中的pH存在相互作用,环境中的pH易受到铁的投加而改变,同时需要考察铁-厌氧氨氧化工艺中最适温度的变化。由于铁对厌氧氨氧化过程的影响,其投加浓度和价态组合也需要进行考察,才能更加全面地了解铁对厌氧氨氧化过程的影响。目前关于铁-厌氧氨氧化工艺的影响因素还在探索,对于影响因素的研究较少,主要集中温度、pH和铁的浓度上,提供了理论依据。
3.1 温度和pH值
研究表明anammox菌的最佳反应温度范围在35~38°C之间,最适pH值为7.5~8.0[56]。然而,铁元素在中性的条件下会以Fe(OH)2或者Fe(OH)3的形态存在,这种絮体易沉淀在反应器中,影响微生物传质,在不同温度环境下,铁-厌氧氨氧化工艺中的anammox菌活性也不尽相同,因此需要选择合适的温度和pH值。周健等研究得到添加Fe(0)的厌氧氨氧化体系中,当温度为20~35°C时,总氮去除率逐步升高并且始终保持较高的水平(76.17%~94.84%);当温度为45°C时,总氮去除率急剧降低,得到其最佳温度为35°C。并且总氮去除率随着pH(7.49~2.20)降低而降低,从5.14降低至2.20过程中,总氮去除率从89.41%快速降至1.01%[29]。陈方敏和他的同事研究不同温度、pH值对铁氨氧化过程影响,得到最适温度和pH分别是30°C和6.5,氨氮转化量最高到80.2%[57]。Oshiki和他的同事在研究利用anammox菌实现硝酸盐氮依赖Fe(II)的氧化中得到,温度范围30~45℃、pH范围5.9~9.8内,硝酸盐氮依赖Fe(II)的氧化活性最高,同时促进厌氧氨氧化反应的进行[14]。因此投加铁对厌氧氨氧化的最适温度没有明显影响,然而由于铁元素的沉淀,最适pH变低。
3.2 Fe的浓度与价态组合
不同价态的铁对微生物的作用不同,其最佳浓度也会不同,过量的铁可能抑制微生物的活性,引起微生物的中毒甚至死亡,产生不可逆转的抑制作用,因此需要合理投加含铁物质的用量至关重要,研究者们针对不同价态的铁的最优浓度也开展了一些研究(表1)。
如表1所示,Guo等在研究不同浓度(0、100 mg·L-1、1 000 mg·L-1)Fe(0)对厌氧氨氧化的长期影响下,得到1 000 mg·L-1浓度下anammox量增加得最多,且明显缩短了anammox反应器的启动时间[8]。对于Fe(II)来说,最优浓度在0.08~0.09mmol·L-1之间[24,58-59],进一步提高Fe(II)浓度,anammox菌的生长受到抑制,高浓度的Fe(II)会诱导芬顿反应[43]。Zhang和他的同事们指出Fe(II)对anammox过程的不可逆抑制阈值为50mg·L-1[42],Li等进一步发现,添加109.29和378.57mg·L-1Fe(II)可部分抑制和完全抑制厌氧氨氧化过程[60]。姚海楠等通过设置不同Fe(III)浓度(50mg·L-1、200mg·L-1、500mg·L-1)处理模拟垃圾渗滤液,得到50mg·L-1Fe(III)浓度试验组的氨氮转化量和转化速率最高,主要由于高Fe(III)浓度在中性条件下会迅速水解并沉淀在微生物表面阻碍传质,并且高浓度的Fe(III)达到一定浓度会具有生物毒性,从而降低微生物的代谢[61],同李祥等研究发现一致[62]。研究者也考虑组合投加不同价态的铁。Bi等考察了在升流式反应器中,Fe(0)、Fe(II)、Fe(0)/Fe(II)对厌氧氨氧化过程的影响。研究表明,相比单独投加Fe(0)和Fe(II),组合投加Fe(0)/Fe(II)从第16d硝酸盐去除率和总氮去除率才开始下降,其平均值分别为88.43%和80.77%。重新投加的周期长,效率提高[30]。

表1 不同价态的铁的最优浓度及影响Tab.1 Optimal concentration of iron in different valence states and its impact
4 结语
铁的投加对厌氧氨氧化反应有明显的促进作用。不同价态的铁投加对厌氧氨氧化的电子传递机制有不同的影响,可以通过氧化还原作用生成厌氧氨氧化底物,且耦合Feammox、NAFO反应促进脱氮效果。针对厌氧氨氧化的缺点,不同价态的铁投加对缩短启动时间(Fe(0))、提供更好的外界环境(Fe(0)、Fe(II)、Fe(III))、促进厌氧氨氧化菌生长代谢(Fe(0)、Fe(II)、Fe(III))均有显著的改善作用,并表现在多个方面的反应机制。在厌氧氨氧化反应中,铁作为微生物生长的必需因素,调节血红素c含量促进酶系统的活动,并提高优势微生物群落富集促进厌氧氨氧化反应进行。铁还可以加速颗粒污泥形成,改善反应过程中颗粒污泥的粒径,提高颗粒污泥的活性。同时铁的投加影响整个脱氮系统中的pH,因此铁-厌氧氨氧化工艺的最佳pH范围相较于厌氧氨氧化工艺有所下降,但是最佳温度范围并没有太多改变。不同价态的铁产生促进作用的适宜浓度也有所差别,且组合投加不同价态的铁对脱氮效率有积极影响。
铁对厌氧氨氧化的研究目前仍处在实验室探索阶段,投入实际生产的不多。为了工程实践应用,结合目前的研究,提出几个未来值得关注的方向:①铁的投加形式目前较为单一(铁粉、FeCl2、FeCl3),寻找廉价、易被微生物利用的铁源对铁-厌氧氨氧化工艺具有重大意义,且需要系统研究铁投加过量对微生物、酶造成的影响。②针对底物浓度(氨氮、亚硝酸盐)、C/N、Fe/N等因素,系统研究铁-厌氧氨氧化工艺的影响因素,为后续的应用提供参考价值。③关于厌氧氨氧化的强化方式很多,关注铁与其他强化手段的耦合效果,比如碳源、物理场等。④目前研究涉及与铁相关的功能酶和功能基因较少,借助宏基因组、宏蛋白组等技术手段,更加全面深入了解铁-厌氧氨氧化工艺。
