余甘子不同溶剂提取物体外抗氧化活性及对H2O2诱导RAW264.7细胞损伤的保护作用
2020-09-03李伟张小英叶嘉宜陈熔李一峰陈运娇曹庸
李伟,张小英,叶嘉宜,陈熔,李一峰,陈运娇,曹庸
(华南农业大学 食品学院,广东省功能食品活性物重点实验室,广东省天然活性物工程技术研究中心,广东 广州, 510642)
机体在衰老的过程中产生自由基,过度的自由基会影响体内氧化平衡,造成DNA损伤等,影响细胞的正常功能[1]。现代研究指出自由基与多种疾病有关,如心血管疾病、炎症、衰老等[2]。生物体内的抗氧化系统通常能有效清除体内过剩的自由基,主要包括抗氧化物酶和非酶促系统。其中,酶促系统包括超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)及过氧化氢酶(catalase, CAT)等,非酶系统包括还原型谷胱甘肽等物质[3]。近年来,大量报道指出植物提取物能有效清除体内外自由基、提高抗氧化酶酶活等作用,其中多酚类物质被认为是植物中重要的抗氧化物质,具有巨大的研究及应用前景。
余甘子,属于大戟科叶下珠属植物,是一种传统可食用水果;现广泛分布于热带和亚热带地区,我国境内主要分布于广东、广西、云南、四川等地[4-5]。药理研究指出余甘子中富含多酚类、多糖类、有机酸及维生素等活性物质,具有抗氧化、抗炎、抗肿瘤及抗衰老等多种生理活性[6-7]。常用作治疗多种疾病如咳嗽、喉咙炎症及消化不良[8]。目前,大多数报道关注余甘子单一溶剂提取物或单一成分的功效,而余甘子不同溶剂提取物抗氧化性能研究较少。本研究旨在评价余甘子不同溶剂提取物抗氧化活性及对H2O2诱导氧化损伤巨噬细胞的保护作用,为余甘子功能食品开发提供研究依据。
1 材料与方法
1.1 材料与试剂
余甘子,无限极(中国)有限公司;RAW264.7巨噬细胞,中国科学院典型培养物保藏委员会昆明细胞库。
DMEM高糖培养基,美国Hyclone公司;胎牛血清、噻唑蓝(methyl thiazolyl tetrazolium,MTT)、双抗(青霉素/链霉素)美国Gibico公司;超氧化物歧化酶、乳酸脱氢酶(lactate dehydrogenase, LDH)、谷胱甘肽(glutathione, GSH)、丙二醛(malondialdehyde, MDA),南京建成生物工程研究所;其余试剂均为分析纯。
1.2 仪器与设备
MK-3酶标仪,Thermo Labsystems公司;CKX41倒置显微镜,日本Olympus公司;AL104电子天平,梅特勒-托利多;FD1型冷冻干燥机,北京博医康技术公司;LC-15C高效液相色谱仪,日本岛津公司;SH-D真空泵,河南予华有限公司。
1.3 试验方法
1.3.1 余甘子不同溶剂提取物的制备
称取余甘子适量,以水、70%乙醇(体积分数)、正丁醇及乙酸乙酯分别进行提取实验。第1次提取料液比1∶10(g∶mL),提取时间2 h;第2次提取料液比1∶5(g∶mL),提取时间1 h。合并2次提取液,50 ℃真空浓缩后再冷冻干燥,制备余甘子不同溶剂提取物。每个实验重复3次,计算提取率,计算如公式(1)所示:
(1)
式中:m1为余甘子原料质量;m0为提取物干粉质量。
1.3.2 余甘子不同溶剂提取物体外抗氧化活性评价
1.3.2.1 还原能力
参考陈秋娟等[9]方法,以铁氰化钾法测定余甘子不同溶剂提取物还原能力。取不同浓度样品溶液(0.16~2.56 mg/mL,1 mL),加入0.2 mol/L 磷酸钠溶液(2.5 mL)和1%铁氰化钾(2.5 mL),50 ℃恒温水浴锅中暗处反应20 min,最后加入10%三氯乙酸(2.5 mL)。混合液在3 000 r/min下离心10 min,将上清液(2.5 mL)、双蒸水(2.5 mL)及0.1%三氯化铁(0.5 mL)振荡混匀,静置10 min,700 nm下测定吸光值,吸光值越大表明还原能力越强。以蒸馏水代替样品做空白对照,抗坏血酸作为阳性对照,每个样品3平行。
1.3.2.2 清除超氧阴离子自由基能力
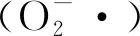

(2)
1.3.2.3 总抗氧化能力
参考HSU等[11]方法,采用钼酸铵法测定余甘子不同溶剂提取物总抗氧化能力。钼酸铵反应体系:0.988 g钼酸铵、0.919 g Na3PO4及6.516 g H2SO4溶于200 mL溶液中,待用。取不同质量浓度样品溶液(0.16~2.56 mg/mL,0.1 mL),加入1 mL钼酸铵反应体系,95 ℃水浴90 min,695 nm处测定吸光值,吸光值越大表明还原能力越强。以抗坏血酸作为阳性对照,每个样品3平行。
1.3.2.4 清除羟自由基能力
参考杨冰鑫等[12]和GIESE等[10]方法反应体系包括0.5 mL 1.5 mmoL/L FeSO4、0.35 mL 6 mmoL/L H2O2、0.15 mL 20 mmoL/L水杨酸钠及0.5 mL不同浓度桉叶多酚(0.16~2.56 mg/mL),37 ℃孵育1 h后562 nm测定吸光值A1;以不加样品,用去离子水代替样品在562 nm处测得的吸光值为A0;以去离子水代替6 mmoL/L的H2O2在562 nm 处测得的吸光值为A2。以抗坏血酸作为阳性对照,每个样品3平行。羟自由基清除率的计算如公式(3)所示:
(3)
1.3.3 余甘子不同溶剂提取物对H2O2诱导巨噬细胞氧化损伤的保护作用
1.3.3.1 细胞培养
本次试验采用细胞株为小鼠腹腔单核巨噬细胞RAW264.7细胞系,细胞培养基为DMEM完全培养基(10%胎牛血清,1%双抗),培养条件为37 ℃的恒温培养箱(5% CO2)。细胞每1~2 d换液,所有的操作都在无菌条件下进行。
1.3.3.2 余甘子不同溶剂提取物细胞毒性试验
将RAW 264.7细胞按5.0×104个/mL接种于96孔板,每孔200 μL,置于37 ℃、5% CO2条件下培养24 h。弃去上清液,加入不同浓度样品溶液处理细胞;对照组细胞加入完全培养基。培养24 h后,弃去上清液并以PBS清洗细胞2次,每孔加入100 μL 5 mg/mL MTT,培养箱中孵育4 h。弃去上清液后再加入150 μL 二甲基亚砜,振荡溶解10 min。450 nm下测定吸光值,细胞活性计算如公式(4)所示:

(4)
1.3.3.3 H2O2诱导巨噬细胞氧化损伤模型
参照1.3.3.2方法,将加入不同浓度样品溶液换成不同浓度H2O2溶液,计算细胞活性。
1.3.3.4 细胞T-SOD、LDH、GSH、MDA测定
将RAW 264.7细胞按2.0×105个/mL接种于6孔板,每孔2 mL,置于37 ℃、5% CO2条件下培养24 h。弃去上清液,试验组加入不同浓度样品培养液;阳性对照组加入抗坏血酸培养液;空白组和模型组加入完全培养基。孵育24 h,弃去上清液后加入H2O2溶液造模4 h。弃去上清液后,以PBS清洗细胞2次。将细胞匀浆后,参照试剂盒说明书测定细胞总超氧化物岐化酶(T-superoxide dismutase,T-SOD)活力和谷胱甘肽含量、丙二醛含量。
1.3.4 高效液相色谱法分析余甘子提取物重要成分
将余甘子提取物溶解后,制备成1 mg/mL储备液,过0.22 μm滤膜。色谱柱为DIKMA C18(250 mm×4.6 mm,5 μm);柱温37 ℃;流动相选择0.2%甲酸水溶液-甲醇体系;采用梯度洗脱,洗脱条件为:0~6 min,0~7%甲醇;6~16 min,7%~30%甲醇;16~41 min;30%~80%甲醇;41~50 min;80%~90%甲醇;进样量10 μL;检测器波长270 nm;流速为1 mL/min。
1.4 数据分析
实验采用SPSS 18.0进行单因素方差分析并用LSD法进行多重比较,数据结果以平均值±标准差表示,显著水平设置为P<0.05。
2 结果与分析
2.1 余甘子不同溶剂提取物提取率及总多酚、总黄酮含量
由表1可得,余甘子不同溶剂提取物提取率及总多酚、总黄酮含量差异较大。余甘子70%乙醇提取物和水提取物含量显著高于正丁醇和乙酸乙酯提取物提取率(P<0.05)。相似研究也表明余甘子水提取物和乙醇提取物含量显著高于乙酸乙酯和石油醚提取物[13],这可能与余甘子中极性物质(多糖、蛋白质类)有关,导致其在不同溶剂中的溶解性不同。此外,余甘子总多酚、总黄酮含量变化规律与提取率类似。余甘子水和70%乙醇提取物总多酚、总黄酮含量均显著高于正丁醇和乙酸乙酯提取物(P<0.05)。根据相似相溶原理,不同极性抗氧化成分在不同溶剂中溶解度是不同的,初步推断余甘子中总多酚和总黄酮以极性酚或黄酮类为主[14]。赵玉红等[15]同样发现刺蔷薇叶不同溶剂提取物总多酚含量高低顺序为80%乙醇>水>正丁醇。本次试验结果表明70%乙醇提取物提取率、总多酚及总黄酮含量均高于其他溶剂提取物(P<0.05),这也说明70%乙醇能有效提取余甘子中多酚和黄酮类物质。

表1 余甘子不同溶剂提取物得率及总多酚和总黄酮含量
2.2 余甘子不同溶剂提取物体外抗氧化活性评价
2.2.1 还原能力
实验以铁氰化钾法测定余甘子不同溶剂提取物还原能力,有报道指出抗氧化能力越强,其还原能力越高,吸光值越大。由图1可知,余甘子不同溶剂提取物还原能力与样品浓度呈量效关系,但同等样品浓度下低于抗坏血酸。总体来看,70%乙醇提取物还原能力略高于水提取物(P>0.05),而正丁醇和乙酸乙酯提取物还原能力显著低于水和70%乙醇提取物(P<0.05)。这也说明水或者70%乙醇提取物中含有更多抗氧化活性物质,能有效还原铁氰化钾,表现出更强的还原能力[16]。相似研究[17]指出苹果皮不同溶剂提取物还原能力大小为60%乙醇提取物>蒸馏水提取物>乙酸乙酯提取物。总之,余甘子不同溶剂提取物均表现出有效的还原能力,其中70%乙醇提取物还原能力最强。

图1 余甘子不同溶剂提取物还原能力
2.2.2 清除超氧阴离子自由基能力

图2 余甘子不同溶剂提取物对的清除作用
2.2.3 总抗氧化能力
实验通过钼酸酸法测定余甘子不同溶剂提取物总抗氧化能力,它能将Mo(Ⅳ)还原成Mo(Ⅴ),酸性条件下形成绿色的磷酸盐;695 nm下测得吸光值越大,说明总抗氧化能力越高[19]。实验结果表明不同浓度抗坏血酸组总抗氧化能力均高于等浓度下余甘子不同溶剂提取物组(P<0.05)。但余甘子不同溶剂提取物仍表现出一定总抗氧化能力,并呈现浓度依赖性增大(图3)。当样品浓度为2.56 mg/mL,70%乙醇提取物总抗氧化能力显著高于水组、正丁醇组及乙酸乙酯组(P<0.05)。总之,4种提取物总抗氧化能力大小排序为:70%乙醇>水>乙酸乙酯>正丁醇。
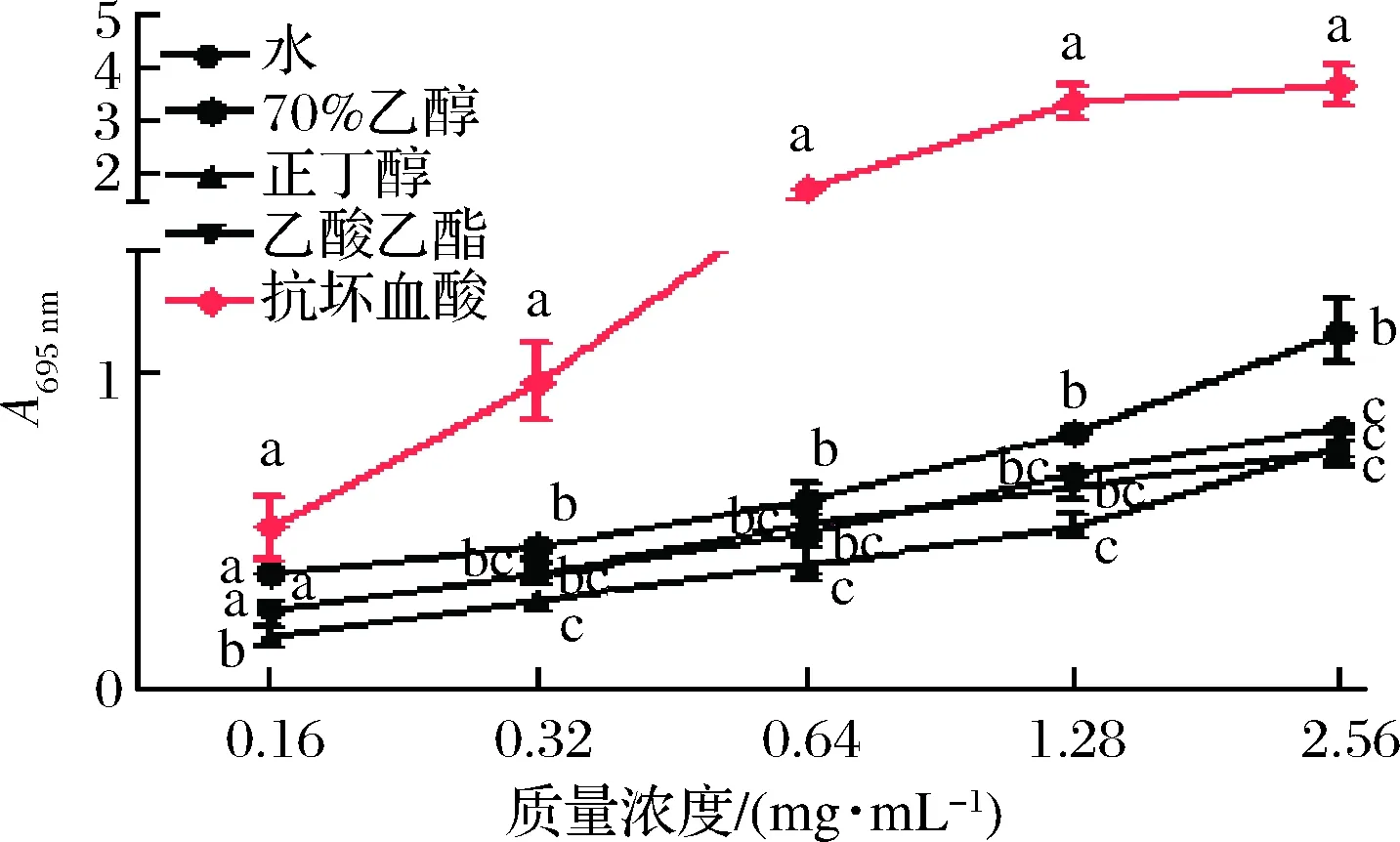
图3 余甘子不同溶剂提取物总抗氧化能力
2.2.4 羟自由基清除率
羟自由基(·OH)是生物体内活性很高的自由基之一,它能与绝大部分生物大分子发生反应,造成机体氧化损伤[20]。实验以水杨酸法测定余甘子不同溶剂提取物抗氧化活性,随着样品浓度增大,·OH清除能力越来越高(图4)。4种提取物对·OH清除率大小排序为70%乙醇>水>乙酸乙酯>正丁醇。有报道对余甘子乙醇提取物进行工艺优化和抗氧化活性评价,发现余甘子45%乙醇提取物对·OH的清除率优于茶多酚。本次试验中,等浓度下70%乙醇提取物表现出最高的·OH清除率,最高清除率为(82.66±4.86)%,这也说明余甘子中起到重要抗氧化效果的物质可能存在于70%乙醇提取物部分。

图4 余甘子不同溶剂提取物对·OH的清除作用
2.3 余甘子不同溶剂提取物对H2O2诱导氧化损伤的保护作用
2.3.1 余甘子不同溶剂提取MTT实验
实验研究不同浓度余甘子不同溶剂提取物(25~800 μg/mL)对RAW264.7细胞活性的影响。由图5可得,在25~100 μg/mL,余甘子不同溶剂提取物细胞活性均高于90%,对RAW264.7细胞无明显细胞毒性。因此,后续实验选用25、50及100 μg/mL不同溶剂提取物进行研究。

图5 余甘子不同溶剂提取物对RAW264.7细胞活性的影响
2.3.2 H2O2浓度筛选
H2O2是一种强氧化剂,因其操作简单、容易控制,常用于体外诱导细胞氧化损伤[21]。由图6可得,与对照组相比,不同浓度H2O2对RAW264.7细胞均有一定程度损伤(P<0.05)。当H2O2浓度为0.5 mmoL/L,RAW264.7细胞活性为(50.46±3.88)%;当H2O2浓度高于或低于0.5 mmoL/L时,细胞过低或者过高活性均不能有效建立H2O2诱导RAW264.7细胞氧化损伤模型。因此,实验选用0.5 mmoL/L H2O2开展后续细胞氧化损伤实验。
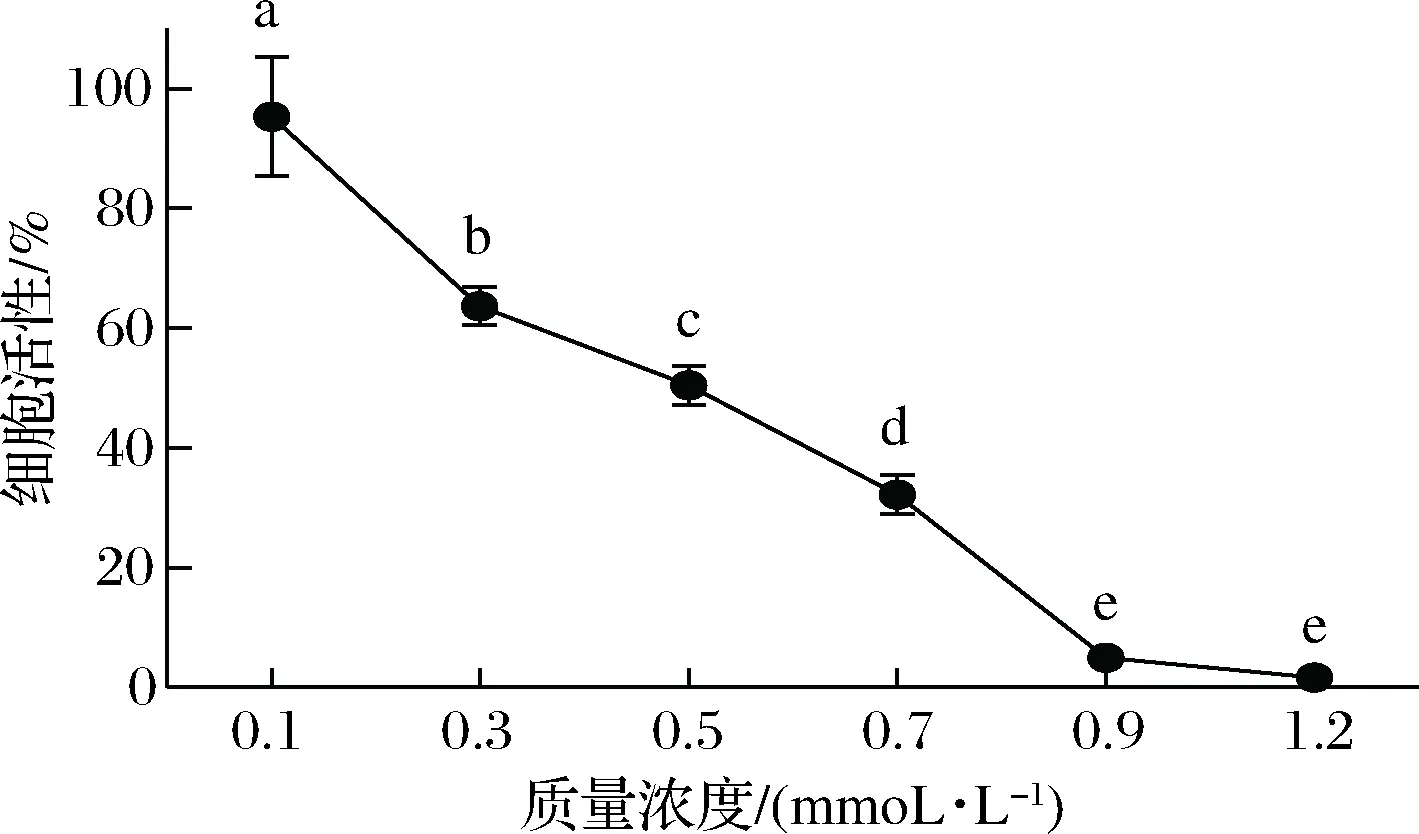
图6 H2O2对RAW264.7细胞活性的影响
2.3.3 余甘子不同溶剂提取物对RAW 264.7细胞中T-SOD活性的影响
T-SOD对维持机体氧化平衡起着重要的调节作用,它能有效催化超氧阴离子为H2O2和O2,是体内重要的抗氧化酶之一[22]。由图7可得,模型组T-SOD活性[(36.7±6.75) U/mg prot]显著低于对照组[(93.00±7.24) U/mg prot](P<0.01),说明H2O2诱导RAW264.7细胞造成强烈的氧化损伤,且余甘子不同溶剂提取物对细胞的保护作用呈现一定的剂量-浓度依赖效应和差异性。相比于模型组,水提取物和70%乙醇提取物中高浓度剂量组均能显著提高细胞内T-SOD活性(P<0.01),有效延缓H2O2诱导巨噬细胞的氧化损伤。其中高浓度70%乙醇提取物组T-SOD活性与对照组无显著差异(P>0.05)。相似研究[23]发现中高剂量组(80 μg/mL、100 μg/mL)马齿苋黄酮能有效提高H2O2诱导RAW264.7细胞中T-SOD活性,低浓度剂量组无显著影响(P>0.05)。这提示天然来源抗氧化物质需要达到一定浓度才能起到更好地延缓氧化损伤作用。此外,乙酸乙酯提取物组在100 μg/mL时T-SOD活性显著提高39.37%(P<0.05),而正丁醇各浓度组对细胞T-SOD活性无显著影响(P>0.05)。可见余甘子水和70%乙醇提取物能有效提高氧化损伤细胞中T-SOD活性,正丁醇和乙酸乙酯提取物效果较差。

图7 余甘子不同溶剂提取物对H2O2诱导RAW264.7细胞中T-SOD活性的影响
2.3.4 余甘子不同溶剂提取物对RAW 264.7细胞中LDH活性的影响
LDH广泛存在于体内,当细胞受损时LDH会大量释放,细胞内LDH分泌水平显著降低,它能有效反映细胞受到的氧化损伤程度[24]。由图8可得,模型组LDH活性[(416.62±37.58) U/mg prot]极显著低于对照组61.71%[(159.50±32.96) U/mg prot](P<0.01),这说明细胞受到氧化损伤后LDH发生了部分外泄。余甘子不同溶剂提取物处理细胞后,发现70%乙醇提取物组低、中、高浓度均能有效提高提高细胞LDH活性(P<0.05),而水、正丁醇及乙酸乙酯在中、高剂量组下起到相同保护作用。此外,余甘子不同溶剂提取物对细胞的保护作用呈现浓度依赖性,能有效预防或者延缓H2O2导致的细胞膜受损或者破裂,防止细胞内LDH外漏。

图8 余甘子不同溶剂提取物对H2O2诱导RAW264.7细胞中LDH活性的影响
2.3.5 余甘子不同溶剂提取物对RAW 264.7细胞中GSH含量的影响

图9 余甘子不同溶剂提取物对H2O2诱导RAW264.7细胞中GSH含量的影响
2.3.6 余甘子不同溶剂提取物对RAW 264.7细胞中MDA含量的影响
MDA是膜脂氧化重要的产物之一,其含量能够反映机体受自由基攻击水平程度,间接表明细胞膜系统受损程度[27]。由图10可得,细胞受到H2O2损伤后,模型组MDA含量为(64.65±13.38) nmol/mg prot,极显著高于对照组[(8.12±2.00) nmol/mg prot](P<0.01)。MDA是机体内脂质氧化的最终产物,代表脂质过氧化的水平[28]。经余甘子不同溶剂提取物处理后,细胞MDA含量呈剂量依赖性降低。与模型组相比,水提取物和70%乙醇提取物能极显著降低细胞中MDA含量(P<0.01);其中,100 μg/mL 乙醇提取物组MDA含量显著降低71.01%。此外,正丁醇和乙酸乙酯提取物高剂量组MDA含量比模型组分别降低24.79%和28.63%。李冲等[29]指出巫山神茶能降低损伤细胞中MDA含量,保护细胞膜结构及功能,起到抗氧化作用。本次试验也能说明余甘子不同溶剂提取物能降低自由基引起的脂质过氧化程度。综上,余甘子不同溶剂提取物一定程度上都能延缓H2O2氧化损伤,降低细胞内MDA含量,维持细胞氧化平衡。其中,70%乙醇提取物不同浓度组降低氧化损伤细胞中MDA含量最显著。

图10 余甘子不同溶剂提取物对H2O2诱导RAW264.7细胞中MDA含量的影响
2.3.7 余甘子乙醇提取物成分分析
通过上述化学和细胞抗氧化评价,发现余甘子70%乙醇提取物具有更加显著体外抗氧化活性,并对H2O2诱导的RAW264.7细胞起到最佳剂量依赖性的保护作用。通过高效液相色谱对比和文献对比分析,对余甘子70%乙醇提取物进行成分分析。以标准物质为参照,检测出4种主要多酚类化合物(图11):没食子酸(11.241 min)、柯里拉京(24.757 min)、鞣花酸(33.952 min)和槲皮素(37.885 min),含量分别为(18.07±0.21)、(9.90±0.26)、(12.21±1.53)、(1.80±0.04) mg/g。其中没食子酸是2015版《中国药典》中规定的余甘子药材标准评判物质,规定其含量不低于1.2%。本试验中检测出没食子酸含量为1.80%左右,说明余甘子质量已达药典标准。另柯里拉京、鞣花酸及槲皮素均是余甘子中重要活性物质,文献指出它们具有优异的抗氧化、抗炎、抗肿瘤等生理活性[30-31]。这也间接说明70%乙醇提取物富含的这些功能活性成分可能与其优异的抗氧化作用有一定关联性,但仍需要进一步研究证实。
图11 余甘子70%乙醇提取物高效液相色谱图
3 结论
综上所述,本文通过化学方法和H2O2诱导的RAW264.7细胞模型,初步评价余甘子不同溶剂提取物体外抗氧化活性。结果表明,余甘子不同溶剂提取物能有效清除超氧阴离子自由基和羟自由基,具有良好总还原能力和总抗氧化能力。同时,它能有效提高细胞内超氧化物歧化酶活力和乳酸脱氢酶活力,降低丙二醛值及提高谷胱甘肽含量。其中,70%乙醇提取物表现出最佳体外抗氧化活性和对氧化损伤细胞的保护作用,这可能与其富含没食子酸、柯里拉京、鞣花酸和槲皮素等抗氧化成分有关。本文初步探究余甘子不同溶剂提取物的体外抗氧化活性和对氧化损伤细胞的保护作用,但起抗氧化作用的物质基础仍需要进一步证实和研究,抗氧化作用保护机制有待深入开展。总体来说,本文为余甘子开发成功能活性明确的食品或保健食品者提供一定的研究基础和依据。
