水解豌豆蛋白特性表征及其与石榴皮提取物协同抗氧化作用探究
2020-09-03曹云刚李朝蕊韩馨蕊朱振宝冯莉黄峻榕熊幼翎
曹云刚,李朝蕊,韩馨蕊,朱振宝,冯莉,黄峻榕,熊幼翎
1(陕西科技大学 食品与生物工程学院, 陕西 西安,710021)2(肯塔基大学 动物与食品科学系,列克星顿 美国,40546)
豌豆蛋白是一种低脂低热量低致敏的植物蛋白,具有较为全面而均衡的营养成分,其氨基酸组成接近FAO/WHO推荐的标准模式,是一种天然优质的必需氨基酸来源[1]。适当的条件下酶法水解蛋白,不仅改善蛋白溶解度及加工特性、提高蛋白利用率,酶解得到的水解豌豆蛋白(pea protein hydrolysates, PPHs)的多肽或多肽片段还具有完整蛋白所不具备的一些生理活性,比如降血压、抑制血管紧张素转化酶(angiotensin-converting enzyme,ACE)活力及优良的抗氧化性等[2-5]。水解豌豆蛋白的成分及功能与水解前豌豆蛋白的构象、水解用酶的种类、水解条件等息息相关。加热处理、极端pH处理、超高压、超声波等[6-7]处理方式均可改变蛋白质的构象,进而影响水解酶与蛋白质的相互作用,最终获得结构、功能及活性不同的水解产物,极大地拓宽了其在食品领域中的应用[8]。
蛋白水解物具有较好的抗氧化性能,但基于食品体系及加工贮藏环境的复杂多变性,单独使用蛋白水解物作为抗氧化剂有时难以获得理想的效果。植物多酚作为优良的天然抗氧化剂,具有多种生理活性功能,在食品中的应用是目前的研究热点之一。张欣[1]研究发现,豌豆蛋白水解物与甘草提取物在乳状液体系中的抗氧化机制存在一定互补性,而CHARLTON等[9]的研究表明多肽能够抑制多酚化合物的抗氧化作用。因而蛋白水解物与多酚复配的抗氧化性能有待进一步研究。
石榴皮提取物具有抑菌、抗癌、抗病毒、抗氧化等作用,石榴皮多酚是石榴皮中主要的抗氧化活性物质[10]。然而目前石榴皮作为榨取石榴汁的副产物大都被丢弃,造成了资源的浪费。因此,本研究探究极碱处理及不同水解酶对豌豆蛋白水解物抗氧化性的影响,在此基础上探究豌豆蛋白水解物与石榴皮提取物复配的抗氧化活性,为合理利用豌豆蛋白资源,开发天然新型高效的复合抗氧化剂提供以理论依据及实验参考[11]。
1 材料与方法
1.1 材料与试剂
中豌八号青豌豆,沭阳唱亮园林绿化有限公司;石榴皮提取物(CSLP-A-708089),陕西嘉禾生物科技有限公司;风味蛋白酶、 复合蛋白酶,丹麦Novozymes公司中国分公司;大豆卵磷脂、组氨酸,上海源叶生物科技有限公司;2,4,6-三硝基苯磺酸,美国Ark Pharm公司;水溶性维生素E(Trolox),美国Sigma-Aldrich公司;二硫苏糖醇、丙烯酰胺/甲叉双丙烯酰胺30%(质量分数)溶液(29∶1)、过硫酸铵等,生工生物工程(上海)股份有限公司;正己烷、α-脱氧核糖、2,2′-联氮-双-3-乙基杂兵噻唑啉-6-磺酸(2,2′-azino-bis-(3-ethylben zothiazoline-6-sulfonic acid,ABTS)二铵盐等试剂均为分析纯,天津市科密欧化学试剂有限公司。
1.2 仪器与设备
高速多功能粉碎机,武义海纳电器有限公司;QLM-90k对撞式气流磨粉机,上虞市和力粉体有限公司;HR/T20MM立式高速冷冻离心机、水分测定仪,湖南赫西仪器装备有限公司;冷冻干燥机,上海比朗仪器制造有限公司;自动凯氏定氮仪、SE-A6全自动脂肪测定仪,济南市阿尔瓦仪器有限公司; Mini-PROTEAN 3 Cell电泳仪,美国 Bio-Rad 公司;电热恒温干燥箱,上海一恒科学有限公司。
1.3 实验方法
1.3.1 豌豆分离蛋白(pea protein isolate, PPI)的制备及其性质测定
(1)PPI的制备
参照JIANG等[6]的方法,称取5 kg青豌豆,40 ℃烘干后用多功能粉碎机破碎去皮并粉碎为30~300目的粗粉,再经过气流磨粉机处理20 min得到20目左右的豌豆细粉。用正己烷-乙醇混合溶剂(体积比10∶1)对豌豆细粉进行2次脱脂处理。干燥后的脱脂豆粉按1∶10(g∶mL)的料液比与超纯水混合,用2 mol/L NaOH调节pH至8.0并搅拌2 h,在4 ℃下以3 300×g离心30 min。离心后的上清液用2 mol/L HCl调节pH至4.5,以3 300×g冷冻离心20 min后用超纯水洗涤2次,4 740×g离心10 min。最终以5倍的超纯水将沉淀分散,再用2 mol/L NaOH调节pH至7.0。样品经冷冻干燥并密封后于4 ℃保存。
(2)PPI性质测定
水分含量测定:直接干燥法[12];蛋白质含量测定:凯氏定氮法[13];灰分含量测定:恒重法[14];脂肪含量测定:索氏提取法[15]。
1.3.2 PPHs的制备
豌豆蛋白极碱处理:参照JIANG等[6]的方法,用2 mol/L NaOH调节蛋白水溶液(20 g/L)pH值至12.0并保持1 h,使蛋白结构部分展开;再将溶液pH值调回至7.0,保持1 h使蛋白结构重新折叠。
PPHs的制备:参照张欣等[3]的方法,将未处理和加碱处理(pH 12,1 h)的20 g/L豌豆蛋白水溶液分别同风味蛋白酶和复合蛋白酶在50 ℃水浴作用30 min(酶与蛋白质量比为1∶100)[16,23]。水解结束后在80 ℃处理15 min灭酶,待冷却到室温后将pH调节至7.0。水解物在9 010×g离心10 min除去沉淀,冷冻干燥后4 ℃密封保存待用。
1.3.3 PPHs凝胶电泳
参照LIU等[17]的方法,在非还原条件下进行聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)实验,分离胶浓度为12%,浓缩胶浓度为5%。将样品稀释为4 mg/mL,与样品缓冲液等体积混合后,于沸水浴加热3 min后立即冷却,每孔上样量为15 μL。
1.3.4 PPHs性质测定
(1)水解度测定[18]:取200 μL PPHs样品溶液(4 mg/mL)与2 mL 0.1% SDS 混合,再加入1 mL 2,4,6-三硝基苯磺酸溶液(0.01%)充分混匀,50 ℃水浴中避光反应1 h后,加入2 mL Na2SO3溶液(0.1 mol/L)终止反应,取出并冷却至室温放置15 min,于420 nm处测定吸光度值。以2 mmol/L亮氨酸做标准曲线,水解度表示为蛋白水解液中游离氨基含量与蛋白完全水解后所含氨基含量之比。豌豆蛋白完全水解后氨基酸含量为4.37 mmol/g。
(2)溶解度测定[19]:将蛋白水解液(2 mg/mL)在5 000×g离心15 min后,采用双缩脲法测定上清液中蛋白含量。蛋白溶解度以上清液中蛋白含量占总蛋白含量(2 mg/mL)百分比表示。
1.3.5 PPHs抗氧化能力测定
(1)ABTS自由基清除能力:参照LIU等[17]的方法,取20 μL PPHs样品溶液与1 980 μL ABTS自由基工作液振荡混合,30 ℃条件下避光反应10 min,734 nm处测定吸光度值AS。以超纯水做空白测定吸光度值Ab。以Trolox做标准曲线,清除能力以Trolox当量(mmol/L)表示。ABTS自由基清除率计算如公式(1)所示:
(1)
(2)羟自由基清除能力:配制20 mg/mL PPHs样品溶液,参照周媛媛等[20]的描述,采用α-脱氧核糖法测定·OH清除率。
(3)1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力[21]:配制20 mg/mL的PPHs样品溶液,将1.5 mL样品和等体积0.1 mmol/L DPPH无水乙醇溶液振荡混合,于30 ℃条件下反应30 min后于517 nm处测定吸光度值AS,同时以样品溶剂为空白测定其吸光度值Ab。
(4)Fe2+螯合能力[22]:取1 mL PPHs样品溶液(20 mg/mL)与3.7 mL超纯水和0.1 mL 2 mmol/L FeCl2混合,反应3 min后加入0.2 mL 5 mmol/L菲啰嗪,混合均匀。空白组用超纯水代替待测样品。室温放置10 min,用超纯水调零,在562 nm处读取吸光值。
(5)抑制脂质体氧化能力:参照ZHANG等[24]的方法,取0.8 mL待测PPHs样品溶液(20 mg/mL)和4 mL 脂质体悬浊液混合均匀,加入0.1 mL FeCl3和0.1 mL抗坏血酸诱发脂质体氧化。通过测定硫代巴比妥酸反应物(thiobarituric acid reative substances,TBARS)生成量,每升脂质体悬浊液所含丙二醛的毫克数(mg/L)表示。空白以样品溶剂代替待测样品。计算如公式(2)所示:
(2)
式中:A532,样品组在532 nm的吸光值;VS,待测样品的体积0.8 mL; 9.48,由摩尔消光系数152 000 L/(mol·cm)转换而得。
1.3.6 石榴皮提取物对PPHs抑制脂质体氧化作用的影响
上述实验发现,加碱前处理所得PPHs具有更好的抗氧化能力,因而本实验在脂质体体系中继续探究石榴皮提取物与加碱前处理所得PPHs复配是否具有协同效应。配制4种混合物样品(包含4 mg/mL加碱1(或2)PPHs、50(或100) μg/mL石榴皮提取物)。将混合物样品分别添加到脂质体悬浊液后,再加入0.1 mL FeCl3和0.1 mL抗坏血酸诱发脂质体氧化[1]。样品测定方法与1.3.5中抑制脂质体氧化测定方法相同。PPHs与PE抑制TBARS生成的协同率计算如公式(3)所示:
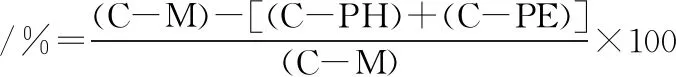
(3)
式中:C,PH,PE和M分别代表空白组、PPHs、PE、PPHs和PE的混合物对于TBRAS生成的抑制能力。
1.4 数据统计分析
本研究中所有实验均设置2~3次重复,使用Statistix 9.0分析软件的一般线性模型程序进行方差分析,采用LSD全配对多重比较进行显著性分析(P<0.05),采用SigmaPlot 12.5软件进行数据绘图。
2 结果与分析
2.1 PPI组分分析
对PPI的组分进行分析,实验结果表明PPI中蛋白质含量为92.7%,水分含量为3.71%,灰分含量为4.89%,脂肪含量小于0.5%。
2.2 PPHs的性质
2.2.1 SDS-PAGE
由图1可知,加碱前处理及水解酶种类对PPI的水解影响非常显著。加碱前处理显著提高了2种酶对PPI的水解效果,尤其是提高了复合蛋白酶对PPI的水解效果,其水解产物分子质量均较小且分布范围较窄。极端pH处理使得蛋白分子结构展开,导致埋藏于蛋白内部的活性基团暴露出来,增加了蛋白酶作用位点,因而提高了蛋白酶水解效果。风味蛋白酶和复合蛋白酶对PPI的水解能力较弱,所得水解产物中仍有较多高分子质量片段,且水解产物的分子质量分布相对较宽。2种酶的水解产物具有明显的差异。本实验结果类似,张欣等[3]及PEA-RAMOS等[16]的研究结果也表明蛋白酶种类是影响水解物成分的重要因素。
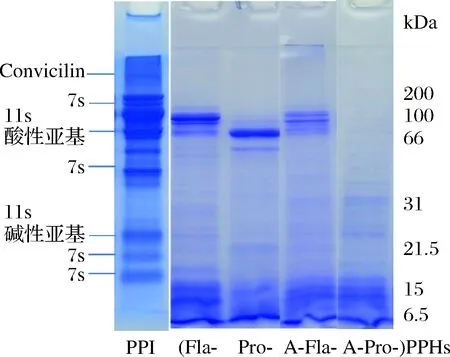
图1 PPI和不同PPHs的聚丙烯酰胺凝胶电泳
2.2.2 水解度和溶解度
(1)水解度
由图2可知,加碱前处理和水解酶种类对于豌豆分离蛋白的水解度有明显的影响。PPI经过加碱预处理后,水解程度显著提高。极端碱性处理下,蛋白质结构发生一定的变化,保留了大部分二级结构,三级结构发生较大变化,其原始结构中包裹的部分活性基团或特殊位点暴露,与水解酶相应结合能力增加[3]而水解效率得到了有效提高,形成了更多小肽段,这与SDS-PAGE的实验结果基本一致。风味蛋白酶对PPI的水解度高于复合蛋白酶的水解度,二者对加碱预处理PPI的水解度相当,这与SDS-PAGE的实验结果并不完全一致。ADLER-NISSEN[25]研究认为大分子多肽的空间位阻作用可以影响游离氨基与TNBS的相互作用,从而影响了水解度的准确测定。
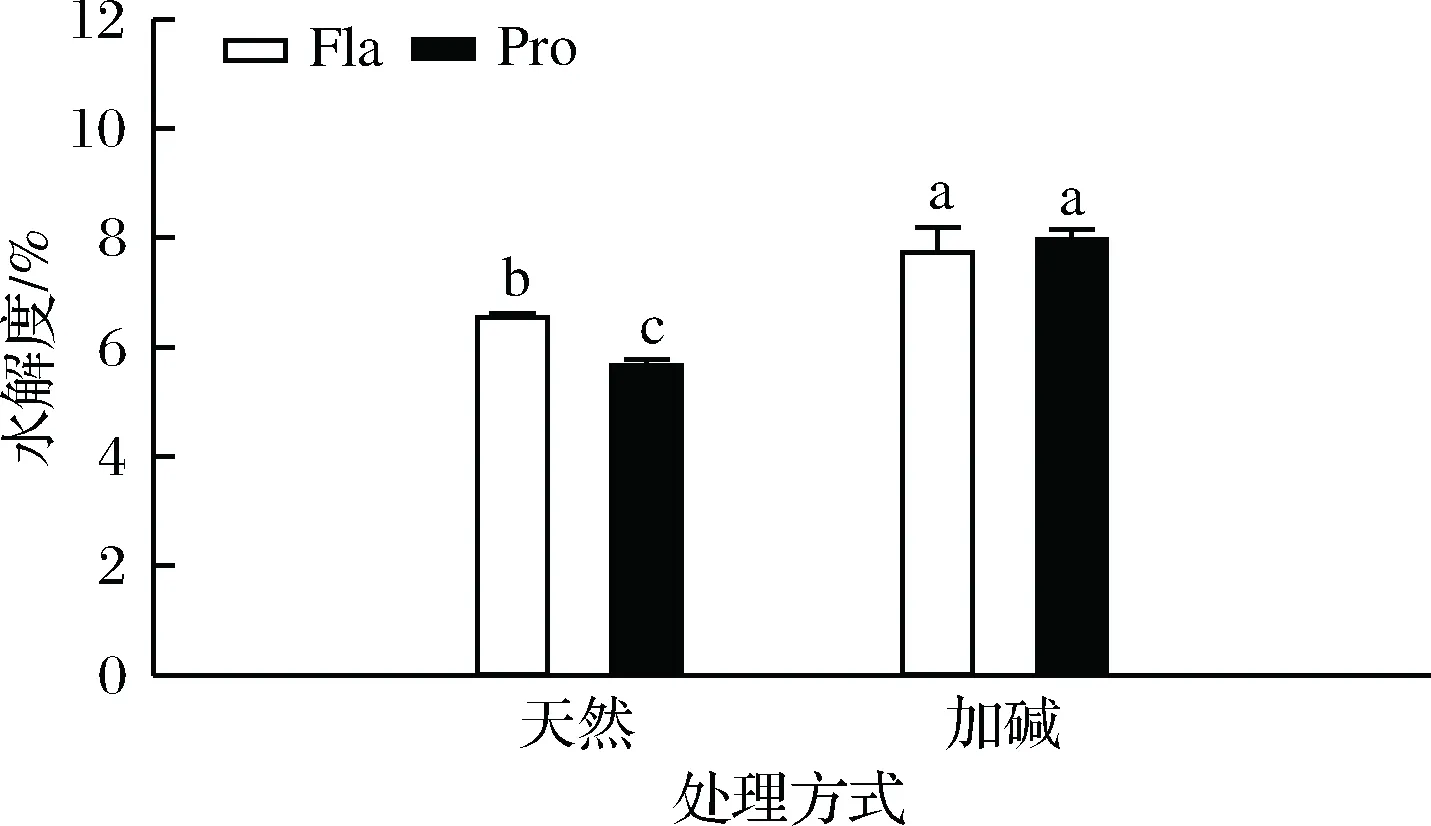
图2 不同处理对PPI水解度的影响
(2)溶解度
由图3可知,相比天然处理,加碱处理略微提高了蛋白水解物的溶解度,这与蒋将等的实验结果一致[26]。当前处理方式相同时,复合蛋白酶水解物溶解度更高,其原因可能在于不同蛋白酶的作用位点不同,酶解所得水解物的组成和结构也不同。

图3 不同处理对PPHs溶解度的影响
2.3 水解豌豆蛋白的抗氧化能力
2.3.1 自由基清除能力
由图4可知,加碱前处理显著提高了所得PPHs的3种自由基清除能力(P<0.05)。这可能是由于加碱处理导致豌豆蛋白分子适当展开,暴露出埋藏于天然蛋白内部的活性基团,增加了与蛋白酶的作用位点,提高了蛋白水解度,并生成了许多小分子质量的新肽段。一般来说分子质量较小的多肽具有更好的自由基清除能力,这与其他文献的报道类似[27-28]。水解酶种类对PPHs的自由基清除能力影响也很显著,整体而言复合蛋白酶水解物的体现出了更高的自由基清除能力,这和不同酶类与蛋白作用位点不同从而导致水解产物组分及水解度等迥异有关。
2.3.2 Fe2+螯合能力
过渡金属离子如Fe2+是重要的氧化诱发剂,可以诱发脂肪及蛋白等食品分子的氧化,导致食品化学稳定性及感官品质下降。Fe2+螯合能力是评价氧化剂抗氧化性能常用的方法。Fe2+能与菲啰嗪结合形成紫色复合物,在562 nm波长处有最大光吸收值。当金属离子螯合剂存在时,竞争性结合Fe2+导致紫色复合物形成量减少,吸光度值降低。由图4-d可知,与自由基清除能力趋势相一致,加碱前处理能够显著提高PPHs螯合Fe2+的能力;复合蛋白酶酶解得到的PPHs螯合Fe2+的能力明显优于风味蛋白酶作用,这可能是由于复合蛋白酶具有更加宽泛的底物特性,更有利于获得具有较强螯合金属离子能力的酶解产物[22]。
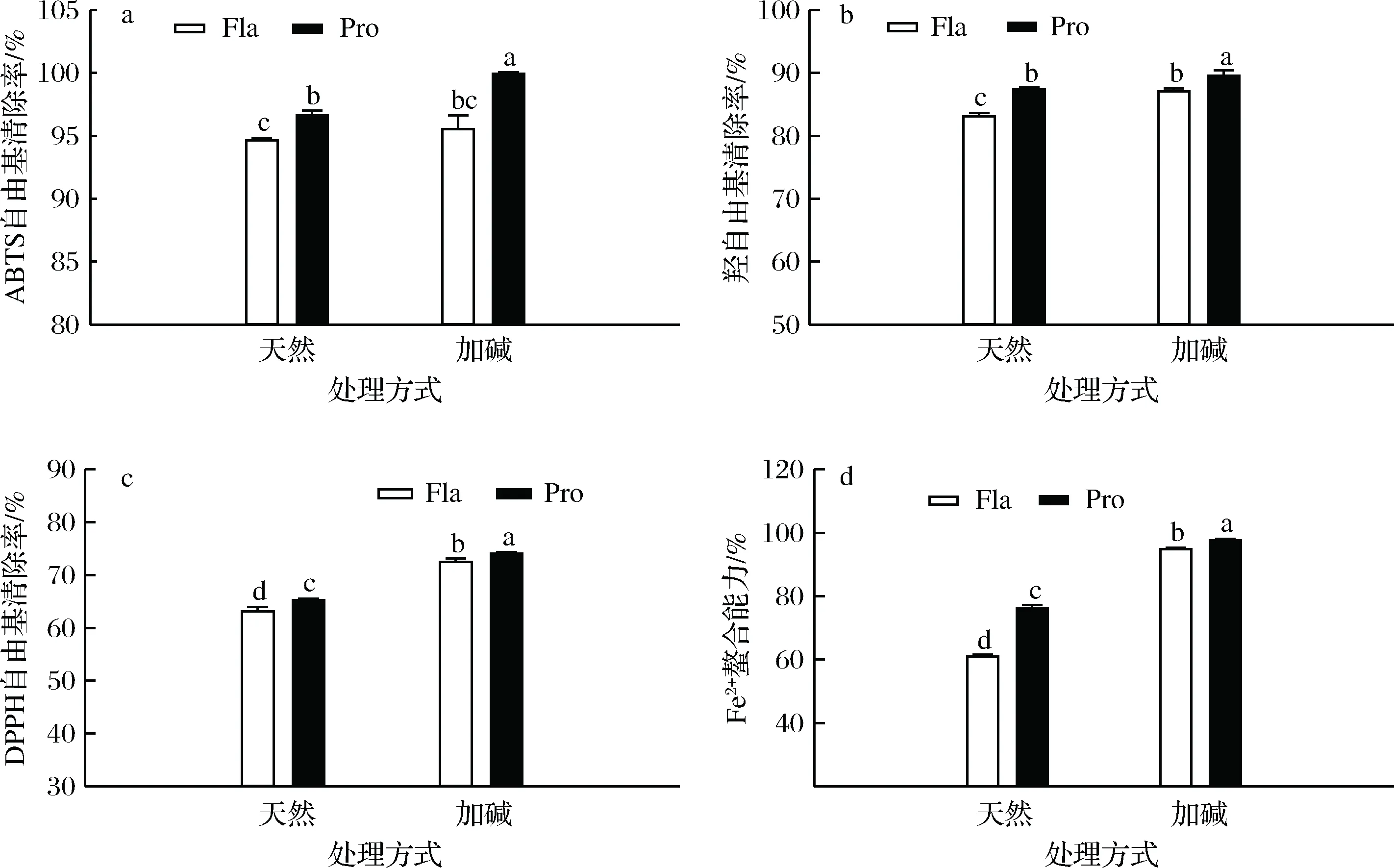
图4 不同处理对PPHs抗氧化能力的影响
2.3.3 抑制脂质体氧化能力
脂质体是一种人工合成的具有磷脂双层结构的颗粒,作为模型被广泛用于探究抗氧化剂在食品体系中的应用具有很大的研究潜力[1]。如图5所示,经诱导氧化后空白组的TBARS值约为0.8 mg/mL,各种类型的PPHs均具有一定的抑制脂质体氧化作用,但效果具有明显差异。加碱前处理显著提高了所得PPHs的抑制脂质体氧化作用,相比风味蛋白酶水解物,复合蛋白酶水解物具有更好的抑制效果。整体趋势与PPHs自由基清除能力及Fe2+螯合能力趋势相一致。PPHs的抗氧化能力与其氨基酸组成和序列密切相关,前人研究表明具有较强抑制 TBARS 生成能力的 Fro-PPHs含有更多可电离 R 残基[1],此外,水解前的加热处理能促进蛋白结构适度展开,有利于更多具有自由基清除能力的活性氨基酸残基暴露[1]。但需要注意的是蛋白水解物抑制脂肪氧化的作用机制主要体现在两方面[3,17]。在化学方面PPHs作为自由基清除剂、氢(电子)供体或过渡金属离子螯合剂可以阻断自由基链反应的发生;在物理方面,PPHs可以在脂肪球表面形成一层物理保护膜,在一定程度上阻止自由基与脂肪的接触进而抑制脂肪的氧化。因而,PPHs对脂质体中脂肪氧化的抑制作用是综合作用的结果,除了化学方面的抗氧化作用以外,可能还与不同类型PPHs在脂肪可能表面的分散情况不同有关[29]。
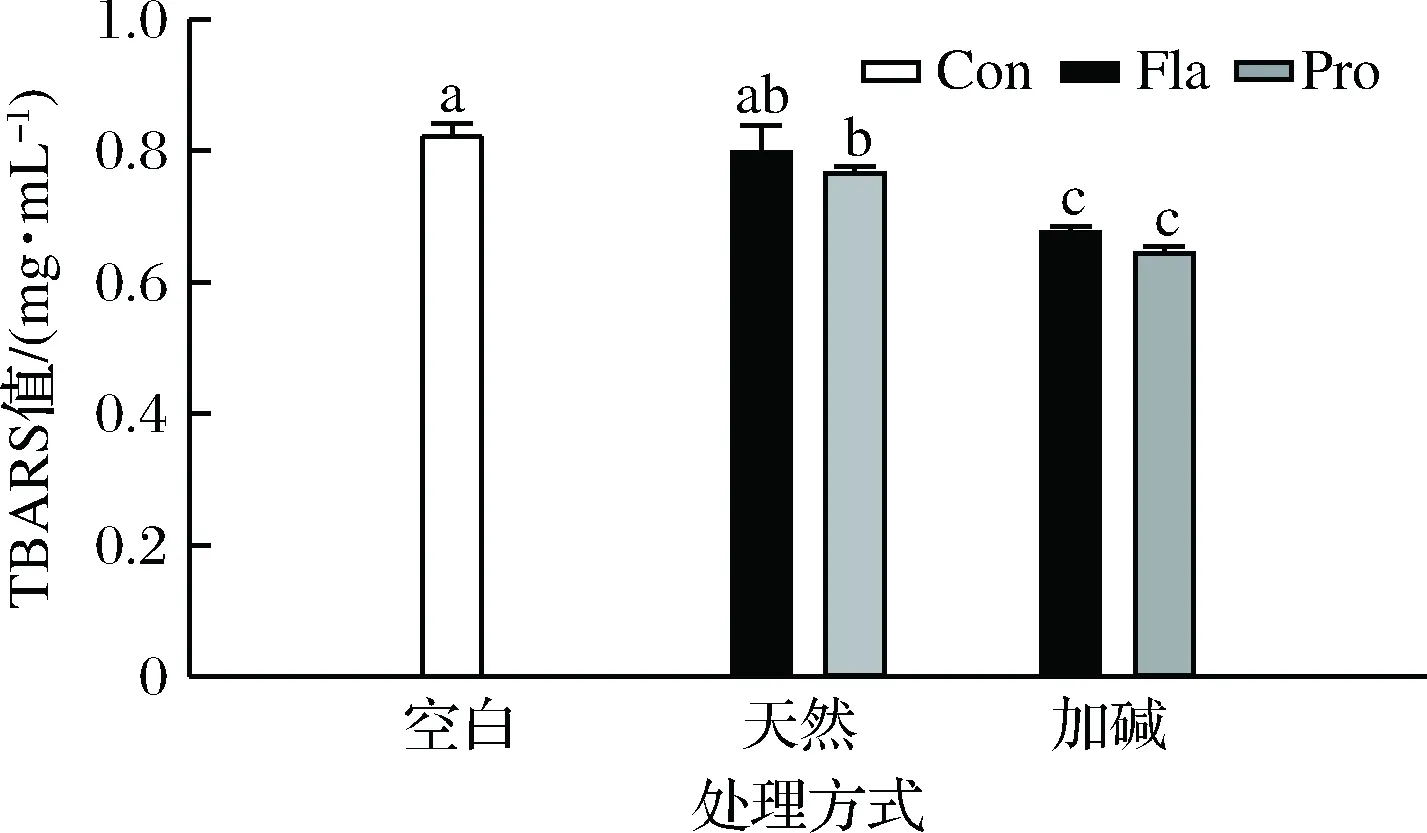
图5 不同PPHs抑制脂质体氧化的能力
2.4 石榴皮提取物(pomegrante peel extract,PE)对A-PPHs抗氧化能力的影响
由前面的实验结果可知,经加碱前处理所得的A-PPHs具有更好的抗氧化能力,在此我们选择A-PPHs作为代表,在脂质体体系中进一步探究了石榴皮提取物对PPHs抗氧化能力的影响。由图6可知,石榴皮提取物(PE)、加碱处理得到的风味蛋白酶水解物(A-Fla-PPHs)和复合蛋白酶(A-Pro-PPHs)均具有明显的抑制脂质体氧化能力。石榴皮提取物富含酚类物质而蛋白水解物含有大量的可电离R残基二者均具有一定的自由基清除能力及金属离子螯合能力,因而可以抑制脂肪氧化[1]。PE与PPHs复配使用的效果均优于PPHs单独使用(即“1<1+1”),且石榴皮提取物浓度越高抗氧化效果越好;但PE与A-Fla-PPHs复配使用的协同率均为负值,即为“1+1<2”;而PE与A-Pro-PPHs复配使用具有较好的协同增效作用,即“1+1>2”。其中加碱前处理得到的复合蛋白酶水解物A-Pro-PPHs与100 μg/mL的石榴皮提取物复配使用时,协同效果最好,协同率达24.22%。与本研究结果类似,张欣研究发现不同PPHs与甘草提取物在脂质体体系中也存在协同或拮抗效应,蛋白酶的特异性可能导致了PPHs的分子质量、氨基酸序列等不同,从而影响其在脂质体体系中的分布及其与LE之间的相互作用,最终导致其与LE复配使用时呈现协同或拮抗效应[1]。
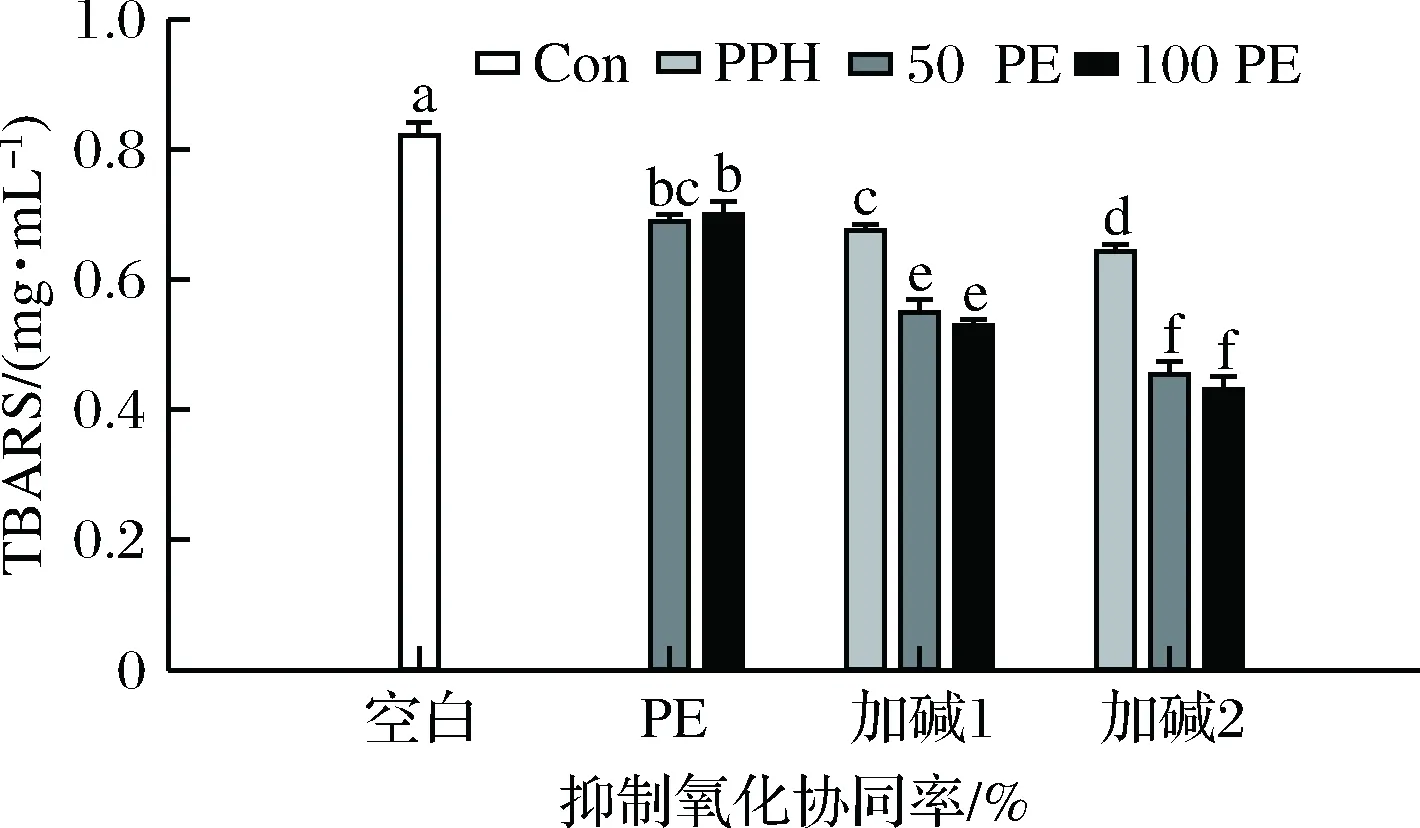
图6 不同浓度PE对A-PPHs抑制脂质体抗氧化能力的影响
3 结论
前处理方式和水解酶种类对于水解豌豆蛋白的性质及抗氧化性能有明显的影响。加碱预处理能够有效地提高豌豆蛋白的水解度、溶解度及水解产物的抗氧化性能。整体来看,与风味蛋白酶水解物相比,复合蛋白酶水解物具有更好的水解度、溶解度及抗氧化性能。单独使用PPHs时,加碱预处理豌豆蛋白复合蛋白酶水解物抑制脂质体氧化效果最佳。石榴皮提取物与PPHs复配使用的抑制脂质体氧化的效果均优于PPHs单独使用(即“1<1+1”),且石榴皮提取物浓度越高抗氧化效果越好;但PE与A-Fla-PPHs复配使用的效果为“1+1<2”;而PE与A-Pro-PPHs复配使用具有协同增效作用(即“1+1>2”)。
