PTTG1IP在甲状腺滤泡上皮细胞起源肿瘤中的表达及意义
2020-09-03刘志敏刘天卿王红龙
刘志敏,刘天卿,王红龙,刘 楠
(1.大连市友谊医院 病理科,辽宁 大连 116001;2.大连医科大学附属第二医院 内分泌1科,辽宁 大连 116027)
PTTG1IP(pituitary tumor transforming gene binding factor, PBF/PTTG1IP)为一种原癌基因,于2000年被Chien和Pei等人首次发现[1]。PTTG1IP是调节细胞周期的重要分子,主要调节细胞从分裂中期向后期的转化,并控制染色体单体的释放[2]。因此,PTTG1IP功能异常,可以导致细胞增殖异常。在体内实验中已证实,PTTG1IP具有转化功能,可诱导无胸腺的裸鼠在皮下形成高度恶性的肿瘤[3]。PTTG1IP过表达已在乳腺癌等肿瘤中检测到[4]。
PTTG1IP蛋白功能多样,在甲状腺滤泡上皮细胞中,除调控细胞增殖外,还具有调节甲状腺滤泡细胞的钠碘同向转运体(sodium iodide symporter, NIS)和单羧酸转运蛋白8(monocarboxylate transporter 8, MCT8)功能的作用[5-6],从而影响滤泡细胞对碘的摄取。部分研究显示:在甲状腺PTTG1IP特异性过表达的转基因小鼠中,甲状腺滤泡细胞基因稳定性下降[7],甲状腺明显增大并出现甲状腺滤泡增生性病变—巨滤泡腺瘤[8]。这些研究提示,PTTG1IP蛋白过表达可能与甲状腺滤泡性肿瘤有关。目前,关于PTTG1IP蛋白在人甲状腺滤泡上皮起源的不同肿瘤中的表达情况及意义尚不清楚。有研究者发现,PTTG1IP蛋白在乳头状癌组织中的表达高于正常甲状腺组织[9]。
甲状腺肿瘤中,滤泡上皮起源的肿瘤最为常见,主要包括良性肿瘤—滤泡性腺瘤、分化型的癌—乳头状癌和滤泡癌、差分化的癌—未分化癌等。不同甲状腺滤泡上皮起源的肿瘤,不仅在组织学形态、生物学行为等方面不同,分子表型也具有很大差异。例如,甲状腺乳头状癌具有较高的BRAFV600E突变,已经用于协助临床病理诊断及提示预后;而滤泡癌则具有较高的RAS和TP53突变[10]。分析比较甲状腺滤泡上皮起源的不同肿瘤的分子表型,对认识不同肿瘤的发生发展机制、对不同肿瘤进行正确诊断及治疗具有重要的意义。
本研究收集了多种不同类型的甲状腺组织,包括正常甲状腺组织、滤泡性腺瘤、乳头状癌、滤泡癌和未分化癌,检测PTTG1IP蛋白在各类组织中的表达情况,分析PTTG1IP蛋白在甲状腺滤泡上皮起源的不同肿瘤发生发展中的作用及临床意义。
1 材料和方法
1.1 材 料
收集大连市友谊医院与大连医科大学附属第二医院2005—2019年间的甲状腺石蜡包埋标本。甲状腺滤泡性腺瘤患者23例,其中男性9例,女性14例,年龄36~68岁;甲状腺乳头状癌患者65例,其中男性16例,女性49例,年龄23~78岁,其中25例切取距癌肿>1 cm的正常甲状腺组织作为癌旁正常组织;甲状腺滤泡癌患者19例,其中男性10例,女性9例,年龄31~74岁;甲状腺未分化癌患者18例,其中男性8例,女性10例,年龄54~86岁。所有病理参数包括组织学类型、浸润范围、淋巴结转移等情况均由两位有经验的病理医师独立完成。依据2017年版内分泌器官肿瘤WHO分类,结合患者临床病理资料,对患者进行TNM分期。
1.2 免疫组织化学方法
兔抗人PTTG1IP多克隆抗体购自美国剑桥Abcam公司、二抗(MaxVision-HRP)及DAB显色液均购自中国福州迈新生物技术公司。
所有病例组织均经10%中性福尔马林固定、常规石蜡包埋、4 μm连续切片,按照如下步骤进行操作:二甲苯Ⅰ10 min、二甲苯Ⅱ10 min、无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、95%乙醇2 min、85%乙醇2 min、75%乙醇2 min、H2O2阻断内源性过氧化物酶10 min、Tris-EDTA缓冲液(pH 9.0)微波抗原修复 15 min、一抗室温孵育1 h(1∶250)、二抗10 min、DAB显色、流水冲洗 15 min、苏木素复染、常规脱水、透明、封片。用已知的阳性切片作阳性对照,PBS代替一抗作阴性对照。
1.3 结果判定
上皮细胞膜、细胞浆或细胞核出现淡黄色颗粒判定为阳性细胞。根据阳性细胞的染色强度和比例对每张切片分别进行评分。染色强度评分:无着色,0分;淡黄色,1分;棕黄色,2分;黄褐色,3分。阳性细胞比例评分:无阳性细胞,0分;1%~25%,1分;26%~50%,2分;≥51%,3分。两个得分相乘,最后得分≤3分记为阴性病例,>3分记为阳性病例。
1.4 统计学方法
采用χ2检验分析甲状腺不同组织类型中PTTG1IP蛋白表达的差异性及PTTG1IP蛋白表达与患者临床病理特征间的关系。应用SPSS 25.0统计软件处理数据,P<0.05为差异有统计学意义。
2 结 果
2.1 PTTG1IP蛋白在甲状腺不同组织类型中的表达情况
PTTG1IP蛋白在甲状腺癌癌旁正常组织、滤泡性腺瘤、乳头状癌、滤泡癌及未分化癌的肿瘤细胞中均有表达。PTTG1IP蛋白在癌旁正常组织表达率为28%,在滤泡性腺瘤组织中为30.43%,在乳头状癌组织中为61.54%,在滤泡癌组织中为31.58%,在未分化癌组织中为22.22%。
PTTG1IP蛋白在甲状腺乳头状癌组织中的表达率显著高于癌旁正常组织(P=0.004)、滤泡性腺瘤组织(P=0.010)、滤泡癌组织(P=0.021)和未分化癌组织(P=0.003)。见表1和图1。
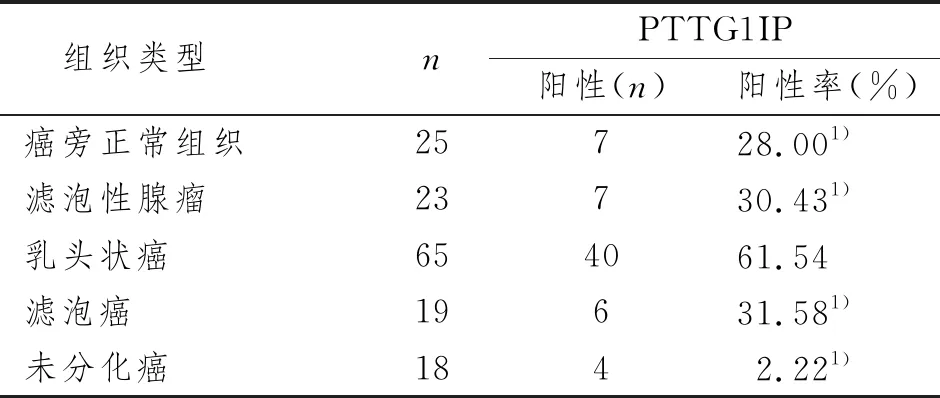
表1 PTTG1IP蛋白在甲状腺不同组织类型中的表达

A: 正常甲状腺;B:滤泡性腺瘤;C:乳头状癌;D:滤泡癌;E:未分化癌图1 甲状腺不同组织类型中PTTG1IP蛋白的表达(×400)Fig 1 Expressions of PTTG1IP protein in different types of thyroid tissue (×400)
2.2 PTTG1IP蛋白在甲状腺滤泡上皮起源的不同肿瘤中的表达特点
PTTG1IP蛋白不仅在具有经典形态的甲状腺乳头状癌中阳性表达,在本实验所包含的2例滤泡亚型乳头状癌也均阳性表达,阳性表达的40例中,26例为强表达,14例为中等强度表达;在PTTG1IP蛋白阳性表达的6例滤泡癌中,仅有1例为强表达,其余5例均为中等强度表达;在PTTG1IP蛋白阳性表达的4例未分化癌中,仅有1例为强表达,其余3例均为中等强度表达。
2.3 PTTG1IP蛋白表达与甲状腺乳头状癌患者临床病理特征的关系
在甲状腺乳头状癌中,≥55岁年龄组的PTTG1IP蛋白表达率(84.00%)显著高于<55岁年龄组的表达率(47.75%);有甲状腺外侵犯组表达率(75.00%)显著高于无甲状腺外侵犯组的表达率(41.67%);TNM分期Ⅲ-Ⅳ组的表达率(88.24%)显著高于TNM分期Ⅰ-Ⅱ组的表达率(52.08%)。见表2。
甲状腺滤泡癌及未分化癌的PTTG1IP蛋白表达率与患者临床病理特征之间均无明显相关性(P>0.05)。
3 讨 论
甲状腺滤泡上皮起源的肿瘤组织类型多样,均具有各自典型的组织学形态。滤泡腺瘤为单发的、具有完整包膜的、滤泡大小较一致的良性甲状腺肿瘤;乳头状癌为显示滤泡分化形态及具有特征性的核的分化型甲状腺癌;滤泡癌为具有滤泡分化的、侵犯包膜和/或血管的、且缺乏乳头状癌特征性核的分化型甲状腺癌;未分化癌为全部或部分由未分化细胞构成、免疫组化和超微结构特征表明具有滤泡上皮分化的癌。甲状腺滤泡上皮起源的不同肿瘤亦具有不同的生物学行为:乳头状癌的扩散方式主要为局部淋巴结转移,滤泡癌主要为血行播散,而未分化癌则表现为广泛的局部侵袭及远处转移。因此,阐明甲状腺滤泡上皮起源的不同肿瘤的发生发展机制及对不同肿瘤进行正确识别具有重要的意义。

表2 PTTG1IP蛋白表达与甲状腺乳头状癌患者临床病理特征间的关系
PTTG1IP蛋白在人类多种正常组织中表达,其氨基酸肽序列与人类其他蛋白无明显同源性,但是在多物种间具有高度保守性,提示其可能具有独特的功能,并在物种进化中发挥重要作用。学者对PTTG1IP蛋白与肿瘤关系的关注始于一项垂体肿瘤的研究。该项研究显示,PTTG1IP蛋白在垂体肿瘤组织中的表达高于正常垂体组织,提示PTTG1IP可能参与肿瘤的发生[11]。随后,研究者发现PTTG1IP蛋白在多种恶性肿瘤中存在过表达,包括结肠癌和乳腺癌等[12]。除蛋白过表达外,基因突变亦可能引起PTTG1IP功能异常。但一项菌落形成实验显示,PTTG1IP基因突变并不能引起菌落生长,因此,在癌症的发生中,PTTG1IP蛋白过表达可能是比基因突变更为重要的分子事件[13]。
在本研究中,我们检测了正常甲状腺组织、滤泡性腺瘤、乳头状癌、滤泡癌及未分化癌组织中PTTG1IP蛋白的表达情况。结果显示:PTTG1IP蛋白在检测的所有甲状腺组织类型中均有表达,但仅在乳头状癌组织中表达明显升高。PTTG1IP蛋白在乳头状癌组织中的表达率显著高于正常甲状腺组织和滤泡性腺瘤组织,并且显著高于滤泡癌和未分化癌。这些结果提示:一方面,在甲状腺滤泡上皮细胞起源的肿瘤中,PTTG1IP蛋白可能与乳头状癌的发生有关,而与滤泡癌及未分化癌的发生无关;另一方面,PTTG1IP蛋白可能是鉴别乳头状癌与甲状腺良性病变及其他恶性滤泡上皮性肿瘤的一个有用指标。Read等[14]亦发现,PTTG1IP在分化型甲状腺癌中高表达。本研究中,在人甲状腺滤泡上皮起源的不同肿瘤中,PTTG1IP蛋白在乳头状癌组织中表达显著升高,而如前所述,在甲状腺PTTG1IP特异性过表达的转基因小鼠中,却出现巨滤泡腺瘤性病变[8],推测这项动物实验仅提示PTTG蛋白过表达具有刺激甲状腺滤泡上皮异常增生的作用,而能否导致乳头状癌等更为复杂的恶性病变,可能需要更多实验、更长的实验周期来验证。
此外,我们还发现在高年龄组、伴有甲状腺外侵犯组及高TNM分期组的甲状腺乳头状癌组织中,PTTG1IP蛋白表达率均明显升高,提示PTTG1IP蛋白过表达可能促进乳头状癌的进展。一项体外实验表明,PTTG1IP可以通过调节细胞侵袭性伪足相关蛋白的功能而促进甲状腺细胞的浸润和迁移[15],这也提示了PTTG1IP蛋白促进甲状腺乳头状癌进展的可能机制,仍需进一步研究。
乳头状癌是甲状腺最常见的恶性肿瘤[16],大部分患者预后良好,但仍有部分患者预后较差。有研究表明,PTTG1IP与甲状腺癌患者差的预后有关[14]。放射碘消融是治疗甲状腺癌最重要的术后辅助手段,NIS是放射碘消融甲状腺肿瘤和转移灶的重要相关基因。在甲状腺过表达PTTG1IP的小鼠模型中,NIS表达明显受抑制,甲状腺摄取碘的能力明显下降[8]。另一项研究也提示了PTTG1IP蛋白对放射碘消融效果的影响:改变PTTG1IP蛋白的磷酸化状态,可以克服PTTG1IP蛋白对甲状腺摄取碘的抑制,从而增加放射碘消融的疗效[17]。
综上所述,一方面,在甲状腺滤泡上皮起源的多种肿瘤中,PTTG1IP蛋白过表达可能与乳头状癌的发生发展有关,而与滤泡癌及未分化癌的发生发展无关;另一方面,PTTG1IP蛋白可能是鉴别乳头状癌与甲状腺良性病变及其他恶性滤泡上皮性肿瘤的一个有用指标;此外,PTTG1IP蛋白过表达可以抑制甲状腺癌细胞对放射碘的摄取,从而降低放射碘消融的效果,从而导致部分患者预后较差。因此,PTTG1IP可能为难治的乳头状癌提供新的治疗靶点。
