动脉瘤性蛛网膜下腔出血伴神经源性肺水肿一例
2020-09-02张欣杨志刚
张欣 杨志刚
患者男性,70岁。持续头痛、头晕3.50小时伴反复呕吐入院。患者于2019年6月28日20∶30左右无明显诱因突发剧烈头痛、头晕,伴意识丧失数分钟,神志清醒后出现恶心并反复呕吐,呕吐物为胃内容物,病程中无胸闷、胸痛、憋气、呼吸困难等症状。既往有原发性高血压病史30年,规律服用硝苯地平(拜新同)30 mg/d,血压维持在140/80 mm Hg(1 mm Hg=0.133 kPa);高脂血症病史10年,间断服用阿托伐他汀20 mg/d,血脂控制不详。入院后急诊查体:体温36.7℃,心率71次/min,呼吸25次/min,血压200/99 mm Hg。查体合作,神志清楚,精神差,双侧瞳孔等大、等圆,直径约2 mm,对光反射灵敏,肌力和肌张力正常,共济运动和感觉系统检查无明显异常,颈项强直,病理征阴性。Glasgow昏迷量表(GCS)评分14分,其中呼唤睁眼3分、正确回答问题5分、可按指令活动肢体6分,Hunt-Hess分级Ⅱ级。头部CT显示蛛网膜下腔出血(图1),胸部CT未见异常(图2)。急诊行全脑血管造影(6月29日1∶35),可见右侧颈内动脉后交通段动脉动脉瘤,大小约3.00 mm×2.90 mm×2.90 mm,瘤颈3 mm,于全身麻醉下行支架辅助弹簧圈栓塞术,选择LVIS支架(3.50 mm×15.00 cm,美国Microvention公司)覆盖1/2瘤颈,再依次选择3 mm×4 cm、2 mm×6 cm和1.50 mm×3.00 cm弹簧圈栓塞动脉瘤,实时脑血管造影显示动脉瘤栓塞致密,后交通动脉显影良好(图3)。术后常规转入神经重症监护病房,分别以甘露醇125 ml/8 h静脉滴注、尼莫地平1 mg/h静脉泵入,控制颅内压、缓解脑血管痉挛。发病后15小时(6月29日11∶17)患者主诉头痛,但无憋、喘表现和主诉。常规复查CT,蛛网膜下腔出血无明显变化(图4);胸部CT显示,右肺上叶后段呈片状、条片状高密度影,边缘模糊(图5),未予特殊处理。发病后45小时(6月30日17∶00)逐渐出现低热、房颤、低氧血症等症状与体征;听诊双肺呼吸音增粗,但未闻及明显啰音;实验室检查血白细胞计数13×109/L[(4~10)×109/L],动脉血氧分压(PaO2)60 mm Hg(80~100 mm Hg)、氧合指数(OI)为150(≥200),氨基末端B型利尿钠肽前体(NT-proBNP)758.20 pg/ml(0~300 pg/ml);床旁胸部X线检查显示双侧中下肺野纹理增多、增粗,不排除外支气管炎可能(图6)。根据患者临床表现及辅助检查结果,拟诊吸入性肺炎,予抗感染、抗心律失常治疗,头孢呋辛1.50 g/次(3次/d)静脉滴注,盐酸胺碘酮先以负荷剂量150 mg静脉注射再以1 mg/min静脉泵入,持续6小时后改为0.50 mg/min。发病后84小时(7月2日8∶00)病情突然恶化,出现严重低氧血症、高热;听诊双肺可闻及明显干湿啰音,以右侧明显;血常规白细胞计数18.60×109/L、中性粒细胞比例0.848(0.40~0.75),动脉血气分析pH值7.38、PaO236 mm Hg、氧合指数<100、二氧化碳分压(PaCO2)为42 mm Hg(35~45 mm Hg),NT-proBNP 2404.01 pg/ml;复查头部CT(7月2日9∶00)显示颅内出血明显吸收(图7);胸部CT(7月2日9∶00)显示双肺纹理增多,可见多发片状、条片状高密度影,边缘模糊(图8);床旁胸部X线检查(7月2日10∶00)显示双肺野纹理增多、增粗,可见大片状模糊阴影,密度较均匀(图9);经口气管插管可吸出大量血性痰液,连续三天病原学检测均呈阴性。结合病史、临床表现、实验室和影像学检查,临床诊断为神经源性肺水肿。遂经静脉泵入咪达唑仑0.05 mg/(kg·h)和芬太尼0.025 mg/h,充分镇静、镇痛,机械通气模式为容量控制通气(VCV)模式、潮气量(VT)6 ml/kg、呼吸频率16次/min、吸入氧浓度(FiO2)60%、呼气末正压通气(PEEP)12 cm H2O(1 cm H2O=0.098 kPa)。治疗原则仍以缓解脑血管痉挛、抗感染和抑制炎症反应为主,继续静脉泵入尼莫地平1 mg/h,美罗培南1 g/次(3次/d)、万古霉素1 g/次(2次/d)和甲泼尼龙120 mg/d(甲泼尼龙琥珀酸钠120 mg溶于100 ml生理盐水中)静脉滴注,同时间断行腰椎穿刺术监测颅内压、引流血性脑脊液。机械辅助通气24小时后(7月3日11∶00)氧合指数升至200,体温恢复正常,胸部X线检查显示肺部渗出影明显好转,继续机械辅助通气,FiO2、PEEP分别下调至50%和9 cm H2O。机械通气48小时后(7月4日13∶00)氧合指数无明显变化,胸部X线检查显示肺部渗出影进一步好转,持续机械辅助通气,PEEP下调至7 cm H2O,甲泼尼龙减至80 mg/d;机械通气72小时后(7月5日13∶00)氧合指数升至260,听诊双肺湿啰音基本消失,停用咪达唑仑,调整通气模式为容量-同步间歇指令通气(V-SIMV)模式、潮气量8 ml/kg、呼吸频率8次/min、FiO240%、PEEP 5 cm H2O、压力支持水平(PS)5 cm H2O;继续机械辅助通气96小时后(7月6日13∶00)患者神志清楚,体温正常,心率和血压稳定,氧合指数>400。通过自主呼吸试验(SBT)后撤离呼吸机、拔除气管插管;甲泼尼龙剂量减至40 mg/d。拔管20小时后(7月6日9∶00),鼻导管吸氧3 L/min,体格检查神志清楚,体温36.5℃,心率75次/min,呼吸20次/min,血压154/73 mm Hg,脉搏血氧饱和度(SpO2)99%;胸部X线检查显示双肺渗出影基本吸收(图10)。遂自神经重症监护病房转入普通神经外科病房。
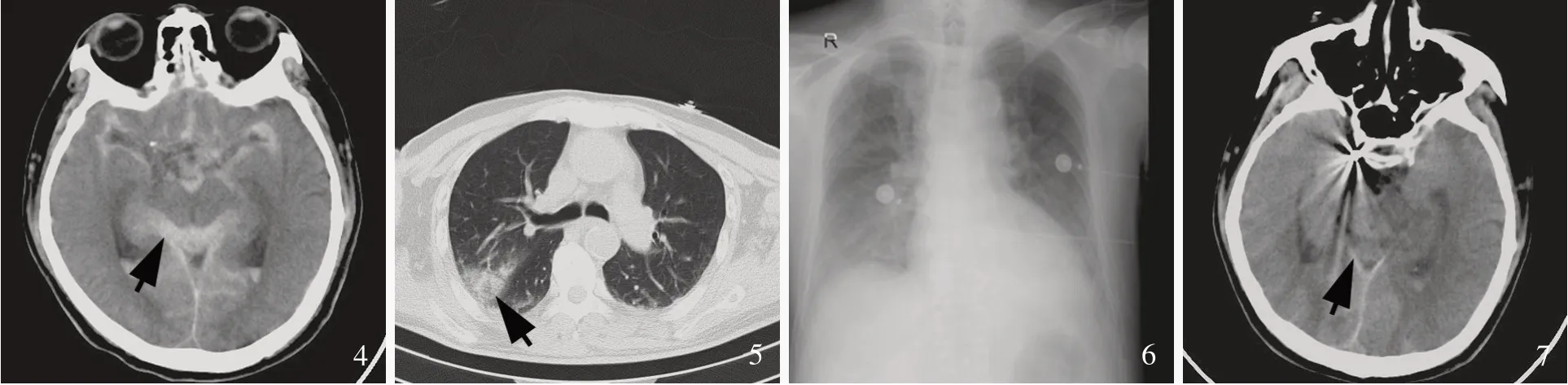
图4发病15小时(术后6小时)头部CT显示,蛛网膜下腔出血较入院时无明显变化(箭头所示)图5发病15小时(术后6小时)胸部CT显示,右肺上叶后段呈片状或条片状高密度影,边缘模糊(箭头所示)图6发病45小时床旁胸部X线显示,双侧中下肺野纹理增多、增粗,不排除支气管炎可能图7发病84小时头部CT显示,与入院时相比,颅内出血明显吸收(箭头所示)Figure 4 Head CT at 15 h after onset(6 h after surgery)showed no obious changes of SAH(arrow indictaes).Figure 5 Lung CT findings at 15 h after onset(6 h after surgery)showed patchy and strip hyperintensity in the posterior segment of right upper lung(arrow indicates).Figure 6 Bedside chest X-ray at 45 h after onset showed increased lung marking in bilateral middle and lower lung fields,except for bronchitis.Figure 7 Head CT at 84 h after onset showed ICH was significantly absorbed(arrow indicates).
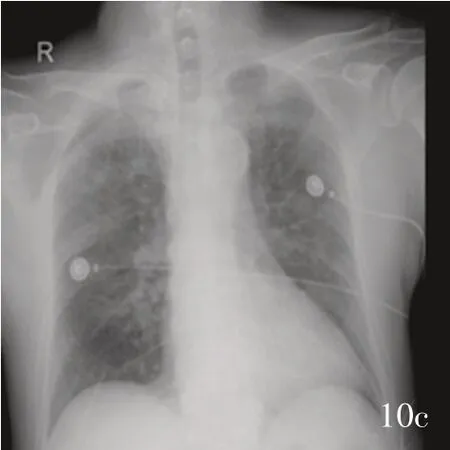
图8发病84小时胸部CT显示,双肺纹理增多,可见多发片状或条片状高密度影,边缘模糊图9发病85小时床旁胸部X线显示,双肺野纹理增多、增粗,双侧肺野可见大片状模糊阴影,密度较均匀图10床旁胸部X线检查所见10a机械通气24小时后双侧肺野纹理增多、增粗,大片状模糊阴影,密度较均匀,较发病85小时有所减少10b机械通气48小时后双侧肺野纹理增多、增粗,大片状模糊阴影较机械通气24小时明显吸收10c拔管后20小时双侧肺野纹理增多、增粗,较机械通气48小时明显好转Figure 8 Lung CT at 84 h after onset showed increased lung texture,multiple patchy and strip patchy hyperintensity with blurred edges.Figure 9 Beside chest X-ray at 85 h after onset showed increased and thickened lung field texture,and large patch-shaped fuzzy shadows were seen in both lung fields with uniform density.Figure 10 Bedside chest X-ray findings After 24 h of mechanical ventilation showed increased and thickened lung field exture,and large patching and fuzzy shadows were seen in both lung fields,with more uniform density and less density than before(Panel 10a).After 48 h of mechanical ventilation showed increased and thickened lung marking,and large fuzzy shadow absorption were seen in both lung fields(Panel 10b).At 20 h after tracheal intubation showed the both lungs texture was increased and thickened,which was better than before(Panel 10c).
讨 论
神经源性肺水肿(NPE)系指在无心脏、肺、肾脏等疾病的情况下,中枢神经系统损害导致的急性肺水肿,亦称中枢性肺水肿或脑源性肺水肿。关于中枢神经系统损伤继发肺损伤的报道最早可追溯到19世纪70年代[1-2]。Cushing于20世纪初首次阐述中枢神经系统损害与血流动力学障碍的联系,至1918年Moutier报告战伤中的颅脑创伤患者常发生致死性肺水肿,此后,医学界逐渐形成“神经源性肺水肿”概念,但多为病例报道或小样本研究,实际上尸检所呈现的神经源性肺水肿远多于临床所见[3-4]。
本文患者发病早期虽数次呕吐胃内容物,但胸部CT检查未见明显异常,动脉血气分析各项参数基本在正常参考值范围内;且胸部影像学首发异常部位为右肺上叶后段,与常见的吸入性肺炎不符;此外,机械辅助通气后可见血性痰液,未见食物残渣,故排除吸入性肺炎的可能。结合本文患者诊治过程,分析神经源性肺水肿的发生原因可能为:(1)神经源性肺水肿的诊断为排他性诊断,应符合严重中枢神经系统疾病病程中突发呼吸困难、紫绀、白色或粉红色泡沫痰、肺部大量湿性啰音,同时排除补液原因导致的急性左心衰竭,且无原发性心脏、肺、肾脏疾病[5]。本文患者在治疗过程中,尽管因应激反应出现白细胞计数和体温升高、心率增快等现象,使得血清NT-proBNP升高,在无绝对证据排除感染和心功能障碍的情况下,干扰对神经源性肺水肿的诊断[6]。(2)目前公认神经源性肺水肿的诊断标准包括氧合指数<200[5,7],可能忽略疾病早期出现肺水肿但氧合指数≥200的患者。Meguro等[8]认为,随着Hunt-Hess分级的增加,神经源性肺水肿发病率和严重程度呈逐渐升高趋势。关于神经源性肺水肿的发病机制,目前已取得共识的理论是血流动力学说和肺血管通透性学说,这两种作用机制均从病生理学角度阐明交感神经系统在神经源性肺水肿发病过程中的中介作用[3,9],并且二者可能同时存在[10-11]。因此推断中枢神经系统损伤致颅内压增高均可引起不同程度的交感神经兴奋,从而诱发不同程度肺水肿,这可能是广义的神经源性肺水肿。其中部分病例病情严重,氧合指数<200,是临床可监测到的神经源性肺水肿[7]。例如本文患者发病后15小时胸部CT可见局灶性斑片状影,可能已发生神经源性肺水肿,但尚无临床症状。(3)神经源性肺水肿的病因几乎涵盖所有中枢神经系统损伤[12],包括颅脑创伤、脑出血、蛛网膜下腔出血[13]、脑梗死、脑炎和(或)脑膜炎[14]、脑肿瘤[15]等,以及新生儿缺氧缺血性脑病(HIE)、全面性强直-阵挛发作(GTCS)[16]、吉兰-巴雷综合征(GBS)、神经外科手术、气脑造影术、电痉挛治疗、绞刑、自缢等。由此可见,神经源性肺水肿病例散发于各科,从而给系统性诊治带来困扰。
治疗方面,一是积极处理原发病,控制颅内压;二是积极处理低氧血症、加强液体管理,缓解肺水肿[2,17-18]。研究显示,对于神经源性肺水肿患者,早期行呼吸机辅助通气,尤其是呼气末正压通气的应用可纠正低氧血症[19-20]。本文患者的诊治过程也充分说明了机械辅助通气和呼气末正压通气的重要性。然而,临床上除了重症医学科、呼吸科、急诊科等科室具备机械通气的条件,更多的科室并无相关设备和专业人员。因此,对神经源性肺水肿的早期识别即显得尤为重要,特别早期发生肺水肿但并无严重低氧血症的患者,如果能够做到早期识别并集中治疗,出现机械通气指征时立即进行气管插管呼吸机辅助通气,可以降低病死率。
利益冲突无
