基于网络药理学探讨钩藤治疗高热惊厥的作用机制
2020-09-02蔡小其伦龙威李盼朱丽臻石艳红
蔡小其, 伦龙威, 李盼, 朱丽臻, 石艳红
高热惊厥是儿科临床常见的急症,5岁以下儿童的患病率高达3%~5%,且复发率为30%~40%[1]。引起高热惊厥复发的危险因素多,包括首发年龄、初发体温及家族史等[2]。反复或长时间发作的高热惊厥易造成不同程度的脑损伤,部分可演变为癫痫,影响患儿智力发育及身心健康[3]。高热惊厥的发病机制复杂,涉及炎症反应、离子通道改变、染色体异常等病理生理机制[4]。目前,地西泮、咪达唑仑等西药主要用于高热惊厥急性期的治疗,但不能减少高热惊厥的复发,且可引起嗜睡、头晕、乏力等不良反应[5]。而预防性用西药,因其副作用多,目前在临床上并不推荐[6]。
高热惊厥属于中医学“急惊风”范畴。急惊风的中医治疗,疗效确切,且副作用少。宋代著名儿科医家钱乙首先在《小儿药证直诀》中提出“心热肝风作急惊”为急惊风的主要病机,此观点为后世沿用至今,为目前小儿急惊风的主流病机,治则多以清热平肝,息风止痉为法[7]。钩藤恰好是息风止痉的良药,其性微寒,其味甘,归肝、心包二经,具有息风止痉,清热平肝的功效。古今中医临床上,以钩藤为主药的复方在高热惊厥的预防及治疗中,均占了大部分[8,9]。近年来,已有研究发现,钩藤中的有效成分钩藤碱具有镇静、抗惊厥、抗癫痫等多种中枢药理作用[10-11]。但鲜有从细胞及分子水平系统阐述钩藤治疗高热惊厥的作用机制的研究报道。
本研究拟通过采用网络药理学方法,利用复杂网络及可视化技术,从系统层面分析钩藤治疗高热惊厥的活性成分及潜在机制,为其作用机制的实验研究提供参考,也为后续深入复方药理研究提供理论基础。
1 资料与方法
1.1 钩藤化学成分的获取及筛选 以“GouTeng”作为关键词,从TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php)中获取中药钩藤可能的化学成分,可以获得活性一系列成分信息。在获得的结果中,以类药性和口服生物利用度两个指标作为筛查标准,筛选出同时满足类药性≥0.18和口服生物利用度≥30%的化学成分,得到潜在有效成分的化学物ID及其名称。同时,本研究通过国内外文献检索,将既往报道过的钩藤有活性的成分,也一同纳入本次研究中。
1.2 预测潜在药物靶点 利用反向药效团匹配数据库PharmMapper(http://www.lilab-ecust.cn/pharmmapper/)筛选得到钩藤的潜在候选成分,然后下载计算结果。可获得PDB ID、靶点名称和得分(fit score),其中fit score为分子和靶点的匹配度,越高代表越匹配。在结果中,选取fit score>3的靶点蛋白作为该化合物的潜在靶标蛋白,并用UniProt数据库(http://www.uniprot.org/)输入筛选获得的蛋白靶点PDB ID,经检索和转化操作得到的钩藤主要成分的潜在作用靶点。
以“Febrile Convulsion”为关键词,通过OMIM(https://omim.org/)和GeneCards(https://www.genecards.org/)数据库,搜索高热惊厥相关发病基因。同时,本研究通过文献检索,搜索已报道与高热惊厥发病相关的基因,将其一并纳入本研究,最后去除重复基因和假阳性基因。通过R语言中“VennDiagram”功能,将高热惊厥发病靶点与上述药物成分靶点匹配分析,从而得出两者交集,进而得出钩藤潜在活性成分相关的作用靶点。
1.3 药物-成分-靶点-疾病网络构建 将得到的钩藤药效成分的预测靶点结果及高热惊厥发病靶点结果,在TXT中分别列出“药材-药效成分”“药效成分-疾病靶点”和“疾病靶点-疾病”之间的相互关系。通过Cytoscape 3.6.1软件的关联功能建立“钩藤-药效成分-靶点-通路-高热惊厥”网络模型。网络图中以药物、药效成分、靶点蛋白和疾病分别作为4种节点,它们之间的相互关系分别以直线相连,从而达到可视化效果。
1.4 蛋白相互作用网络构建与分析 本研究将钩藤对高热惊厥的潜在蛋白靶点列出,导入String数据库(https://string-db.org/),限定物种为人,进行蛋白的互作分析。以蛋白相互作用系数作为筛查标准,选取蛋白相互作用系数≥0.4的蛋白,保存结果。获得蛋白相互作用图及string_interactions.tsv文件。
1.5 生物过程与通路分析 下载Bioconductor-clusterProfiler(http://www.bioconductor.org)数据库,将其导入R语言中,将钩藤的作用靶点文件string_interactions.tsv导入Bioconductor-clusterProfiler数据库(http://www.bioconductor.org),限定物种为人,对钩藤作用靶点进行GO分析和KEGG通路分析,最后保存结果。设定检验阈值P<0.05,并按照涉及的靶点数目多少进行排序,筛选出排名靠前的生物过程或通路。
1.6 靶点通路分析 利用KEGG(https://www.kegg.jp/)数据库,导入钩藤治疗高热惊厥相关的潜在靶点蛋白,得到钩藤治疗高热惊厥的主要生物通路图。
2 结果
2.1 钩藤活性成分的获取与筛选 在TCMSP数据库中,利用类药性值、口服生物利用度值作为筛选指标,获得同时符合该条件的33种化学成分,结果见表1。

表1 钩藤中潜在成分信息
2.2 潜在作用靶点预测 将PharmMapper数据库得到的所有靶点,删除重复并去除假阳性,最终整合得到钩藤活性成分作用靶点129个。通过与OMIM和GeneCards数据库中与高热惊厥相关基因(共868个)进行比对,筛选出27个潜在有效成分(表2),从表2中可知,钩藤治疗高热惊厥的潜在有效成分为生物碱类、萜类、黄酮类等。活性成分对应46个可能与钩藤治疗高热惊厥相关的作用靶点(图1、表3)。

表2 钩藤治疗高热惊厥的潜在有效成分
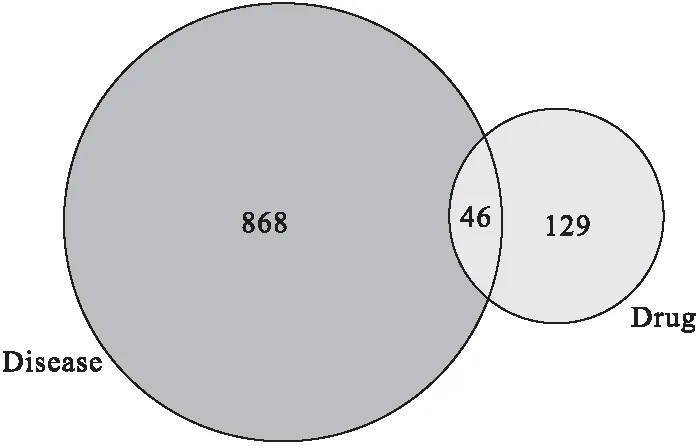
图1 活性成分靶点与高热惊厥基因靶点的交集
2.3 钩藤-有效成分-靶点-高热惊厥网络构建 通过Cytoscape软件构建“钩藤-有效成分-靶点-高热惊厥”的网络模型(图2,见封三)。该网络共有76个节点(其中包括1个药材、27个成分、46个靶点和1个疾病)。
2.4 蛋白相互作用网络构建与分析 将潜在靶点列出并输入String数据库中,限定物种为人,选取蛋白相互作用系数≥0.4的蛋白,进行蛋白互作分析,得出蛋白相互作用图(图3,见封三)。从蛋白相互作用图中可知,与其他蛋白关系最密切的排名前5的蛋白为:白细胞介素-6(interleukin-6,IL-6)(36)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)(35)、蛋白激酶Bα(protein kinase Bα,AKT1)(32)、白细胞介素1B(interleukin-1B,IL-1B)(32)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)(32),图4中列出排名靠前30的蛋白。

表3 钩藤活性成分治疗高热惊厥的潜在靶点
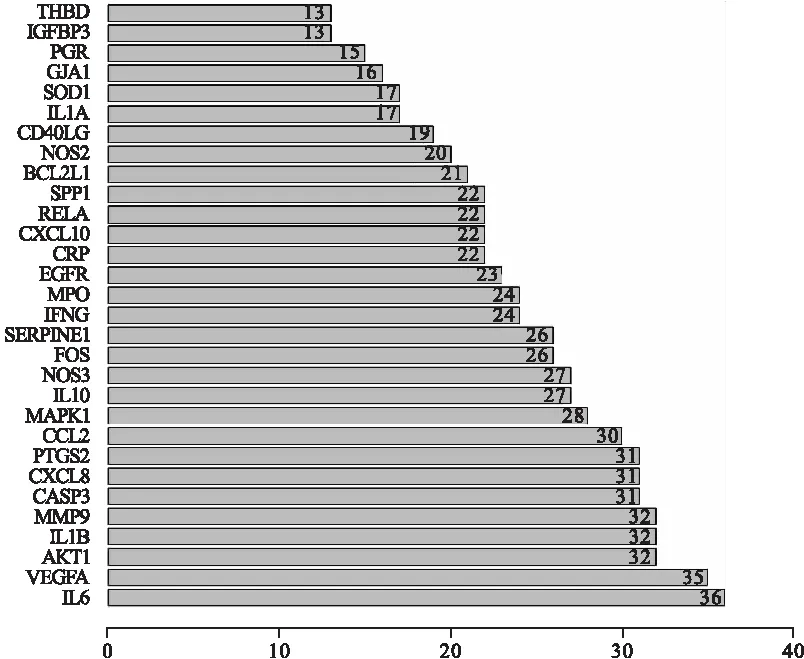
图4 与其他蛋白关系最密切的前30名蛋白
2.5 基因功能和通路分析 利用R语言中Bioconductor-clusterProfiler数据库,将钩藤潜在活性成分预测出的46个作用靶点导入其中,进行GO分析,分析结果如图5(见封三)。由GO分析可知,钩藤治疗高热惊厥主要是通过调节人体内的细胞因子受体结合、细胞因子活性、四苯丙烯结合、受体配体活动、受体调节器活动、氧合绑定等生物功能实现的,最终影响人体的炎症反应、细胞凋亡、细胞存活和细胞对缺氧的适应性。
2.6 钩藤潜在作用靶点途经分析 利用R语言中Bioconductor-clusterProfiler数据库进行分析,将钩藤治疗高热惊厥的46个潜在作用靶点进行KEGG通路富集分析,结果如图6(见封三)。获得钩藤治疗高热惊厥的通路,以各通路中含有的作用靶点数排序,排名靠前的几条通路分别为:晚期糖基化产物信号通路(AGE-RAGE signaling pathway in diabetic complications),白细胞介素-17信号通路(IL-17 signaling pathway),低氧诱导因子-1信号通路(HIF-1 signaling pathway),肿瘤坏死因子信号通路(TNF signaling pathway),磷脂酰肌醇信号通路(PI3K-Akt signaling pathway)等信号5条通路,涉及多个治疗高热惊厥的潜在靶点。提示钩藤治疗高热惊厥靶点分散于这几条通路中,其中大多数靶点存在于多条通路中发挥作用,如IL-6、VEGFA、AKT1、IL-1B、MMP9等。
3 讨论
本研究显示,钩藤中与治疗高热惊厥相关的成分27个,其中生物碱类占了绝大部分,其次是萜类和黄酮类。钩藤中吲哚类生物碱能够减少硝酸士的宁所致的小鼠惊厥的个数,和惊厥小鼠的死亡个数[12]。钩藤中黄酮类化合物主要为槲皮素,槲皮素可通过抑制半胱氨酸蛋白酶活性,来抵抗细胞凋亡,从而在癫痫持续状态中保护神经元[13]。综上,笔者推测吲哚类生物碱和槲皮素可能是钩藤治疗高热惊厥的主要成分。
KEGG分析显示,钩藤治疗高热惊厥涉及46个作用靶点,这些靶点主要存在于AGE-RAGE、IL-17、HIF-1、TNF、PI3K-Akt等5条通路中。
根据KEGG分析结果,与IL-17信号通路相关联的靶点有21个。IL-17通路的主要作用是诱导炎症反应及促进细胞凋亡[14-15]。既往研究发现,在缺血再灌注损伤的大鼠大脑皮质中,细胞释放的IL-17可促进神经细胞的凋亡,而通过实验手段干扰,降低IL-17的释放后,则可明显减少神经元的凋亡[16]。综上,钩藤可能通过调节该通路以减少IL-17释放,从而减少炎症反应及神经细胞的凋亡。
AGE-RAGE、TNF、PI3K-Akt三条信号通路在此一并讨论,晚期糖基化终产物(AGEs)-受体(RAGE)结合可激活多种细胞内信号通路,包引起炎症反应,以及通过RAGE诱导PI3K-Akt-依赖通路,进而参与细胞增殖和凋亡[17]。肿瘤坏死因子作为一种重要的细胞因子,可诱导细胞内多种信号通路,主要包括细胞凋亡、细胞存活、炎症等。孙丹等[18]研究发现,肿瘤坏死因子可参与炎症反应的调控过程,引起炎性病理损害,从而直接或间接引起脑组织损伤。此外,肿瘤坏死因子也可激活PI3K-Akt信号通路,来参与细胞凋亡[19]。有研究表明,细胞内PI3K-Akt信号转导通路的激活及下游信号的级联反应是细胞凋亡发生的必要前提,若处于细胞凋亡的早期阶段,对信号通路进行干预,则可以避免细胞凋亡的发生,从而减轻脑损伤[20]。以上三条信号通路主要涉及炎症反应及细胞凋亡,由此推测钩藤的活性成分主要通过控制炎症反应及减少神经细胞凋亡,从而达到治疗高热惊厥的作用。
HIF-1通路中包含11个治疗靶点。HIF-1是一种调节氧稳态的主要转录因子,在缺氧条件下,HIF-1成为众多低氧诱导基因的主要调控因子,可调节多种靶基因,增加O2输送的蛋白,并介导对缺氧的适应性反应[21]。已有研究表明,HIF-1信号通路在癫痫中可被激活,且HIF-1α蛋白的表达与机体缺氧状态成正相关[22]。惊厥的发生与脑细胞缺氧关系密切,由此推测,钩藤还可通过调节神经元对缺氧的适应性来治疗高热惊厥。
综合上述,笔者推测钩藤可能主要通过AGE-RAGE、IL-17、HIF-1、TNF、PI3K-Akt等5条通路发挥控制炎症反应,减少神经细胞凋亡,调节神经元对缺氧的适应性等作用,从而治疗高热惊厥。然本研究仅依靠数据库信息在理论层面进行探析,对于钩藤治疗高热惊厥的具体机制还需通过动物实验、临床研究进一步验证。
