基于萘-咟啶鎓受体分子的合成及其对F-的特性识别
2020-09-02董智云贾佳王拾梅席福贵
董智云,贾佳,王拾梅,席福贵
(忻州师范学院 化学系,山西 忻州 034000)
近年来阴离子的识别和检测受到了广泛地关注[1-2].氟是人体中不可缺少的元素,含量过低会导致出现软骨病、龋齿等疾病[3-5],含量过高会导致厌食、胃溃疡、器官损伤等,因此,检测氟离子具有十分重要的意义.目前,已报道的氟离子探针主要有:脲[6]、硫脲[7]、酰腙[8]、酰肼[9]、酚[10]、亚胺[11]、咪唑[12-16]、有机硼化合物[17-18]、有机硅化合物[19-22]等. 咪唑环中的C(2)-H作为识别位点,可与阴离子形成特殊的离子型氢键(C-H)+…X-[23].咟啶衍生物作为咪唑鎓化合物的类似化学物,其2位H作为识别位点也可与阴离子形成特殊的氢键(C-H)+…X-,是一类良好的离子型氢键供体,但基于咟啶衍生物的荧光探针并不多见[24-25],本文用简单的方法设计合成了一种基于萘-咟啶鎓的新型受体分子1,该受体分子以咟啶环上的C(2)-H作为阴离子结合位点,萘基和咟啶基团作为发光基团,可实现裸眼识别F-,并对F-具有荧光开启(turn-on)功效,其合成路线如图1所示.

图1 受体分子1的合成路线Fig.1 Synthetic routes of receptor 1
1 实验部分
1.1 仪器与试剂
1.1.1 仪器
Bruker 400 MHz 核磁共振仪(TMS为内标,DMSO-d6为溶剂);UV-2550紫外可见分光光度计;Hitachi F-4600 荧光光谱仪;LCMS-8030液相色谱质谱联用仪.
1.1.2 试剂

1.2 受体分子1的合成
1.2.1 化合物2的合成
氮气保护下,在100 mL两口瓶中加入氢化钠(质量分数60%, 0.8 g, 20 mmol),20 mL乙腈,冰水浴下搅拌15 min,加入溶于20 mL乙腈的咟啶(1.85 g, 11 mmol)溶液.缓慢滴加溶于20 mL乙腈的1,5-二溴戊烷(1.19 g, 5 mmol)溶液,室温反应10 h,反应结束后加入50 mL水,二氯甲烷萃取(50 mL×3),无水Na2SO4干燥,抽滤,旋蒸,真空干燥得棕褐色油状黏稠液体,柱层析分离纯化(洗脱剂V乙酸乙酯∶V甲醇=4∶1)得黄棕色固体1.64 g,即化合物2,产率为79%.1H NMR (DMSO-d6, 400 MHz),δ:1.40~1.51 (m, 1H), 1.62~1.75 (m, 2H), 3.65 (t,J=7.2 Hz, 2H), 6.34 (d,J=7.3 Hz, 1H), 6.64 (d,J=7.3Hz, 1H), 7.03~7.21 (m, 4H), 7.49 (s, 1H).
1.2.2 受体分子1的合成
氮气保护下,将化合物2(1.21 g, 3 mmol),2-溴甲基萘(1.54 g, 7 mmol)和30 mL甲苯置于100 mL两口瓶中,110 ℃条件下反应28 h.反应结束后,冷却至室温,产生黄色固体,抽滤,用甲苯和无水乙醚各洗涤3次,真空干燥,得产物1.45 g,产率为57%.
将上述产物溶于50 mL蒸馏水中,加入NH4PF6(0.49 g,3 mmol),室温搅拌5 h,产生沉淀,抽滤,水洗3次,真空干燥,得到黄色固体1.29 g,为受体分子1,产率为77%.1H NMR (DMSO-d6, 400 MHz),δ:1.79~1.83 (m, 1H),2.04~2.07 (m, 2H),4.22 (t,J=8.1 Hz, 2H),5.53 (s, 2H),6.91 (d,J=7.8 Hz, 1H), 7.29 (d,J=7.7 Hz, 1H), 7.36 (t,J=8.1 Hz, 1H),7.52~7.57 (m, 4H),7.64 (d,J=8.3 Hz, 1H),7.76~7.80 (m, 1H),7.91~7.95 (m, 2H),8.00 (d,J=8.6 Hz, 1H),8.23 (s, 1H),9.73 (s, 1H).13C NMR (DMSO-d6, 100 MHz),δ:23.22, 25.86, 51.95, 54.82, 108.74, 109.22, 121.90, 124.13, 124.30, 125.34, 126.75, 127.00, 127.14, 128.19, 128.64, 128.89, 129.14, 129.37, 130.88, 132.20, 133.12, 133.25, 134.89, 154.14. ESI-MS([1-2PF6-]2+),m/z:343.17(计算),343.20(实测).
1.3 阴离子识别性能测试
1.3.1 UV-Vis吸收光谱测试

利用Job曲线法[26]测定受体分子1与阴离子的结合比,使受体分子1和阴离子的总浓度固定为5×10-5mol/L,依次改变受体分子1与阴离子的物质的量比(XG),使XG分别为 0、 0.1、 0.2、 0.3、 0.4、 0.5、 0.6、 0.7、 0.8、 0.9、 1.0,测试其UV-Vis吸收光谱. 以络合物的浓度cHG对XG作图,曲线最大值对应的XG值即是受体分子1与阴离子的结合比,其中,cHG=(A0-A)/A0×cH,A0代表受体分子1中未加入阴离子时的紫外吸收强度,A代表加入阴离子后形成的络合物的紫外吸收强度,cH代表相应的受体分子1的浓度.
1.3.2 荧光光谱测试

1.3.3 核磁滴定实验
在受体分子1(5×10-3mol/L) 的DMSO-d6溶液中,通过累计加样的方式逐次加入1.5 mol/L的四丁基氟化铵的DMSO-d6溶液,利用1H NMR检测受体分子1中的各个氢原子化学位移的变化.
2 结果与讨论
2.1 受体分子1与阴离子作用的UV-Vis光谱
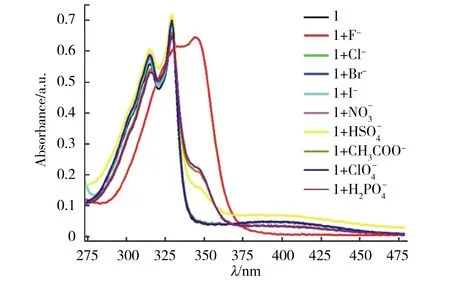
图2 受体分子1的DMSO溶液(5.0×10-5 mol/L)中加入不同阴离子(1 mmol/L)后的UV-Vis光谱变化Fig.2 UV-Vis absorption spectra of receptor 1 (5.0×10-5 mol/L) in DMSO upon addition of various anions (1 mmol/L)

为了进一步研究受体分子1对F-的识别性能,对F-进行了UV-Vis吸收光谱滴定实验,如图3所示,随着F-的不断加入,受体分子1在315、329和400 nm处的吸收峰强度降低,并且产生了10 nm的红移,在353 nm处出现1个新的较大的吸收峰,可能是由于受体分子1与F-之间存在相互作用,形成了稳定的氢键络合物,导致分子共轭程度增强,光谱产生红移[27]. 同时溶液颜色由淡黄色逐渐变为无色(图3中内插图),表明受体分子1可作为F-的比色化学传感器.

图3 在受体分子1的DMSO溶液(5.0×10-5 mol/L)中滴加F-(0→1 mmol/L)时的UV-Vis光谱变化(a)(内插图:加入F-前后受体分子1的颜色变化); 受体分子1和F-在329 nm处的非线性拟合曲线(b)Fig.3 UV-Vis titration spectra of receptor 1 (5.0×10-5 mol/L) in the presence of different concentrations of F- (0→1 mmol/L) in DMSO(a)(Inset: the color of receptor 1 in the absence and presence of F-); The non-linear fitting curve of receptor 1 and F- at 329 nm(b)
在超分子体系中,如果主、客体之间以1∶1的化学计量比形成了络合物,可通过下式非线性拟合计算相应的结合常数.
A=A0+ (Alim-A0) / 2cH{cH+cG+1/K- [(cH+cG+1/K)2-4cHcG]1/2},
其中,A0代表受体分子1中未加入阴离子时的紫外吸收强度;A代表加入阴离子后形成的络合物的紫外吸收强度,cH代表受体分子1的浓度,cG代表所加入的阴离子的浓度;K为受体分子1和所加入的阴离子的结合常数. 根据UV-Vis吸收光谱滴定曲线,经最小二乘法非线性拟合计算(图3b)得到了受体分子1和F-的结合常数为(3.05±0.15)×103L/mol,相关系数R2为0.996 9,表明受体分子1与F-间生成了1∶1型的络合物[28]. 如图4的Job曲线所示,受体分子1与F-形成络合物的浓度cHG对XG作图,曲线最大值对应的XG值为0.5,表明受体分子1与F-以1∶1的化学计量比形成了稳定的络合物,这与非线性拟合计算的结果一致.

cH+cG=5.0×10-5 mol/L.图4 受体分子1和F-的Job 曲线Fig.4 UV-Vis Job plot of 1 and F-
2.2 受体分子1与阴离子作用的荧光光谱
为了进一步研究受体分子1对F-的识别性能,进行了荧光滴定实验. 在5.0×10-6mol/L的受体分子1的DMSO溶液中不断滴加F-,使得cF-/c1=0、0.1、0.2、0.3、0.5、1.0、2.0、…、9.0、10.0. 如图6所示,随着F-浓度的增大,受体分子1在403 nm处的荧光发射峰不断增强,当cF-/c1=10.0时,荧光强度不再有明显变化,达到饱和,说明受体分子1可作为F-的比率型荧光探针. 如图5中的内插图所示,受体分子1的DMSO溶液在波长为365 nm的紫外灯照射下没有荧光,而加入F-后,溶液呈现出强烈的蓝色荧光,因此,可以实现简易设备条件下荧光识别F-. 同时,受体分子1表现出的无荧光现象为实现简易设备条件下荧光识别F-提供了很好的“零”背景荧光检测条件,非常有利于提高受体分子检测的灵敏度,可应用于生物成像中. 根据荧光滴定曲线,受体分子1检测F-的线性为1.0 × 10-6~3.0×10-5mol/L,最低检测限为8.5×10-6mol/L.

图5 受体分子1的DMSO溶液(5.0×10-6 mol/L)中加入不同阴离子后的荧光光谱变化Fig.5 Fluorescence spectra of receptor 1 (5.0×10-6 mol/L) in DMSO upon addition of various anions

图6 受体分子1的DMSO溶液中加入不同浓度F-时的荧光光谱变化(内插图:加入F-前后受体分子1在365 nm紫外灯下的荧光变化)Fig.6 Fluorescence titrations spectra of receptor 1 in the presence of different concentrations of F- in DMSO (Inset: fluorescence color of receptor 1 in the absence and presence of F- under UV lamp excited at 365 nm)
2.3 受体分子1识别F-的机理及结合模式探讨
以DMSO-d6为溶剂,通过1H NMR研究了受体分子1与F-之间的作用机理. 在5×10-3mol/L的受体分子1的DMSO-d6溶液中, 通过累计加样的方式加入1.5 mol/L的四丁基氟化铵的DMSO-d6溶液,检测受体分子1中的各个氢原子化学位移的变化. 如图7a所示,受体分子1中咟啶环上的C(2)-H质子的信号峰为9.73. 如图7b所示,加入5 mmol/L的F-后,受体分子1中的所有氢质子信号峰强度均有所减弱,其中咟啶环上的C(2)-H质子的信号峰为9.99,向低场的位移Δδ≈0.26,表明受体分子1中咟啶环上的C(2)-H作为阴离子的结合位点与F-形成了离子型氢键(C-H)+…F-[29],该结果与荧光分析测试结果一致.受体分子1表现出的无荧光现象,是由于咟啶基团和萘基之间发生的光诱导电子转移(PET)过程可能导致其荧光消失,加入阴离子F-后呈现出强烈的蓝色荧光,是由于受体分子1咟啶环上的C(2)-H与F-之间发生了较强的氢键作用,从而抑制了咟啶基团和萘基之间的PET过程,导致受体分子1的荧光明显增强[30]. 如图7c所示,继续加入F-至25 mmol/L,受体分子1中所有的氢质子信号峰强度继续减弱,受体分子1中C(2)-H质子的信号峰为10.04,向低场的位移Δδ≈0.05,同时在16.20处出现了[FHF]-的质子峰,说明过量F-的加入会引起受体分子的去质子化,生成了咟啶卡宾化合物,进一步与水作用生成了含醇化合物[31],该含醇化合物的DMSO溶液无色透明,这与紫外光谱的测试结果一致,即受体分子1的DMSO溶液中加入F-后,由黄色变为无色,可实现F-的裸眼比色识别. 受体分子1与F-相互作用的可能作用机理如图8所示.

a.1;b.1+F- (5 mmol/L);c.1+F- (25 mmol/L).图7 DMSO-d6中受体分子1和F-的1H NMRFig.7 1H NMR titrations of receptor 1 upon addition of F- in DMSO-d6

图8 受体分子1与F-之间的可能作用机理Fig.8 Proposed mechanism for the detection of F- with receptor 1
3 结论
本文设计合成了基于萘-咟啶鎓的受体分子1,研究结果显示该受体分子对F-表现出较强的荧光开启功效,并可实现裸眼识别F-. 受体分子1通过其咟啶环上的C(2)-H与F-形成了离子型氢键(C-H)+…F-,二者的结合比为1∶1,结合常数为(3.05±0.15)×103L/mol,最低检测限为8.5×10-6mol/L. 该研究结果为设计其他可识别F-的受体分子提供了有益的参考.
