球形孢子丝菌伊曲康唑耐药株在大蜡螟模型中的毒力和耐药性评价
2020-09-02张静何泰龙吴晓雁黄晓雯黄怀球
张静, 何泰龙, 吴晓雁, 黄晓雯, 黄怀球
(1.中山大学孙逸仙纪念医院皮肤科,广东 广州 510120;2.中山大学附属第三医院皮肤性病科,广东 广州 510630;3.中山大学附属第五医院皮肤科,广东 珠海 519000;4.南方医科大学南方医院皮肤科,广东 广州 510515)
孢子丝菌病(sporotrichosis)是由孢子丝菌复合体(Sporothrixschenckiicomplex)引起的皮肤、皮下组织及周围淋巴系统的慢性感染,在南美洲及我国东北地区高发[1]。孢子丝菌复合体包括申克孢子丝菌(Sporothrixshenckiisensustricto)、巴西孢子丝菌(Sporothrixbrasiliensis)、球形孢子丝菌(Sporothrixglobosa)、墨西哥孢子丝菌(Sporothrixmexicana)和卢艾里孢子丝菌(Sporothrixluriei)。我国孢子丝菌病的致病菌种为球形孢子丝菌[2]。孢子丝菌病主要表现为皮肤结节、斑块、丘疹等增生性皮疹,免疫力低下患者则可能播散至全身引起系统损害进而危及生命[1]。孢子丝菌病的首选治疗药物是伊曲康唑,但近年来有伊曲康唑耐药的报道[3-4]。动物模型对研究孢子丝菌病发病机制和评价药物效果至关重要。小鼠、大鼠是研究孢子丝菌病的经典动物模型,但其成本高、实验周期长。近年来,无脊椎动物用于病原菌感染模型研究的报道越来越多[5-6]。
大蜡螟(GalleriamellonellaL.)属于鳞翅目螟蛾科蜡螟亚科蜡螟属昆虫,其幼虫固有免疫特点与哺乳动物相似,且具有蛋白质丰富、生长周期短、便于繁殖等优点,因此被广泛用于病原菌感染模型进行致病机制和药物评价的研究[7-8]。目前已成功建立申克孢子丝菌和巴西孢子丝菌大蜡螟感染模型[9],而球形孢子丝菌大蜡螟感染模型尚未建立。
本课题组前期在1例伊曲康唑治疗失败的孢子丝菌病患者皮损中分离出球形孢子丝菌,其体外药敏显示对伊曲康唑耐药[10]。因此,本研究建立此球形孢子丝菌大蜡螟感染模型,进一步评价此菌株的毒力和在体内对伊曲康唑的敏感性,现将结果报告如下。
1 材料与方法
1.1 菌株和昆虫
S.globosaSUMS0381分离自1例伊曲康唑治疗失败的淋巴管型孢子丝菌病患者皮疹,经形态学及分子生物学方法鉴定为S.globosa,菌株保存于-80 ℃的15%甘油中。按照CLSIM38-A2方案对其进行体外药敏试验[11],药敏结果显示伊曲康唑的MIC值为8 μg/mL。对照敏感株为S.globosaCBS120340,由荷兰皇家科学院真菌生物多样性研究中心赠送。根据CLSI38-A2方案进行药敏试验,药敏结果显示伊曲康唑的MIC值为1 μg/mL。大蜡螟幼虫采购于天津惠裕德生物科技有限公司,体重为200~240 mg,通体乳白无黑斑,5日龄,置于温度为30~35 ℃、湿度为60%±10%的全黑暗环境培养。
1.2 试剂
马铃薯培养基(potato dextrose agar,PDA)干粉购自英国OXOID公司;二甲基亚砜(dimethyl sulfoxide,DMSO)购自大连美仑生物有限公司,纯度为99%;伊曲康唑原药购自上海基至生化科技有限公司,纯度大于98%。
1.3 菌悬液制备
将菌株置于25 ℃温箱中复苏。将复苏后的真菌转种至PDA培养基,于25 ℃室温下培养1周。用无菌接种针挑取表面菌落,放置于含磷酸缓冲盐溶液(PBS)的无菌试管中,涡旋使菌落分散;再用无菌滤器过滤,去除长菌丝;使用血细胞计数器计数并根据实验目的调整分生孢子浓度。
1.4 模型建立
参考Clavijo-giraldo等[9]研究,用微量注射器将10 μL浓度为1×105/mL的S.globosa菌悬液经幼虫左下腹后足注射入大蜡螟体内,将大蜡螟放入37 ℃温箱观察12天,记录大蜡螟体表颜色变化、刺激反馈及存活情况,当大蜡螟对触摸刺激持续无反应时认为大蜡螟已死亡。设置空白对照组和注射10 μL PBS的阴性对照组。感染后48小时每组取2只幼虫进行组织病理检查。
1.5 毒力检测
将大蜡螟幼虫分为8组,每组10只,将S.globosaSUMS0381和S.globosaCBS120340的菌悬液浓度分别调整至1×104/mL、1×105/mL和1×106/mL(对应注射真菌数量分别为1×102cells/larva、1×103cells/larva和1×104cells/larva),根据上述方法建立感染模型,并设置1个空白对照组和1个PBS对照组,观察12天,记录大蜡螟体表颜色变化、刺激反馈及存活情况。
1.6 药物敏感性检测
根据既往文献[12],将伊曲康唑溶解在1%的DMSO中,根据大蜡螟体重调整伊曲康唑浓度。将大蜡螟分为9组,每组15只,分别为空白组、空白注射20 mg/kg伊曲康唑组、空白注射40 mg/kg伊曲康唑组、S.globosaSUMS0381感染组、S.globosaSUMS0381感染后注射20 mg/kg伊曲康唑组、S.globosaSUMS0381感染后注射40 mg/kg伊曲康唑组、S.globosaCBS120340感染组、S.globosaCBS120340感染后注射20 mg/kg伊曲康唑组和S.globosaCBS120340感染后注射40 mg/kg伊曲康唑组。分别将S.globosaSUMS0381和S.globosaCBS120340菌悬液浓度调整为1×106/mL(1×104cells/larva),根据上述模型建立方法建立大蜡螟幼虫感染模型。注射菌液1 h后,根据分组向大蜡螟幼虫体内分别注射浓度为20 mg/kg和40 mg/kg的伊曲康唑溶液。观察12天内大蜡螟的存活情况,并在注射药液48 h后每组取5只幼虫切片匀浆后进行菌落计数。
1.7 统计学处理
数据采用SPSS 22.0处理。生存曲线比较使用log-rank分析,死亡改善率比较使用卡方检验,菌落下降率比较使用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 S. globosa感染大蜡螟模型
如图1所示,接种S.globosa菌悬液前,大蜡螟幼虫通体呈浅黄色,无色斑,行动活跃,对外界刺激反应灵敏。接种S.globosaSUMS0381菌悬液后第1天,所有大蜡螟幼虫的接种部位及周围出现黑斑并逐渐扩大, 4天内所有被感染的大蜡螟幼虫全身呈黑色,对外界刺激反应迟钝,平均死亡时间为4.4天。接种S.globosaCBS120340菌悬液的大蜡螟的外观表现及存活情况和接种S.globosaSUMS0381的大蜡螟一致。在观察周期内,空白对照组和PBS组大蜡螟外观无明显变化,无死亡。接种S.globosaSUMS0381、S.globosaCBS120340菌悬液96 h的大蜡螟消化道内可见真菌细胞成团状散在分布,消化道管腔结构遭到破坏,证实S.globosa大蜡螟感染模型建立成功。
2.2 S. globosa在大蜡螟模型中的毒力
空白对照组和PBS组大蜡螟幼虫均无死亡,在1×102cells/larva组,S.globosaSUMS0381和S.globosaCBS120340组虽有幼虫死亡,但其生存曲线与空白对照组比较无明显差异(均2=1.00,P=0.320),两组生存曲线比较无明显差异(2=0.00,P=0.970)。在1×103cells/larva组,观察终点12天时,S.globosaSUMS0381和S.globosaCBS120340的致死率均为50%,两者之间的生存曲线无明显差异(2=0.00,P=0.980),但两者与空白对照组的生存曲线差异均有统计学意义(均2=5.42,P=0.020)。在1×104cells/larva组,接种S.globosaSUMS0381后第3天大蜡螟的死亡率为100%, 接种S.globosaCBS120340第3天死亡率为100%,两者之间的生存曲线无明显差异(2=2.37,P=0.124),而与空白对照组比较,差异均有统计学意义(2值分别为17.70、17.32,P值均<0.001)。详见图2。
2.3 S. globosa对伊曲康唑的体内敏感性
在空白组,注射20 mg/kg和40 mg/kg的伊曲康唑未影响大蜡螟的生存时间及活力。在感染组,注射20 mg/kg的伊曲康唑后,感染S.globosaSUMS0381和感染S.globosaCBS120340的大蜡螟的生存率分别提高20%和27%,两者之间无明显差异(2=0.19,P=1.000),但感染S.globosaCBS120340的大蜡螟的菌落计数较之感染S.globosaSUMS0381下降更为明显(12.41±1.29比22.93±1.23,t=-18.66,P<0.001)。注射40 mg/kg的伊曲康唑后,感染S.globosaSUMS0381和感染S.globosaCBS120340的大蜡螟的生存率分别提高40%和60%,两者间差异无统计学意义(2=1.20,P=0.466);与感染S.globosaSUMS0381的大蜡螟相比,感染S.globosaCBS120340大蜡螟的菌落计数降低更为明显(22.32±2.55比43.74±2.59,t=-18.64,P<0.001)。详见图3。

图1 大蜡螟幼虫S. globosa感染模型及组织病理表现(黑色箭头:真菌细胞团)
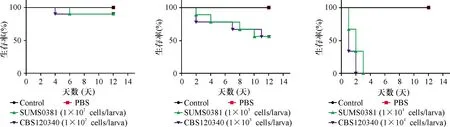
图2 感染S. globosa的大蜡螟幼虫生存曲线图
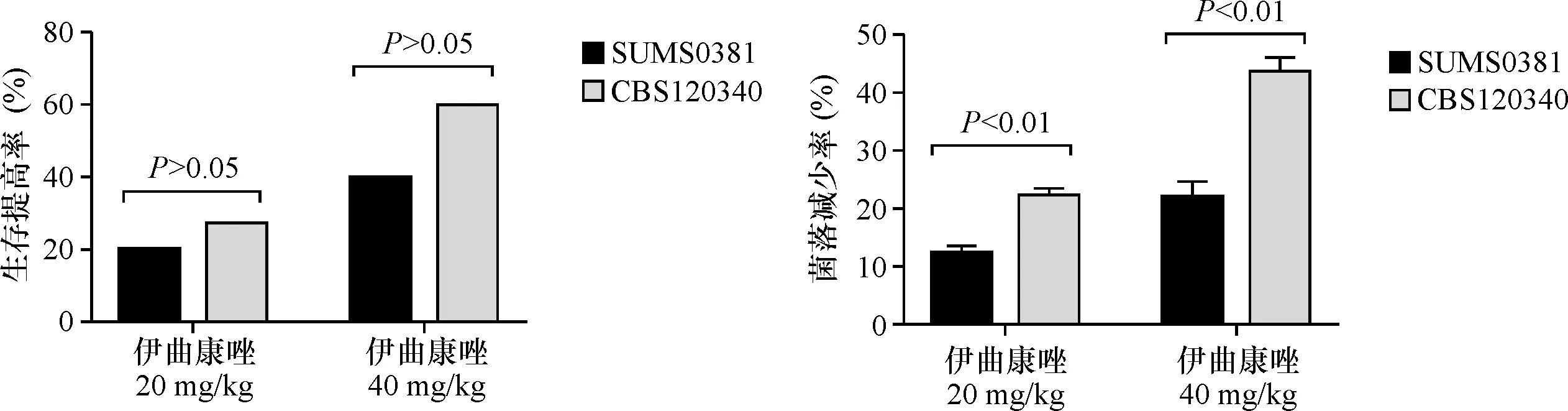
图3 伊曲康唑治疗后S. globosa感染大蜡螟幼虫的生存改善和载菌量变化
3 讨论
大蜡螟幼虫成本低廉,繁殖力强,生长周期短,无自残性,可以在室内20~30 ℃的温度下高密度饲养;体积相对较大,有许多与人类基因同源物编码产物且与哺乳动物的天然免疫系统有许多相似之处,不受伦理限制。因此,大蜡螟是病原微生物的重要实验昆虫模型工具[13]。
大蜡螟幼虫的免疫应答包括黑化、调理素和抗菌肽的产生[14]。大蜡螟幼虫可以对真菌产生免疫应答[15]。既往研究表明大蜡螟幼虫检测白念珠菌毒力的结果与Balb/C 小鼠检测此突变体毒力的结果一致[16];大蜡螟幼虫模型也已被证实适用于烟曲霉和双相型真菌lutzii副球孢子菌、荚膜组织胞浆菌和申克孢子丝菌的毒力研究[17]。在大蜡螟感染模型中,通常用于评估真菌毒力的指标是在观察终点的幼虫死亡数[18]。本研究中,大蜡螟幼虫感染S.globosa后外观出现黑化,部分幼虫即使感染了低浓度(1×102cells/larva)S.globosa,其存活天数和未感染的一致,说明大蜡螟幼虫产生了抗S.globosa免疫应答,可以抵抗低浓度S.globosa感染。在观察终点,S.globosaSUMS0381和S.globosaCBS120340在大蜡螟幼虫上的生存曲线均无统计学差异,说明S.globosa伊曲康唑耐药株和敏感株的毒力无差异。病原菌是否耐药和其毒力无明显相关性,与菌株经历的筛选环境相关[19]。大蜡螟的黑化是大蜡螟免疫识别和免疫应答的标志。本研究中,未观察到不同浓度菌悬液感染的大蜡螟黑化程度有明显差别,目前尚无研究证实大蜡螟的黑化和真菌毒力、载菌量有直接相关性。进一步的研究将对大蜡螟黑化程度进行评分,观察大蜡螟黑化和真菌毒力以及真菌载量的相关性。
研究发现,大蜡螟幼虫筛选抗菌药物的功效与哺乳动物一致,已用于多种抗真菌药物敏感性的研究。Mylonakis等[20]用大蜡螟幼虫建立新型隐球菌感染模型,评估两性霉素B、氟胞嘧啶和氟康唑的抗新生隐球菌活性。Staniszewska等[21]使用大蜡螟幼虫模型证实了新的四唑衍生物明显提高了接种白念珠菌的幼虫存活率和存活时间。Passos等[12]证实了脂质纳米颗粒包裹的伊曲康唑可以延长感染申克孢子丝菌的大蜡螟幼虫的生存时间。本研究中,为了证实S.globosa耐药株对伊曲康唑的敏感性,首先分别使用致死量的S.globosa耐药株菌悬液和S.globosa敏感株菌悬液建立大蜡螟感染模型,注射20 mg/kg的伊曲康唑后,感染S.globosa耐药株和感染S.globosa敏感株的大蜡螟的生存率分别提高20%和27%,两者之间无统计学差异,但感染S.globosa敏感株的大蜡螟的菌落计数下降更为明显;分别向感染S.globosa耐药株和S.globosa敏感株的大蜡螟体内注射40 mg/kg的伊曲康唑后,感染S.globosa敏感株的大蜡螟的存活率高于感染S.globosa耐药株的大蜡螟。20 mg/kg和40 mg/kg的伊曲康唑不影响未感染S.globosa的大蜡螟的存活,且S.globosa耐药株和敏感株的毒力相同。综合以上结果,推测在大蜡螟体内,S.globosa耐药株对伊曲康唑的敏感性较S.globosa敏感株低,与体外药敏结果一致,提示大蜡螟幼虫可以作为检测S.globosa对伊曲康唑敏感性的体内模型。大蜡螟幼虫有与哺乳动物相似的肝脏系统[22],但伊曲康唑在大蜡螟幼虫体内的代谢途径及如何发挥抗真菌活性有待进一步研究。由于体内研究的样本量限制,本研究仅设置两个药物浓度组,未能进一步明确S.globosa耐药株在大蜡螟体内对伊曲康唑的耐药值。
综上所述,在大蜡螟模型中,球形孢子丝菌伊曲康唑耐药株的毒力和敏感株无差异,耐药株对伊曲康唑的敏感性低于敏感株。
