离子束诱变选育高效降解有机磷农药菌株
2020-09-02彭轶楠巩晓芳王治业
彭轶楠 巩晓芳 祝 英 季 彬 陆 栋 杨 晖 王治业
1(甘肃科学院生物研究所 甘肃省微生物资源开发利用重点实验室 兰州730000)
2(中国科学院近代物理研究所 兰州730000)
由于有机磷农药在农业生产中的广泛使用,造成了严重的环境问题,直接或间接地危害人类健康[1]。我国是一个农业大国,目前各地仍在大量施用有机磷农药。如何消除有机磷农药对环境和人类的危害,己成为事关人类健康和国民经济发展的重大问题。利用生物或生物产品来降解有机磷农药的生物修复方法具有无毒、无残留、无二次污染等优点,是消除和降解农药残留的一种安全、有效、廉价的方法,己经成为研究农药降解的首选方法[2-3]。
离子束辐照是20世纪80年代初兴起的一种高效诱变技术[4]。离子束辐照在生命科学研究中具有重要的独特地位,因为它具有常规辐射源所没有的优势:(1) 传能线密度(Linear energy transfer,LET)大;(2)相对生物效率(Relative biological effectiveness,RBE)高;(3)损伤后修复效应小;(4)能量沉积的空间分辨性好;(5)氧效应小;(6)细胞在不同时相内对重离子束敏感性的差异小[5-7]。陈宇等[8]用40~60 keV、剂量1×1011~5×1014cm-2的N+离子注入红霉素产生菌,经筛选得到了高产突变菌株,摇瓶发酵后表明其产量提高20%;向砥等[9]用离子注入选育高产壮观链霉菌,初步试验结果表明其效价较出发菌株提高了102.3%;贾国军等[10]用离子束对北冬虫夏草出发菌悬液进行辐照诱变处理后,其子实体较出发菌的子实体产量提高了52.47%~56.08%。离子束辐照处理微生物菌种,在为食品工业、医药行业提供高转化率的发酵新菌种并使之产业化当中显示出了极大的优势和先进性,开创了微生物育种应用的新局面[11]。
1 材料与方法
1.1 仪器与试剂
高 效 液 相 色 谱 仪 (HP1100, Agilent Technologies Co.Ltd.,USA);配有紫外-可见光度检测器(HP1100,Agilent Technologies Co. Ltd.,USA);紫外-可见分光光度计(北京普析);震荡培养箱(上海一恒)。辛硫磷标准品、氧乐果标准品(农业部环境保护科研检测所研制生产);40%辛硫磷乳油、40%氧乐果乳油(重庆农药化工有限公司),其余试剂均为分析纯。
1.2 菌种来源及培养基
枯草芽孢杆菌菌株LA来源于中国工业微生物菌种保藏管理中心甘肃分中心。发酵培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸馏水1 000 mL,pH=7.0。蒙金娜有机磷培养基:葡萄糖10 g,(NH4)2SO40.5 g,NaCl 3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·H2O 0.03 g,MgSO4·7H2O 0.3 g,CaCO35 g,酵母膏0.4 g,蒸馏水1 000 mL,pH=7.0~7.5。100 mL 的蒙金娜培养基加入2 g琼脂粉,包装,灭菌。用酒精擦净新鲜鸡蛋外壳,用解剖刀切破鸡蛋两端,溜去蛋清后将蛋黄流入已灭菌的锥形瓶中,加入约等量的无菌水,摇匀。待灭菌后的蒙金娜培养基冷却至50 ℃后立即加入卵黄液,每100 mL的蒙金娜培养基加卵黄稀释液1 mL 作为有机磷源,混匀后分装于培养皿内凝成平板;无机盐培养基:NaCl 0.2 g,MgSO40.5 g,K2SO40.5 g,CaCO30.2 g,FeSO4·7H2O 0.001 g,蒸馏水1 000 mL。
1.3 12C6+离子束辐照诱变
将枯草芽孢杆菌LA在发酵培养基中培养至对数期,在无菌条件下,取1.5 mL 菌液置于辐照专用皿中。辐照在中国科学院近代物理研究所重离子加速器研究装置(Heavy ion research facility at Lanzhou,HIRFL)上 进 行,LET 为60 keV/μm,吸收剂量分别为50 Gy、80 Gy、120 Gy、150 Gy、210 Gy、270 Gy,每个剂量分别重复3次。将辐照盒置于辐照盘上,按照不同的吸收剂量依次对菌株进行辐照,辐照结束后,取下培养皿将菌液转移至离心管中,加入甘油置于-20 ℃冰箱保存。
1.4 存活率测定
通过梯度稀释法,将不同剂量辐照后的菌液用无菌水稀释,取梯度稀释浓度为10-5~l0-7的菌液100 μL 涂布于平板,每个梯度浓度重复3 次,30 ℃恒温培养箱中倒置培养48 h,统计平板上长出的菌落数,计算存活率。
存活率=(辐照处理平板上的活菌落数/未辐照平板上的活菌落数)×100%
1.5 解磷细菌的初筛和复筛
将不同剂量离子束辐照处理过的菌液,梯度稀释至10-5~l0-7后,分别涂布在蒙金娜有机磷固体培养基平板上,倒置平放于恒温培养箱中,30 ℃恒温培养48~72 h。以原始菌株涂布在培养基为对照。选择透明圈大于对照的菌落,纯培养后保存。
将初筛的菌株和原始菌株活化后,接种于蒙金娜有机磷液体培养基中,摇床转速200 r/min,30 ℃培养48 h 后结束发酵,采用农业行业标准NY412-2000 规定的钼锑钪分光光度法测定有机磷降解量。
1.6 解磷细菌对有机磷农药降解的检测
采用高效液相色谱测定有机磷农药辛硫磷的残留量[12]。吸取解磷细菌的发酵液1 mL,置于具塞刻度试管中,加入5 mL 二氯甲烷,震荡后静置分离,将下层有机相经无水硫酸钠脱水后,取1 mL加入离心管中,氮气吹干后用甲醇溶液定容至1 mL,用0.22 μm的滤膜过滤后待测[13]。色谱条件:色谱柱为150 mm×4.6 mm、5 μm的SB-C18柱;流动相为甲醇-水(体积比7∶3);流速为:0.4 mL/min;进样量为10μL;柱温为30℃;检测波长为254nm。
采用高效液相色谱测定有机磷农药氧乐果的残留量[14]。吸取解磷细菌的发酵液5 mL于离心管中,与等体积乙酸乙酯混匀并剧烈震荡20 min 萃取;静置30 min 待萃取剂与水相分层后,吸取上层有机相;用旋转蒸发仪蒸干后,加入等体积甲醇-水(体积比1∶9)溶解,用孔径为0.22 μm的滤膜过滤后待测。色谱条件:色谱柱为3.0 mm×150 mm、3.5 μm 的ZORBAX Eclipse PlusC18 柱;流动相为甲醇-水(体积比9∶1);流速为1.0 mL/min;进样量为10 μL;柱温为30 ℃;检测波长为200 nm。
1.7 解磷细菌对有机磷农药的降解特性
制备含有机磷农药辛硫磷和氧乐果浓度分别为100 μg/mL、200 μg/mL、400 μg/mL、600 μg/mL、800 μg/mL 和1 000 μg/mL 的 无 机 盐 培 养 基,在30 ℃、200 r/min 震荡培养48 h 后,测定辛硫磷和氧乐果的降解率,以确定解磷细菌对有机磷农药的最适降解浓度。
制备含有机磷农药辛硫磷浓度为800 μg/mL和氧乐果浓度为400 μg/mL 的无机盐培养基。在20 ℃、25 ℃、30 ℃、35 ℃和40 ℃下,200 r/min震荡培养48 h后,测定辛硫磷和氧乐果的降解率,确定最适温度。在培养基初始pH分别为4.0、5.0、6.0、7.0、8.0、9.0,在30 ℃、200 r/min 震荡培养48 h后,测定辛硫磷和氧乐果的降解率,确定最适初始pH。在30 ℃下分别在100 r/min、120 r/min、140 r/min、160 r/min、180 r/min、200 r/min震荡培养48 h 后,测定辛硫磷和氧乐果的降解率,确定最适转速。以2%、4%、6%、8%、10%的接种量将解磷细菌接种至培养基中,在30 ℃、200 r/min震荡培养48 h后,测定辛硫磷和氧乐果的降解率,确定最适接种量。在30 ℃下200 r/min 震荡培养,分别在发酵后12 h、24 h、36 h、48 h、60 h、72 h结束发酵,测定辛硫磷和氧乐果的降解率,确定最佳降解时间。
1.8 解磷细菌突变株的遗传稳定性试验
将突变株接种于蒙金娜有机磷培养基中,连续传代培养8 次后进行发酵,分别测定有机磷降解量。
2 结果与分析
2.1 吸收剂量与解磷细菌存活率的关系
将辐照后的菌液梯度稀释后涂布在平板培养基上,得到存活率曲线如图1 所示。由图1 可知,辐照至吸收剂量50 Gy 后,菌株存活率迅速降低,仅为55.2%;当吸收剂量增加至80 Gy 时,存活率有所回升,达到70.3%;吸收剂量在150 Gy时,大量菌体致死,存活率明显降低;吸收剂量大于150 Gy时,菌体存活率继续下降,但下降速率缓慢,这可能是因为离子辐照所带电荷沉积在生物体内,影响了DNA碱基间的电子转移,对DNA起了保护作用[15]。

图1 吸收剂量与解磷细菌存活率曲线Fig.1 Dose-effect curve of survival of phosphatesolubilizing bacteria
2.2 解磷细菌的初筛
不同剂量离子束辐照处理过的菌液经过恒温培养,测定细菌的溶磷圈直径(D)和菌落直径(d),D/d值的变化与菌株代谢产物在培养基上蔓延程度有关系。表1列出了不同剂量下突变菌株在蒙金娜培养基平板上的D/d值。由表1可知,经过72 h培养,降解有机磷效果优于原始菌株的突变菌株共24株,其中剂量在50~80 Gy时共有突变菌株5 株,且D/d值均小于2.2;剂量在120~270 Gy 时共有19 株,D/d值全部大于2.2。24 株突变菌株的D/d值在2.01~3.14之间,最大的是剂量150 Gy的3号突变菌株,达3.14。经过不同吸收剂量处理的细菌,其D/d值虽有差异,但每个剂量均出现突变菌株D/d值大于原始菌株,说明菌株经过不同离子束辐照处理后,其降解有机磷的能力均有所提高。
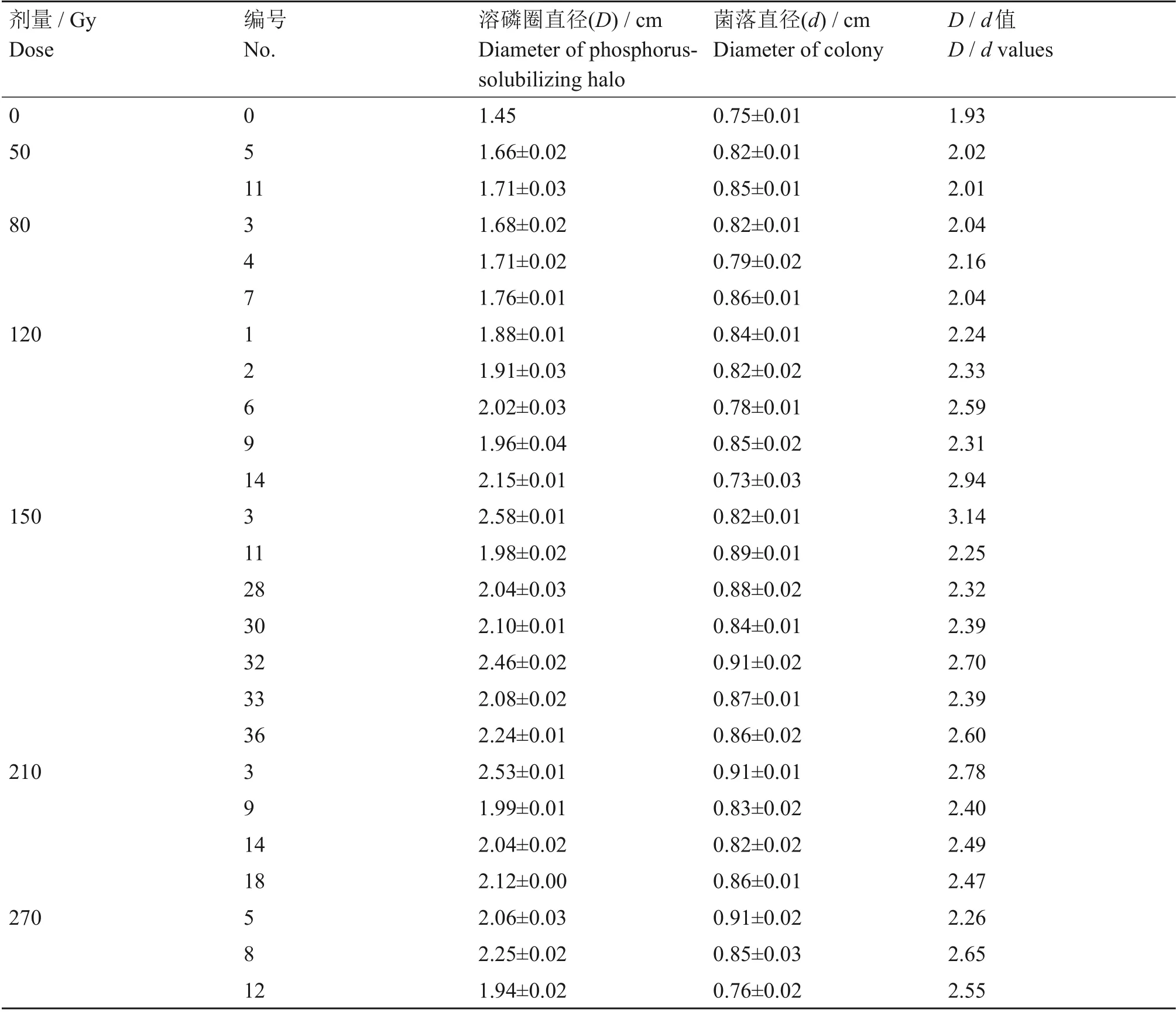
表1 不同吸收剂量下解磷细菌的D/d值Table 1 D/d value of phosphate-solubilizing bacteria at different doses
2.3 解磷细菌的复筛
为了对解磷细菌的降解有机磷能力进行定量分析,本研究采用钼锑抗比色法,并利用卵磷脂作为有机磷的唯一磷来源,测定解磷细菌分解有机磷能力的大小。初筛获得的24 株细菌的降解有机磷能力测定结果见表2。结果表明:经不同吸收剂量处理后,突变菌株的干重差异不明显,但降解有机磷能力存在明显差异,吸收剂量在50~80 Gy 时,菌株对有机磷降解量均在70 mg/L 以下;吸收剂量在120~270 Gy 时,有机磷降解量有了明显提高,其中吸收剂量为150 Gy 时的3 号突变菌株对有机磷降解量达到最高161.71 mg/L,较原始菌株解磷能力提高了2.89倍,命名为LA-1。

表2 不同剂量下细菌降解有机磷的含量Table 2 Phosphate solubilizing capacities of bacteria at different doses
2.4 解磷细菌和有机磷农药起始浓度的关系
在无机盐培养基中分别加入有机磷农药辛硫磷和氧乐果,使其终浓度分别为100 μg/mL、200 μg/mL、400 μg/mL、600 μg/mL、800 μg/mL和1 000 μg/mL,在30 ℃、200 r/min 震荡培养48 h后,测定辛硫磷和氧乐果的降解率,结果见图2。原始菌株LA对辛硫磷的降解率随着浓度的升高而迅速降低,降解率在81.4%~26.6%;与之相比,突变菌株LA-1 对不同浓度的辛硫磷降解率均明显高于原始菌株,尤其在浓度为800 μg/mL时对辛硫磷的降解率达到93.5%,在浓度小于800 μg/mL 时降解率均在90%以上,浓度大于800 μg/mL时降解率有所降低。原始菌株LA对不同浓度的氧乐果降解率在60.5%~18.7%,均小于突变菌株LA-1;突变菌株对低浓度的氧乐果有良好的降解效果,当浓度为400 μg/mL 时降解率为83.6%,对高浓度氧乐果的降解效果较差。

图2 有机磷农药浓度对菌株LA-1降解能力的影响Fig.2 Effect of initial concentration on phoxin and omethoate degradation by strain LA-1
菌株LA-1 在以有机磷农药辛硫磷、氧乐果为唯一碳源的培养基中均可以迅速生长,说明经离子束辐照选育的菌株LA-1 对有机磷农药辛硫磷和氧乐果均有降解效果,尤其对辛硫磷降解效果最佳。因此,选择辛硫磷浓度800 μg/mL、氧乐果浓度400 μg/mL为最佳起始浓度。
2.5 菌株LA-1对有机磷农药的降解特性
在无机盐培养基中分别加入有机磷农药辛硫磷和氧乐果,使其浓度分别为800 μg/mL和400 μg/mL,接种原始菌株LA 和突变菌株LA-1,经不同温度、初始pH、转速、接种量和不同降解时间的条件培养后,测定辛硫磷和氧乐果的降解率,结果见图3。
突变菌株LA-1 在不同温度时,对辛硫磷和氧乐果的降解率均高于原始菌株LA;在温度较高或较低时,LA-1和LA对辛硫磷和氧乐果的降解效果均较差,当温度为30 ℃时,2 株菌对二者的降解效果为最佳。
在不同pH时,菌株LA-1对辛硫磷的降解率均高于菌株LA,在碱性条件下,2 株菌对辛硫磷的降解效果好于酸性条件,当pH 为7.0 时,降解效果最佳;在碱性条件下,菌株LA-1 对氧乐果的降解率小于菌株LA,在酸性条件下,LA-1降解率高于LA,在pH 为7.0 时,2 株菌对氧乐果的降解率最高。
转速的大小直接影响到供氧量的高低,转速过低菌株无法与氧气充分接触,菌株LA-1 在不同温度时,对辛硫磷和氧乐果的降解率均高于菌株LA,且在转速为200 r/min 时,2 株菌对辛硫磷和氧乐果的降解效果均为最佳。

图3 温度(a)、pH(b)、转速(c)、接种量(d)和培养时间(e)对菌株LA-1降解有机磷农药降解的影响Fig.3 Effects of temperature(a),pH(b),rotation speed(c),incubation ratio(d),and incubation time(e)on phoxin and omethoate degradation by strain LA-1
接种量的多少主要影响菌体的生长速度,过低则生长慢,不能形成正常的菌体量以维持正常代谢,菌株LA-1 在不同接种量时,对辛硫磷和氧乐果的降解率均高于菌株LA,在接种量为10%时,2株菌对辛硫磷和氧乐果的降解效果最佳。
微生物发酵有一个特定的发酵周期,若发酵时间较短不利于农药的降解,若发酵时过长菌体则较早进入衰亡期,菌株LA-1 和LA 对辛硫磷的降解率在前24 h较缓慢,在24~48 h降解率明显提高,48 h 后趋于稳定,且在不同时间下,LA-1 对辛硫磷的降解率均高于LA,最佳降解时间为48 h;菌株LA-1 在不同时间下对氧乐果的降解率均高于LA,随着时间的增长,2株菌的降解率缓慢升高,在48 h后趋于平稳,因此48 h为最佳降解时间。
2.6 菌株LA-1的遗传稳定性试验
菌株LA-1 在蒙金娜有机磷培养基中连续培养8 代,温度30 ℃,转速200 r/min 培养48 h,测定菌株LA-1 降解有机磷能力,结果如表3 所示。结果表明,菌株LA-1 降解有机磷能力稳定性良好,生物量均在0.30 g左右,有机磷降解量在160 mg/L左右。
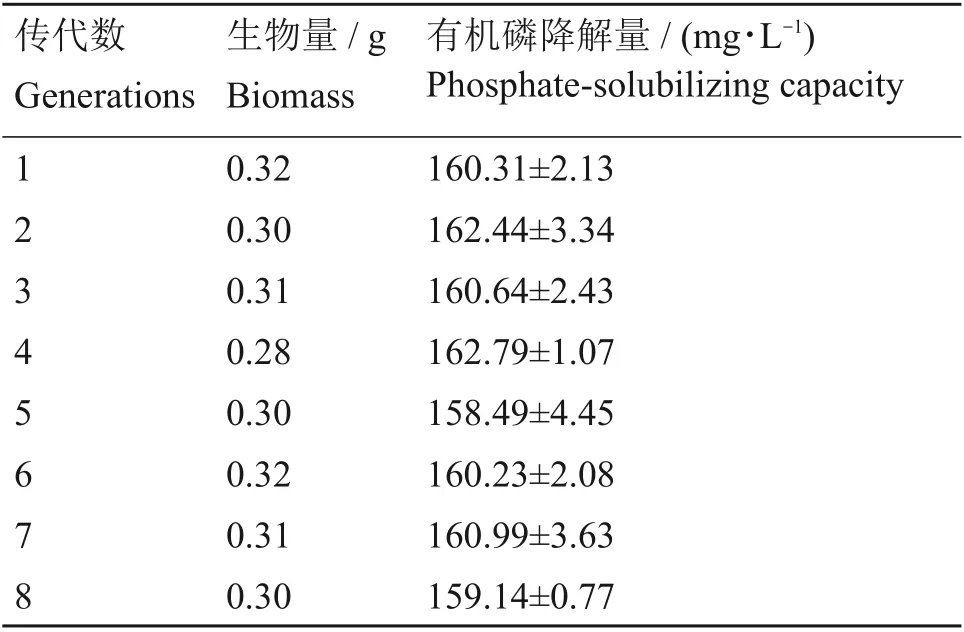
表3 菌株LA-1经8代传代培养后降解有机磷的含量Table 3 Phosphate solubilizing capacities of LA-1 after 8 generations
3 讨论
离子束辐照诱变育种技术作为微生物高效筛选和改良菌种的手段,具有诱变作用强、菌株突变率高,及突变体性能稳定等优点。一些学者认为,低能离子辐照生物体产生的马鞍型剂量效应曲线本质上就是低剂量超敏感性/增强的辐射抗性(Low dose hyperradio sensitivity/increased radioresistance, HRS/IRR)效应[16-18],利用该效应诱变可能获得理想的突变体[19]。在类芽孢杆菌(Paenibacillussp.)、酿 酒 酵 母(Saccharomyces cerevisiae)以及水稻种子中都发现了类似规律[20-22]。本研究中,60 keV12C6+离子的吸收剂量为50 Gy时,菌株的存活率降低,当吸收剂量增加至80 Gy时,菌株存活率逐渐升高,而当吸收剂量继续增加时,存活率又随着剂量的增加迅速降低,整个存活率曲线呈现“马鞍型”,这与其他研究结论一致。本研究发现,吸收剂量为150 Gy 时,突变菌体最多且降解有机磷农药效果最好。同时为利用离子束诱变选育高效降解有机磷农药的突变菌株提供了参考依据。
微生物具有种类多、变异快和易操作等优点,是进行生物修复的重要生物资源。沈雨佳等[13]分离得到1 株戴尔福特菌属(Delftiasp.)可以在7 h内完全降解100 mg/L的辛硫磷;于婷等[23]对嗜铁细菌枯草芽胞杆菌(Bacillus subtilis)Bs-15进行驯化,使其在辛硫磷浓度达到800 mg/L时仍可生长;杨小蓉等[24]分离获得1 株巨大芽孢杆菌(Bacillus megaterium)可以在以氧乐果为唯一碳源的基础培养基中良好生长。本研究通过离子束辐照处理后得到的菌株LA-1在辛硫磷浓度为100~1 000 μg/mL时,其降解率在99.2%~78.3%;氧乐果浓度为100~1 000 μg/mL 时,降解率在98.5%~44.3%,菌株LA-1 对有机磷农药辛硫磷和氧乐果均有较好的降解能力。本研究为微生物降解有机磷农药的研究提供了菌种资源。
目前,针对有机磷农药降解菌在生物修复中的应用已经开展了广泛的研究。张广志等[25]分离出2 株巨大芽孢杆菌(Bacillus megaterium)、1 株地衣芽孢杆菌(B.Licheniformis)和1 株假单胞菌属菌(Pseudomonas)并制备成菌剂,结果表明,4种菌剂处理30 d后,对甲胺磷和甲基对硫磷的降解率均在78%以上;牛明芬等[26]筛选出2 种复合微生物菌剂,当毒死蜱浓度为100 mg/L 时,培养5 d 后2 种复合菌剂的降解效率分别为81.21%和86.57%;Zhu 等[27]筛 选 出1 株 地 衣 芽 孢 杆 菌(Bacillus licheniformis) 和1 株 巨 大 芽 孢 杆 菌(Bacillus megaterium)均可降解阿特拉津,将2 株菌制备成复合菌剂时,对阿特拉津(50 mg/kg)作用7 d 后的降解率达到99.0%。因此,将本研究中突变菌株LA-1 制备成菌剂,用于降解环境中的有机磷农药将是下一步研究方向。在微生物降解有机磷农药过程中,不同品种有机磷农药由于其分子结构和理化性质的不同,对生物降解的敏感性差别很大[28-29]。农药的化学结构决定了溶解性、分子排列和空间结构、分子间的吸引和排斥特征并影响农药能否被微生物所降解[30]。在实际环境中,大多情况下为2种及以上农药的复合污染,可采用突变菌株LA-1 与其他微生物混合培养技术,利用菌种间协同关系筛出安全、稳定、高效的复合菌系,充分发挥微生物的优势。本研究为降解有机磷农药的离子束诱变选育提供了参考依据,为降解有机磷农药菌剂的开发应用提供了菌种资源和理论依据。
