解脂亚罗酵母Y-2对葡萄采后病害及赭曲霉毒素A的控制作用
2020-09-01张晓云顾香玉赵利娜郑香峰杨红娟张红印
张晓云 顾香玉 赵利娜 郑香峰 杨红娟 李 军 张红印*
(1 江苏大学食品与生物工程学院 江苏镇江212013 2 江苏科技大学粮食学院 江苏镇江212003)
葡萄皮薄多汁, 在贮藏和运输过程中极易受到病原菌的侵染而引起腐烂变质, 降低其食用品质和商业价值,并造成严重的经济损失。纯绿青霉(Penicillium verrucosum)[1-2]、 赭曲霉(Aspergillus ochraceus)[3]、炭黑曲霉(A. carbonarius)[4-6]以及黑曲霉(A. niger)[5-6]等致病菌不仅能引起葡萄采后腐烂, 还会产生有毒的次级代谢产物——赭曲霉毒素A(OTA)。OTA 主要以其肾毒性而闻名,此外还具有肝毒性、致癌性、致畸性、免疫以及遗传毒性等[7]。 葡萄被产OTA 的病原菌侵染后,不仅造成巨大的经济损失, 还会对人类健康造成极大的危害[8-9],必须采取有效的措施控制葡萄采后病害及OTA 污染。控制OTA 产生菌的生长是控制葡萄及其制品OTA 污染的最有效措施[10-11]。 利用化学杀菌剂可有效控制OTA 产生菌的生长, 从而控制OTA 的污染。 然而,化学杀菌剂长期、大量的使用会使致病菌产生耐药性,造成环境污染,其残留和积累还会对人类健康造成危害[8,12]。 利用拮抗酵母进行生物防治的方法逐渐引起国内外研究人员的重视并呈现良好的应用前景。
微皱篮状菌(Talaromyces rugulosus)O1 是本实验室从葡萄上分离、筛选到的能够产生OTA 的致病菌[13],而解脂亚罗酵母(Yarrowia lipolytica)Y-2 是从葡萄上分离、 筛选到的1 株能够体外降解OTA 的酵母菌株[14]。 本文以该酵母菌株为研究对象, 考察其对不同品种葡萄由微皱篮状菌O1引起的采后病害以及OTA 积累的控制效果,以期为拮抗酵母在葡萄采后病害和OTA 控制中的应用提供参考。
1 材料与方法
1.1 主要设备与仪器
全自动高压蒸汽灭菌器,美国zealway 医疗器械有限公司;Eppendorf 5810R 高速冷冻离心机,德国Eppendorf 公司;LRH-250 生化培养箱,上海一恒科技有限公司; 安捷伦1260 高效液相色谱仪,Agilent Technologies 公司。
1.2 培养基
1)NYDA 培养基 8 g 牛肉浸膏,5 g 酵母浸膏,20 g 琼脂粉以及10 g 葡萄糖,溶解后用蒸馏水定容1 000 mL,121°C 灭菌20 min。
2)PM 培养基 2 g 麦芽糖,10 g 蔗糖,5 g 酵母浸膏,5 g 蛋白胨, 用蒸馏水定容1 000 mL,121℃灭菌20 min。
3)PDA 培养基 200 g 去皮土豆,将其切块、煮沸20 min, 过滤并添加20 g 葡萄糖,20 g 琼脂粉,用蒸馏水定容1 000 mL,115°C 灭菌20 min。
1.3 微生物培养
挑取2~3 环NYDA 斜面上的解脂亚罗酵母Y-2 于含有50 mL PM 培养基的三角瓶中,在28℃、 180 r/min 条件下振荡培养36 h,然后在4 ℃、7 500×g 条件下离心10 min,收集菌体,用无菌水洗涤,重复此操作2 次。以无菌水调至合适浓度待用。
挑取PDA 斜面上的微皱篮状菌O1 孢子,于PDA 斜面上划线, 置于25 ℃培养箱中培养1 周,然后以无菌水洗下孢子, 调整孢子浓度为1×105孢子/mL。
1.4 葡萄预处理
采用商业成熟度良好且表面无破损、 质地均匀、大小一致的葡萄,用自来水冲洗表面,然后用0.1%NaClO 溶液浸泡1 min, 自来水冲洗干净,放入消毒塑料筐中于室温晾干,备用。
1.5 OTA 浓度的测定
参考Yang 等[14]的方法,利用高效液相色谱(HPLC)测定OTA 浓度。 具体条件:Zorbax SBC18 色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈-1%乙酸(体积比60 ∶40),流速1.0 mL/min,进样量20 μL,柱温30 °C,检测波长和激发波长均为333 nm,发射波长460 nm。
1.6 解脂亚罗酵母Y-2 处理对葡萄采后病害的控制作用
参考Li 等[15]的方法,用打孔器在葡萄赤道处打孔3 mm(宽)×3 mm(深),每孔接种10 μL 解脂亚罗酵母Y-2 菌悬液。 2 h 后接种10 μL 微皱篮状菌O1 孢子悬浮液(1×105孢子/mL)。 2 h 后用保鲜膜将塑料筐包裹起来,置于恒温、恒湿培养箱内(25°C,RH 95%)贮藏,分别记录第14 天葡萄的腐烂直径。 每框包含36 个葡萄,每个试验3 个平行,整个试验重复两次。以无菌水代替解脂亚罗酵母Y-2 菌悬液作为对照组。
考察解脂亚罗酵母Y-2 对不同品种葡萄(夏黑、巨峰、红提)采后病害的控制作用,操作方法同上。 酵母菌悬液的浓度为1×108细胞/mL。
考察不同浓度解脂亚罗酵母Y-2 对红提葡萄采后病害的控制作用时, 酵母菌悬液的浓度分别为1×106,1×107,1×108,1×109细胞/mL。
考察解脂亚罗酵母Y-2 处理对贮藏不同时间的红提葡萄采后病害的控制作用, 酵母菌悬液的浓度为1×108细胞/mL, 记录腐烂直径的时间分别为9,11,13,15,17 d。
1.7 解脂亚罗酵母Y-2 对葡萄中OTA 的控制作用
操作同1.6 节,14 d 时测定不同品种葡萄伤口处OTA 的积累量。 OTA 的提取方法:取腐烂直径相似的葡萄(夏黑、巨峰、红提),打浆,将浆液转移至锥形瓶中, 加入一定体积的三氯甲烷, 置于25°C 摇床中缓慢振摇24 h,收集萃取液。 重复萃取2 次,合并萃取液并旋转蒸发。蒸发结束后在避光条件下向近干的圆底烧瓶中快速加入1 mL 甲醇复溶,离心(12 000 × g,15 min)后的上清液经0.22 μm 有机滤膜过滤,用于OTA 浓度测定。葡萄伤口处的OTA 积累量以ng/伤口计。
考察解脂亚罗酵母Y-2 对不同品种葡萄(夏黑、巨峰、红提)伤口处OTA 积累的控制作用时,操作方法同上,酵母菌悬液的浓度为1×108细胞/mL。
考察不同浓度解脂亚罗酵母Y-2 对红提葡萄伤口处OTA 积累的控制作用时,酵母菌悬液的浓度分别为1×106,1×107,1×108,1×109细胞/mL。
考察解脂亚罗酵母Y-2 处理对贮藏不同时间的红提葡萄伤口处OTA 积累的控制作用,酵母菌悬液的浓度为1×108细胞/mL, 取样测定OTA的时间分别为9,11,13,15,17 d。
1.8 数据统计与分析
数据统计学分析采用SPSS 17.0 软件进行单因素方差分析、方差同质性检验,当P<0.05 时,数据具有显著性差异。
2 结果与讨论
2.1 解脂亚罗酵母Y-2 对葡萄采后病害和OTA的控制作用
由图2 可知,微皱篮状菌O1 在不同品种葡萄伤口处产生的OTA 各不相同, 红提中含量最高,夏黑和巨峰中OTA 含量极低。 而经解脂亚罗酵母Y-2 处理后, 葡萄伤口处OTA 含量均低于对照,尤其是红提伤口处OTA 含量降低最为显著,与对照相比降低了83.3%。由于微皱篮状菌O1 在夏黑
如图1 所示,解脂亚罗酵母Y-2 对不同品种葡萄采后由微皱篮状菌O1 引起的腐烂均有显著的控制作用,能显著降低葡萄的腐烂直径。与对照相比,经解脂亚罗酵母Y-2 处理的夏黑、巨峰和红提葡萄, 第14 天的腐烂直径分别降低了28.7%,19.7%和18.5%。和巨峰葡萄中产生的OTA 量太低,因此无法考察解脂亚罗酵母Y-2 对OTA 积累的控制效果。后续试验选用红提葡萄作为研究对象。
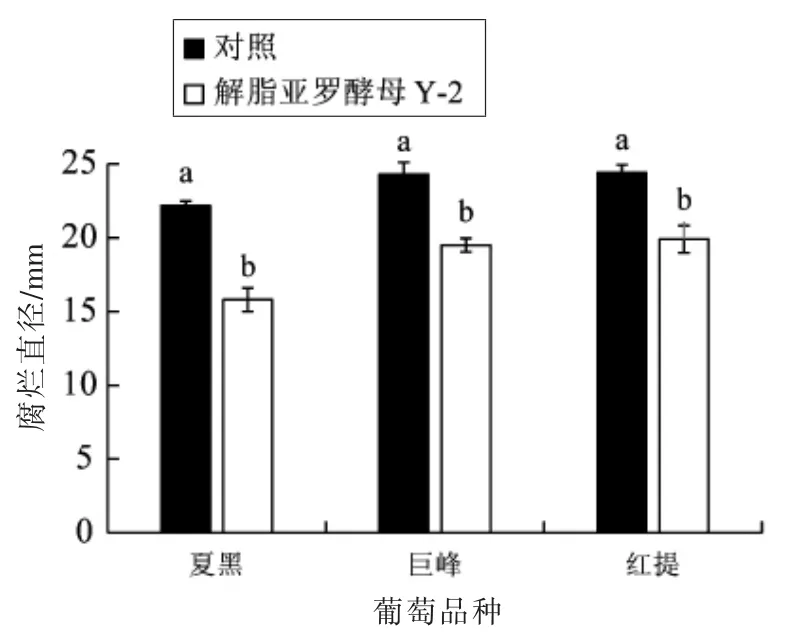
图1 解脂亚罗酵母Y-2 对葡萄由微皱篮状菌O1 引起的腐烂直径的影响Fig.1 Effect of Y. lipolytica Y-2 on the lesion diameter of grapes caused by T. rugulosus O1
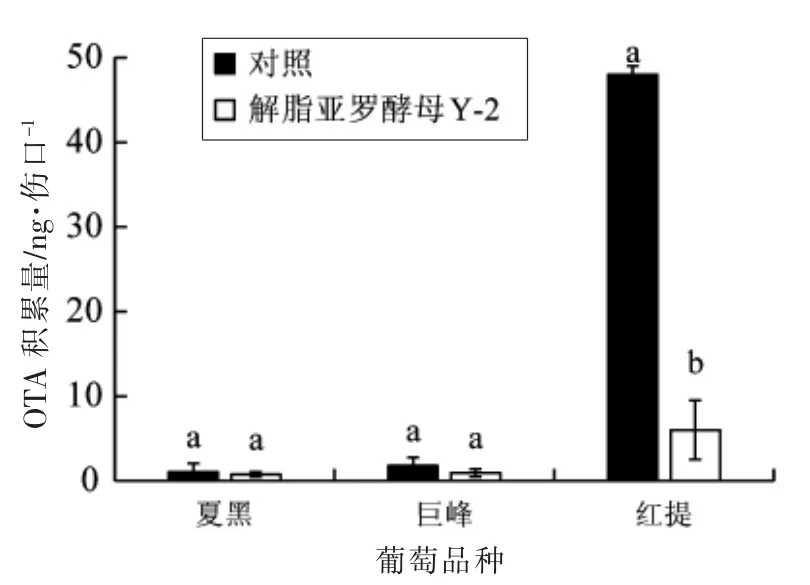
图2 解脂亚罗酵母Y-2 对葡萄伤口处OTA积累量的影响Fig.2 Effect of Y. lipolytica Y-2 on OTA accumulation in the wounds of grapes
近十几年来, 国内外利用拮抗酵母控制农产品由致病菌引起的采后病害及真菌毒素污染的研究取得一定的成果。Velmourougane 等[16]发现,用酿酒酵母(Saccharomyces cerevisiae)处理田间咖啡,可以显著降低由黑曲霉和赭曲霉引起的发病率及OTA 的产生。 Zhu 等[17]研究表明,假丝酵母(Candida zemplinina)M3、酿酒酵母M114、酿酒酵母C297、克鲁维毕赤酵母(Pichia kluyveri)M117 和Metschnikowia aff. fructicola M179 5 株酵母菌均能够显著抑制葡萄上炭黑曲霉和赭曲霉的生长及OTA 的产生。 本研究中,解脂亚罗酵母Y-2 对葡萄由微皱篮状菌O1 引起的采后病害均有显著的控制效果,能显著降低红提葡萄伤口处OTA 的积累。OTA 在葡萄伤口处积累的减少,一方面是由于拮抗酵母抑制了产毒菌的生长[11,16-17],另一方面是该酵母对产生的OTA 的降解作用[14]。
2.2 不同浓度解脂亚罗酵母Y-2 对红提葡萄采后病害和OTA 的控制作用
如图3 所示, 不同浓度的解脂亚罗酵母Y-2对红提葡萄采后由微皱篮状菌O1 引起的腐烂均有控制作用,尤其是高浓度的拮抗酵母。与对照相比,1×107,1×108,1×109细胞/mL 的解脂亚罗酵母Y-2 处理均可显著减小红提葡萄的腐烂直径,且葡萄腐烂直径随酵母浓度的增加而减小。 当酵母浓度为1×108细胞/mL 时, 其腐烂直径为19.5 mm,相比于对照(25.8 mm)降低了23.8%。
如图4 所示, 不同浓度的解脂亚罗酵母Y-2对红提葡萄伤口处由微皱篮状菌O1 产生的OTA积累均有显著的控制效果。 对照组葡萄伤口处OTA 积累量为50 ng/伤口, 而经1×108细胞/mL和1×109细胞/mL 的解脂亚罗酵母Y-2 处理的葡萄伤口处OTA 积累量分别为5.95 ng/伤口和3.53 ng/伤口,OTA 积累量显著降低。 葡萄伤口处OTA 的积累量随着解脂亚罗酵母Y-2 浓度的增加而降低,与葡萄腐烂直径的变化趋势一致。 Zhu等[17]发现,酿酒酵母M114 菌悬液浓度越大,对葡萄上炭黑曲霉和赭曲霉的抑制作用越强, 测得的OTA 含量也越小,与本试验结果一致。
考虑到经济成本等因素,后续选用1×108细胞/mL 的解脂亚罗酵母Y-2 进行试验。
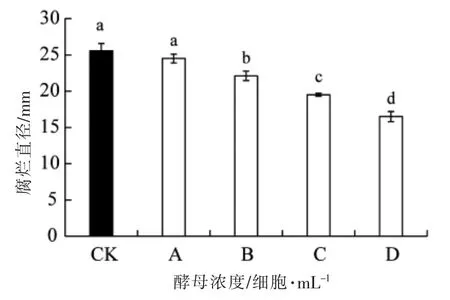
图3 不同浓度解脂亚罗酵母Y-2 对红提葡萄由微皱篮状菌O1 引起的腐烂直径的影响Fig.3 Effect of Y. lipolytica Y-2 at different concentration on the lesion diameter of red globe grapes caused by T. rugulosus O1
2.3 解脂亚罗酵母Y-2 处理对贮藏不同时间的红提葡萄采后病害和OTA 的控制作用
如图5 所示, 对照组和经解脂亚罗酵母Y-2处理的红提葡萄腐烂直径均随贮藏时间的延长而增加,尤其是对照组,葡萄腐烂直径从14.2 mm(9 d)增到26 mm(17 d)。 而经解脂亚罗酵母Y-2 处理的葡萄腐烂直径从11.8 mm(9 d)增到19.8 mm(17 d)。 相同时间,处理组葡萄腐烂直径均显著低于对照组,17 d 的葡萄腐烂直径降低了23.8%。
如图6 所示,随着贮藏时间的延长,解脂亚罗酵母Y-2 处理组和对照组红提葡萄伤口处由微皱篮状菌O1 产生的OTA 积累量均逐渐增加。Lahouar 等[18]发现塔宾曲霉(A. tubingensis)产生的OTA 也随培养时间的增加而增加, 与本研究结果一致。 未经解脂亚罗酵母Y-2 处理的对照组葡萄伤口处OTA 的积累量在第11 天迅速增至35.20 ng/伤口,第17 天达到最大值(60.20 ng/伤口);而经该拮抗酵母处理的葡萄伤口处OTA 的积累量在同时间段分别为1.28 ng/伤口和29.1 ng/伤口,显著低于对照组, 且处理组葡萄腐烂直径也显著低于对照组,表明解脂亚罗酵母Y-2 处理对葡萄贮藏过程中由微皱篮状菌O1 产生的OTA 积累具有显著的控制效果。对产毒菌微皱篮状菌O1 的抑制作用是其原因之一。

图4 不同浓度解脂亚罗酵母Y-2 对葡萄伤口处OTA 积累的影响Fig.4 Effect of Y. lipolytica Y-2 at different concentration on OTA accumulation in the wounds of red globe grapes
3 结论
解脂亚罗酵母Y-2 对不同品种的葡萄由微皱篮状菌O1 引起的采后病害均有显著的控制效果, 且能显著降低红提葡萄伤口处OTA 的积累。与对照相比,该酵母处理的夏黑、巨峰和红提葡萄的腐烂直径分别降低了28.7%,19.7%和18.5%,红提葡萄伤口处OTA 积累量降低了83.3%。 OTA在葡萄伤口处积累的减少, 一方面是由于拮抗酵母抑制了产毒菌的生长, 另一方面是该酵母对产生的OTA 的降解作用。
随着酵母浓度的升高,解脂亚罗酵母Y-2 对红提葡萄采后病害和OTA 的控制效果增强,葡萄腐烂直径和伤口处OTA 的积累量均减少。 当酵母浓度为1×108细胞/mL 时, 红提葡萄腐烂直径比对照降低了23.8%, 伤口处OTA 积累量由50 ng/伤口,降到5.95 ng/伤口。
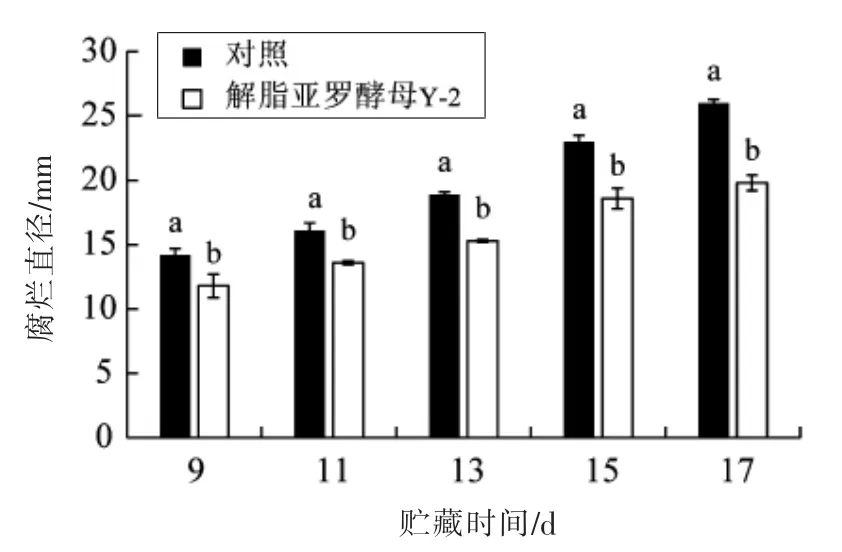
图5 解脂亚罗酵母Y-2 处理对贮藏不同时间的红提葡萄由微皱篮状菌O1 引起的腐烂直径的影响Fig.5 Effect of Y. lipolytica Y-2 on lesion diameter of red globe grapes stored for different times
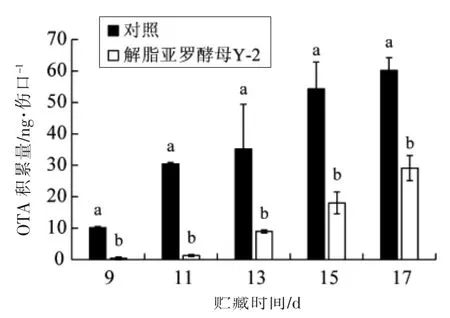
图6 解脂亚罗酵母Y-2 处理贮藏不同时间的红提葡萄伤口处OTA 积累的影响Fig.6 Effect of Y. lipolytica Y-2 on OTA accumulation in the wounds of red globe grapes stored for different time
在红提葡萄贮藏过程中,相同时间,解脂亚罗酵母Y-2 处理组红提葡萄腐烂直径和OTA 积累量均显著低于对照组,表明解脂亚罗酵母Y-2 在葡萄贮藏过程中对其采后病害和OTA 的积累均具有显著的控制效果。
