富含谷氨酰胺多肽的制备及其体外模拟消化
2020-09-01任娇艳林晓玲岑月妍尹西拳袁尔东
任娇艳 林晓玲 岑月妍 尹西拳 梁 明 袁尔东*
(1 华南理工大学食品科学与工程学院 广州510640 2 中新国际联合研究机构 广州510555 3 无限极(中国)有限公司 广州510665)
氧化应激是引起消化道黏膜损伤的重要因素之一。 摄入抗氧化活性物质可预防和治疗消化道黏膜疾病。 研究表明,谷氨酰胺(Gln)有助于提高超氧化物歧化酶和过氧化氢酶的活性, 促进物质抗氧化能力[1]。 此外,它能增强肠上皮细胞屏障功能, 增加结肠和小肠黏膜细胞合成和防止肠道毒素和细菌入侵[2]。 然而,Gln 的溶解度低,在水溶液中易水解,且受热易转化成有毒物质,因此其应用受到极大的限制。 Abumrad N[3]研究证实,谷氨酰胺肽的酰胺基比游离谷氨酰胺中的酰胺基稳定。Bilzer M 等[4]研究发现,谷氨酰胺二肽能够维持和增加肠黏膜细胞内谷胱甘肽的合成与储备, 减少氧自由基对肠黏膜的损害。 谷氨酰胺肽不仅保留了谷氨酰胺多种生理功能和营养, 还具有高水溶性、稳定性、吸收性和低致敏性等优点,可作为谷氨酰胺营养补充的稳定化替代品。
目前, 市场上常见的谷氨酰胺肽主要包括人工合成的Gly-Gln 和Ala-Gln。 人工合成法成本高、产量低且生产过程对环境有污染,使得谷氨酞胺二肽的产品推广受限[2]。 相反,蛋白酶解法作为天然和高效的多肽制备方法,近年来受到推崇。 乳清蛋白、 大米蛋白和小麦蛋白被报道具有保护胃肠道黏膜的功效, 且这几种蛋白中谷氨酰胺的含量相对较高[5-7],可作为天然谷氨酰胺肽制备的原料。
在体外模拟消化过程中,环境pH 的改变和消化酶的作用会影响抗氧化物质的降解、 转化和吸收。 相比于大分子质量肽,小分子质量肽在人体消化中具有更高的抗氧化活性和吸收利用率[8]。研究消化前、 后谷氨酰胺多肽的抗氧化活性变化对判断其在人体内的吸收利用情况, 以及能否发挥预防或治疗消化道黏膜疾病的功效具有重要的意义。
本研究以3 种谷氨酰胺含量高的蛋白原料(乳清、大米和小麦)为研究对象,通过酶解法制备富含谷氨酰胺的多肽,研究模拟消化前、后对其蛋白质含量、酰胺氮含量、分子质量分布和抗氧化活性的影响。 最终筛选出消化利用程度较高的谷氨酰胺多肽的酶解制备工艺参数和制剂形态, 为生产具有保护消化道黏膜功效的功能性食品提供理论依据。
1 材料与方法
1.1 材料与试剂
乳清蛋白粉,广州比灵天然配料有限公司。4°C 避光保存。 大米蛋白粉,陕西森弗天然制品有限公司。 避光保存于阴凉处。 小麦面筋蛋白粉,北京瑞麦嘉禾商贸有限公司。 避光保存于阴凉处。
胰蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、风味蛋白酶、胃蛋白酶,广西庞博生物科技有限公司;胃蛋白酶(高纯)、胰蛋白酶(高纯),上海源叶生物科技有限公司; 水溶性维生素E 标准溶液、荧光素钠溶液(Fluorescein)、偶氮二异丁脒盐酸盐(AAPH),上海阿拉丁生化科技股份有限公司;其余试剂均为分析纯级。
1.2 仪器与设备
八孔消化炉、KDN-1 型自动定氮仪, 上海纤检仪器有限公司; LC-20A 高效液相仪,日本岛津公司;Synergy H1 全功能酶标仪, 美国伯腾仪器有限公司;TSKgel-G2000SWXL,日本东曹株式会社。
1.3 试验方法
1.3.1 蛋白质含量测定 采用GB/T 5009.5-2003《凯氏定氮法》测定原料蛋白(乳清、大米和小麦)的总蛋白质氮含量以及各多肽的蛋白氮含量,按照公式(1)计算各多肽的蛋白质回收率。

1.3.2 富含谷氨酰胺蛋白肽的制备 乳清、 大米和小麦蛋白按照1∶10(m∶V)的料液比溶解,胰蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶和风味蛋白酶先于50 ℃下预热活化10 min。 酶解过程保持加酶量0.75%,温度50 ℃。 根据各酶的最适酶解条件, 调节酶解液pH 值分别为8.0,7.0,9.0,6.5 和6.0,酶解4 h 后采用沸水浴灭酶。 将各酶解液8 000 r/min 离心20 min,浓缩、冻干获得相应多肽。
1.3.3 酰胺氮含量的测定 参考陈思思[2]的方法并稍作修改。采用扩撒皿法测定酰胺氮含量,具体步骤如下: 配制1%蛋白酶解液于15 mL 水解管中,加入1.5 mL 12 mol/L HCl,1.5 mL H2O,封管后于110 ℃水解3 h。测定时在扩撒皿中央加入6 mL 硼酸溶液(2%)和6 滴甲基红溴甲酚绿混合指示剂, 同时移取2.4 mL 水解液于扩散皿外围,加入6 mL NaOH 溶液(40%)。 迅速盖好平板轻轻摇匀,充分混合水解液和NaOH。 室温反应2.5 h 后移去平板, 以0.01 mol/L 标准盐酸滴定扩散皿中央的硼酸溶液至微红色。按照公式(2)计算酰胺氮含量。

式中:WN——酰胺氮含量,mmol/g 蛋白;CHCl——标准盐酸浓度,mol/L; VHCL——标准盐酸体积,mL;WT——样品中蛋白含量,g。
1.3.4 肽分子质量分布的测定 参照任娇艳等[9]的方法, 采用凝胶色谱法测定多肽的相对分子质量分布。 分离柱为TSK G2000 SWXL (7.8 mm×300 mm),液相系统为岛津LC-20A,进样体积20 μL,检测波长214 nm。 流动相为0.1 mol/L PBS 和0.1 mol/L Na2SO4(pH 6.7),洗脱流速0.5 mL/min。
1.3.5 羟自由基清除活性的测定 羟自由基清除活性的测定参照唐正江[10]的方法并作适当修改。具体步骤是:
1)向10 mL 具塞试管中依次加入1.2 mL 邻二氮菲 (5 mmol/L),0.8 mL 磷酸盐缓冲液(pH 7.4),1.2 mL 蒸馏水,1.2 mL 15 mmol/L EDTA。 充分摇匀后,加入1.2 mL FeSO4溶液,混匀,加1.6 mL 0.1%H2O2,于37 ℃反应1 h。 反应结束后迅速取样于酶标仪中测定波长536 nm 处的吸光度,记为Ap。
2)以1.6 mL 蒸馏水代替本节1)中1.6 mL 0.1%H2O2,记为Ab。
3)用1.0 mL 1 mg/mL 多肽溶液代替本节1)中第1 次加入的蒸馏水,记为AS。
按照公式(3)计算OH·清除率R。

1.3.6 氧自由基吸收能力(ORAC)的测定 参照文献[11]、[12]方法测定氧自由基吸收能力(ORAC),并作适当修改。在96 孔荧光板各微孔中加入20 μL 75 mmol/L 磷酸盐缓冲溶液(pH 7.4)、待测多肽(50 μg/mL)及Trolox 标准溶液(6.25,12.5,25 μmol/L 和50 μmol/L), 于37 ℃孵 育10 min后, 用多道移液器迅速在各孔中加入200 μL 0.096 μmol/L 荧光素钠溶液, 继续于37 ℃下孵育20 min, 立即在各孔中加入20 μL 9.95 mol/L 偶氮二异丁脒盐酸盐(AAPH)激活反应,37 ℃恒温反应。 设置激发波长485 nm 和发射波长538 nm,每隔2 min 测定1 次各孔的荧光强度, 共测定3 h。采用标准曲线法,以Trolox 浓度为横坐标,以体系在抗氧化剂Trolox 作用下的净荧光衰减面积Net AUC 为纵坐标,建立ORAC 值计算的标准曲线。 根据各样品孵育下体系的荧光衰减面积计算各多肽的ORAC 值。
1.3.7 优选多肽的体外模拟胃肠消化 参考You L 等[13]的方法进行体外模拟胃肠消化道酶系的反应,并做适当调整。
1)模拟胃消化道酶系 30 mg/mL 多肽溶液用1.0 mol/L HCl 调节体系pH 值至2.0。加入胃蛋白酶(E/S=17/1000),适度搅拌,于37 ℃摇床中恒温孵育90 min 后置沸水浴中灭酶10 min。 将模拟胃消化产物浓缩、冻干,用于各指标测定。
2)模拟胃肠消化道酶系 多肽经胃消化道酶系消化90 min 后,先用0.9 mol/L NaHCO3调节pH 值至5.3,再用1.0 mol/L NaOH 调pH 值至7.5。 加入胰蛋白酶(E/S=2/125),适度搅拌,于37 ℃摇床中恒温孵育2 h 后置于沸水浴灭酶10 min。将模拟胃肠消化产物浓缩、冻干,用于各指标测定。
1.4 统计分析
肽分子质量分布测定的高效液相结果图由计算机采集,使用LC-solution 软件处理。 每组试验重复测定3 次,结果表示为平均值±标准偏差。 方差分析采用OriginPro8.5(OriginLab 公司)的单因素方差分析(one-way ANOVA),不同字母代表在P <0.05 有显著性差异。
2 结果与讨论
2.1 酶解条件对乳清蛋白肽特性的影响
不同酶解条件下制备的乳清蛋白酶解物的蛋白质回收率及酰胺氮含量如图1a 和1b 所示。 5种乳清蛋白肽的蛋白质回收率无显著性差异,且均大于70%(P >0.05)。 其中,胰蛋白酶组多肽的酰胺氮含量相对较高, 为(0.68±0.12)mmol/g 蛋白,与中性蛋白酶、木瓜蛋白酶和风味蛋白酶组多肽相比没有统计学差异(P >0.05)。
如图1c 所示,不同酶解条件下产生的多肽分子质量洗脱特性曲线具有很大的差异。 采用面积归一化法计算得到不同乳清蛋白肽各分子质量区段占比如图1d 所示,其中木瓜蛋白酶组多肽分子质量大于5 ku 的占比高达73.23%,显著高于其余4 种多肽在同一分子质量区段的占比(P <0.05),说明其酶解不完全。
如图1e 和1f 所示, 对各乳清蛋白肽的抗氧化活性进行考察,结果表明:胰蛋白酶组多肽和中性蛋白酶组多肽的羟自由基清除率分别为24.87%和37.65%; 而胰蛋白酶组多肽的ORAC活性显著高于其余各组(P <0.05), 为2.15 μmol TE/(L·mg)肽。
综合考虑, 最终选择ORAC 值较高的乳清蛋白肽(胰蛋白酶组)作为模拟消化的研究对象。
2.2 酶解条件对大米蛋白肽特性的影响
如图2a 所示,木瓜蛋白酶酶解大米蛋白的蛋白质回收率显著低于其余4 种蛋白酶酶解多肽(P<0.05)。 根据图2a 可知, 木瓜蛋白酶组(0.68 mmol/g 蛋白)和风味蛋白酶组的酰胺氮含量(0.64 mmol/g 蛋白)相对较高,且无统计学差异(P>0.05)。
如图2c 所示,中性蛋白酶、碱性蛋白酶和木瓜蛋白酶组多肽的分子质量洗脱曲线较平滑,而胰蛋白酶和风味蛋白酶组多肽在小分子质量区段出现尖锐的峰,揭示分子质量为1 ku 以下的多肽得到富集。 不同大米蛋白肽各分子质量区段占比如图2d 所示, 木瓜蛋白酶组的酶解效果最差,其分子质量小于1 ku 的肽段占比显著低于其余各组(P<0.05)。 由图2e 和2f 可知,风味蛋白酶组多肽的羟自由基清除能力和ORAC 抗氧化活性均优于其余各组,其羟自由基清除率为20.70%,ORAC值为1.18 μmol TE/(L·mg)肽。
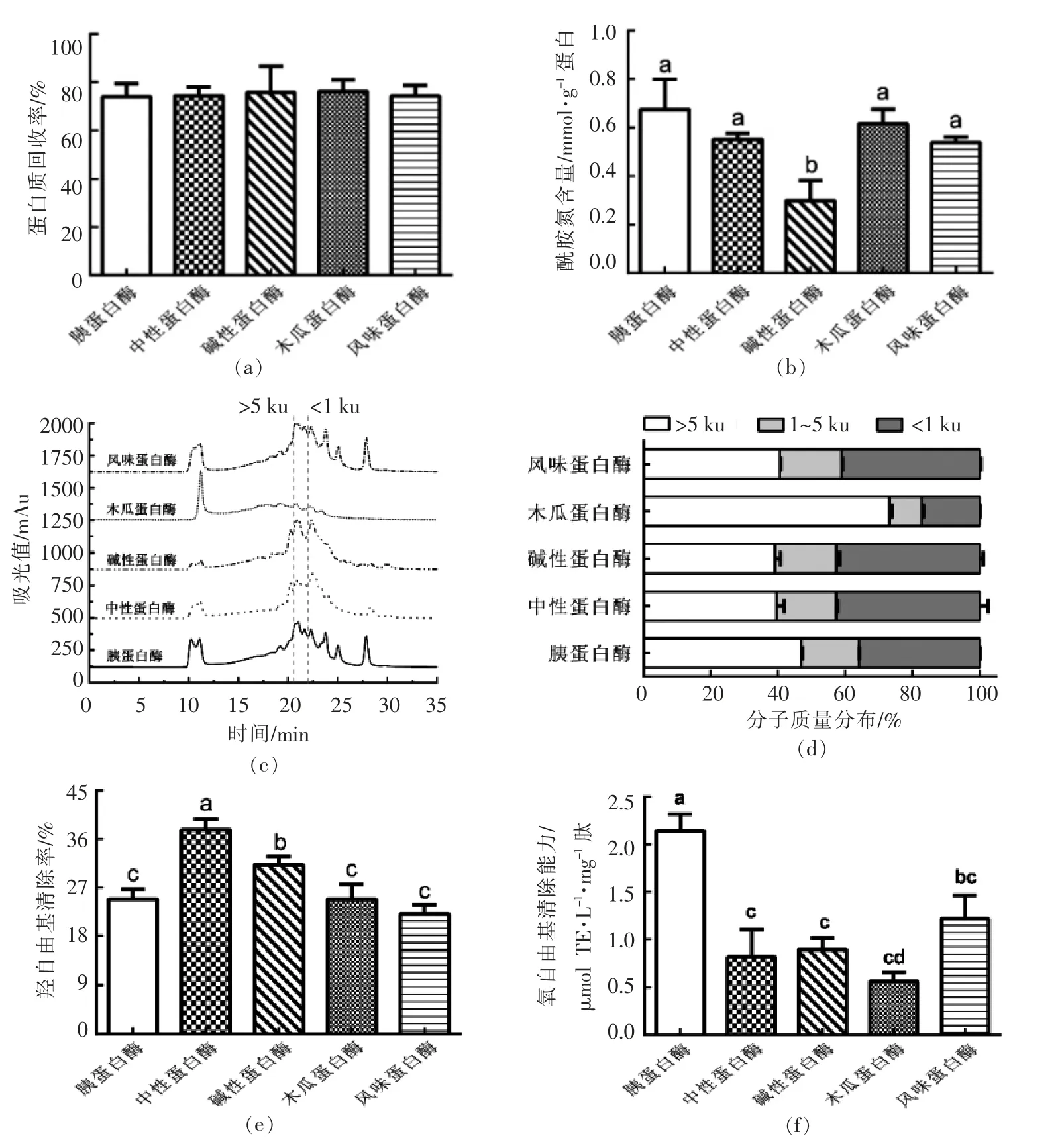
图1 酶解条件对乳清蛋白肽蛋白质回收率(a)、酰胺氮含量(b)、分子质量图谱(c)、分子质量分布比例(d)、羟自由基清除率(e)和氧自由基清除能力(f)的影响Fig.1 Influence of hydrolysis conditions on the protein recovery (a), amide nitrogen content (b), molecular weight chromatogram (c), molecular weight distribution (d), hydroxyl radical scavenging activity (e)and ORAC value (f)of whey peptides
综合上述因素,选择大米蛋白肽(风味蛋白酶组)作为模拟消化的对象。
2.3 酶解条件对小麦蛋白肽特性的影响
如图3a 和3b 所示, 小麦蛋白木瓜蛋白酶组多肽的蛋白质回收率和酰胺氮含量均显著低于其余各组(P <0.05),说明木瓜蛋白酶对含有谷氨酰胺的小麦蛋白的酶解影响显著。
图3c 显示,碱性蛋白酶和中性蛋白酶组多肽均在分子质量为5 ku 处的出峰时间后才被洗脱出来,表明这两种酶对小麦蛋白的酶解完全。结合图3d 结果可知,这两种酶酶解所得多肽的分子质量小于1 ku 的占比均高于80%,且显著高于其余各组(P <0.05)。
各多肽的抗氧化活性如图3e 和3f 所示。 木瓜蛋白酶组多肽的羟自由基清除能力显著高于其余各组(P <0.05),为26.30%,而其ORAC 抗氧化能力却显著低于其余各组(P <0.05)。 风味蛋白酶组多肽的ORAC 活性相对最高,为1.06 μmol TE/(L·mg)肽。
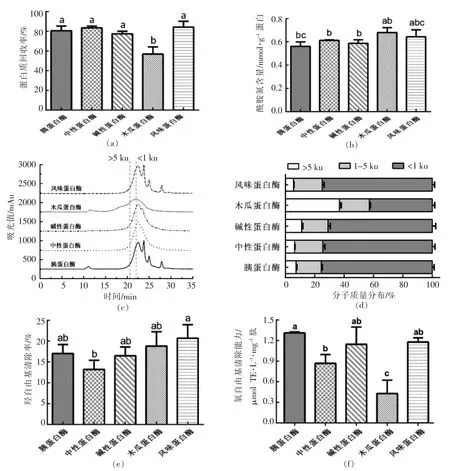
图2 酶解条件对大米蛋白肽蛋白质回收率(a)、酰胺氮含量(b)、分子质量图谱(c)、分子质量分布比例(d)、羟自由基清除率(e)和氧自由基清除能力(f)的影响Fig.2 Influence of different hydrolysis conditions on the protein recovery (a), amide nitrogen content (b),molecular weight chromatogram (c), molecular weight distribution (d), hydroxyl radical scavenging activity (e)and ORAC value (f)of rice peptides
综合考虑上述因素,选择小麦蛋白肽(风味蛋白酶组)作为模拟消化的对象。
2.4 胃、胃肠模拟消化对富含谷氨酰胺多肽特性的影响
2.4.1 乳清蛋白肽(胰蛋白酶组)根据图4a 可知,经胃、胃肠模拟消化后,乳清蛋白胰蛋白酶组多肽的蛋白质回收率与未消化多肽相比无显著性差异(P >0.05),表明胃、胃肠模拟消化对乳清蛋白肽蛋白质含量影响不显著。
如图4b 所示,经胃消化后多肽酰胺氮含量显著减少(P <0.05),而经胃肠消化后,酰胺氮含量增至与未经消化的乳清蛋白肽一致的水平, 表明胃肠模拟消化没有显著改变乳清蛋白肽的酰胺氮含量。
由图4c 可知,经胃、胃肠模拟消化后10~12 min 出现的洗脱峰逐渐消失, 表明大分子蛋白组分在消化阶段进一步转化成能被人体利用的小肽。 对各消化产物在各分子质量区段的占比进行统计,结果见图4d。 经胃肠模拟消化,小分子的寡肽(Mw <1 ku)占比显著增加21.61%(P <0.05),说明乳清蛋白肽经胃肠道消化后更易被人体吸收和利用。
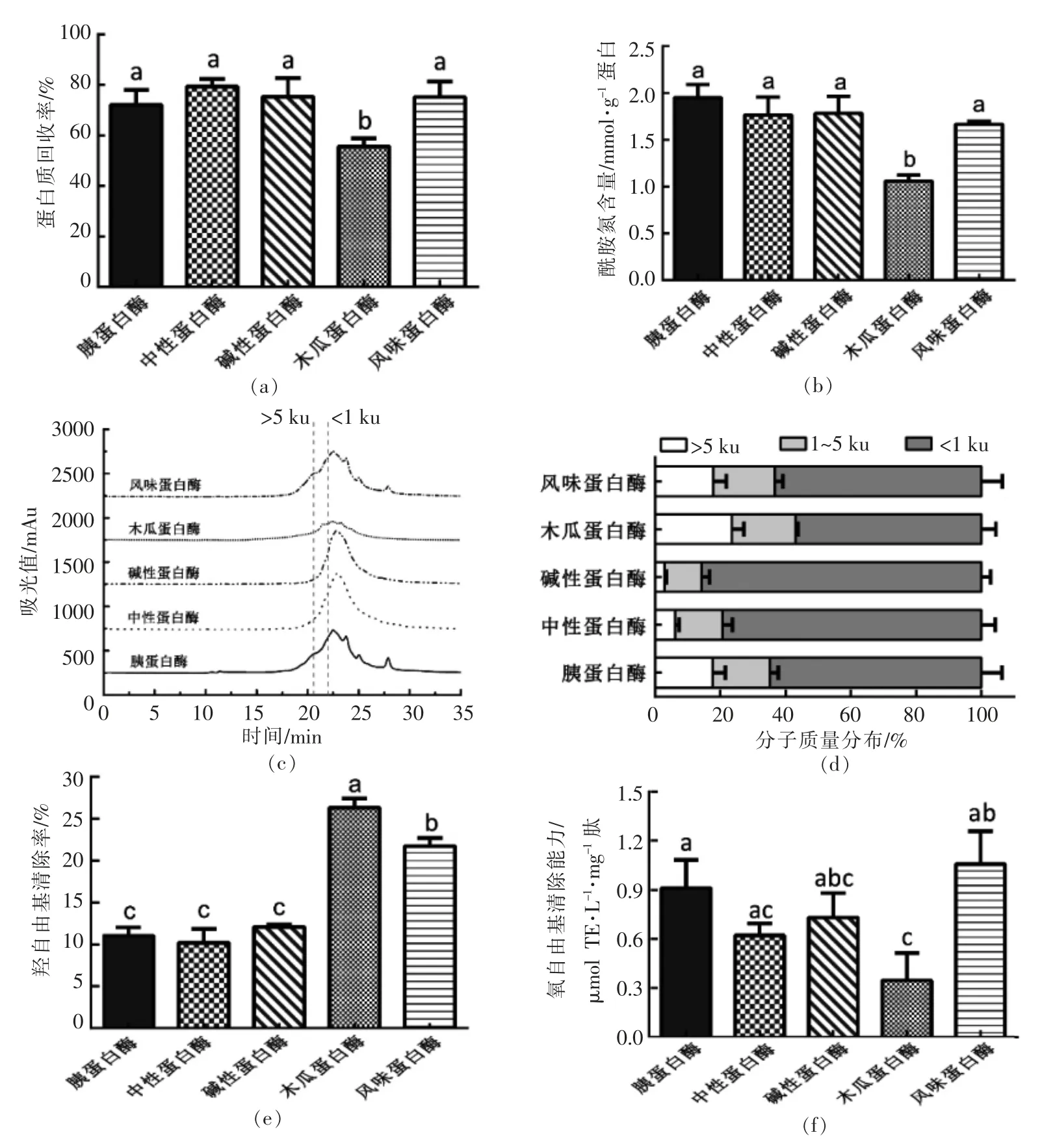
图3 酶解条件对小麦蛋白肽蛋白质回收率(a)、酰胺氮含量(b)、分子质量图谱(c)、分子质量分布比例(d)、羟自由基清除率(e)和氧自由基清除能力(f)的影响Fig.3 Influence of hydrolysis conditions on the protein recovery (a), amide nitrogen content (b), molecularweight chromatogram (c), molecular weight distribution (d), hydroxyl radical scavenging activity (e)and ORAC value (f)of wheat peptides
如图4e 所示,经胃模拟消化后,乳清蛋白肽的羟自由基活性无显著变化(P >0.05),而经肠消化后,乳清蛋白肽(10 mg/mL)的羟自由基活性显著降低至19.36%(P <0.05)。 结果表明,酸性条件和胃蛋白酶对乳清蛋白肽发挥羟自由基清除活性的相关肽组分无显著影响。相反,胰蛋白酶作用会进一步导致胃模拟消化产物中一些关键活性位点被酶切,从而影响其发挥作用。 图4f 显示,经胃、胃肠模拟消化后两种产物的ORAC 值均显著降低至1 μmol TE/(L·mg)肽左右(P <0.05)。
基于此, 可选择肠溶胶囊作为富含谷氨酰胺的乳清蛋白肽(胰蛋白酶组)功能性食品的包装材料。
2.4.2 大米蛋白肽(风味蛋白酶组)大米蛋白肽(风味蛋白酶组)的蛋白质回收率及酰胺氮含量分别见图5a 和5b。 经胃消化和胃肠消化后,蛋白质回收率无显著性差异(P >0.05)。 此外,经胃肠模拟消化的大米蛋白肽的酰胺氮含量也与未消化组无显著性差异(P >0.05)。
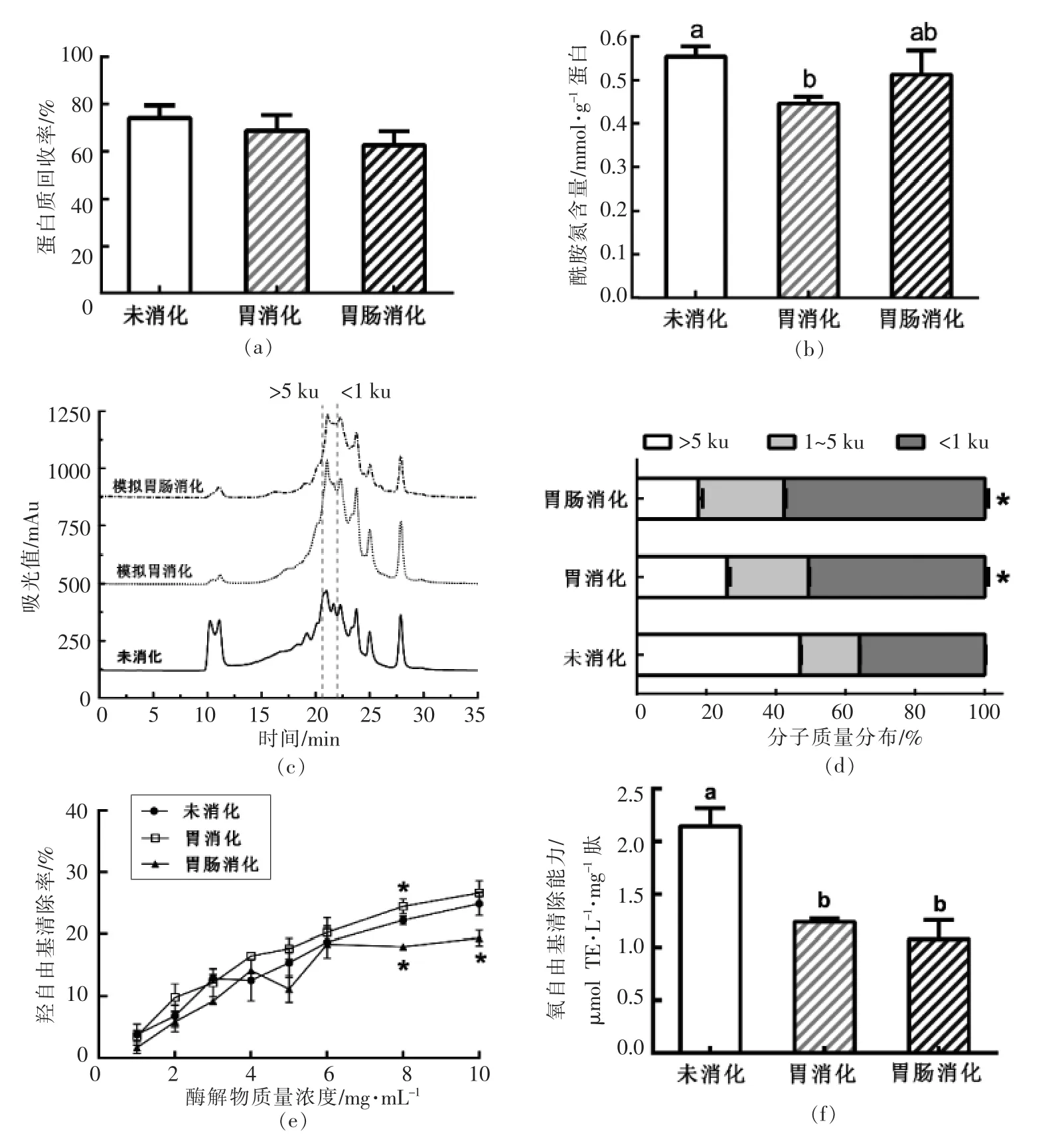
图4 模拟消化对乳清蛋白肽(胰蛋白酶组)蛋白质回收率(a)、酰胺氮含量(b)、分子质量图谱(c)、分子质量分布比例(d)、羟自由基清除率(e)和氧自由基清除能力(f)的影响Fig.4 Influence of simulated digestion on the protein recovery (a), amide nitrogen content (b), molecular weight chromatogram (c), molecular weight distribution (d), hydroxyl radical scavenging activity (e)and ORAC value (f)of whey peptides (Trypsin group)
根据图5c 和5d 可看出,经胃、胃肠模拟消化后, 大米蛋白肽及其模拟消化产物的分子质量洗脱特性曲线无明显变化, 小分子的寡肽 (Mw<1 ku)占比也无统计学差异(P >0.05)。
如图5e 所示,经胃模拟消化后,大米蛋白肽(10 mg/mL)羟自由基活性无显著变化(P >0.05),说明低pH 值环境及胃蛋白酶的酶解不影响该多肽关键氨基酸基团与羟自由基作用。 大米蛋白肽经胃肠模拟消化后, 羟自由基活性显著降低(P<0.05),表明胰蛋白酶的作用使多肽发挥羟自由基清除能力的侧链基团发生水解, 从而影响其功效发挥。
图5f 显示, 大米蛋白肽经胃模拟消化后ORAC 活性显著增加(P <0.05)。疏水性氨基酸具有较好的ORAC 抗氧化活性[14],胃蛋白酶对大米蛋白肽的酶解作用可使其疏水性氨基酸暴露在外,有助于提高其ORAC 抗氧化活性。 大米蛋白肽在经胃肠模拟消化后,ORAC 活性与未消化的多肽无显著性差异(P >0.05)。

图5 模拟消化对大米蛋白肽(风味蛋白酶组)蛋白质回收率(a)、酰胺氮含量(b)、分子质量图谱(c)、分子质量分布比例(d)、羟自由基清除率(e)和氧自由基清除能力(f)的影响Fig.5 Influence of simulated digestion on the protein recovery (a), amide nitrogen content (b), molecular weight chromatogram (c), molecular weight distribution (d), hydroxyl radical scavenging activity (e)and ORAC value (f)of rice peptides (Flavourzyme group)
可选择普通胶囊作为富含谷氨酰胺的大米蛋白肽(风味蛋白酶组)功能性食品的包装材料。
2.4.3 小麦蛋白肽(风味蛋白酶组)小麦蛋白肽(风味蛋白酶组)的蛋白质回收率如图6a 所示。经胃、 胃肠模拟消化后, 其蛋白质回收率分别降至52.10%和43.72%。 模拟消化后蛋白含量下降,如图6b 所示,小麦蛋白肽酰胺氮含量均显著高于未消化肽的酰胺氮含量(P <0.05)。
从图6c 和6d 可看出,模拟胃肠消化后,分子质量洗脱特性曲线没有发生明显变化。 虽然小分子肽(Mw <1 ku)占比增至74.59%,但是与未消化组相比无显著性差异(P >0.05)。
如图6e 所示, 小麦蛋白肽经胃肠模拟消化后, 不同浓度消化产物的羟自由基活性与未消化的多肽羟自由基活性无统计学差异(P >0.05)。 根据图6f 的ORAC 抗氧化活性可知,小麦蛋白肽在模拟消化前、 后ORAC 值均高于0.80 μmol TE/(L·mg)肽,且无显著性差异(P>0.05)。 选择普通胶囊作为富含谷氨酰胺的小麦蛋白肽(风味蛋白酶组)功能性食品的包装材料。
2.5 耐受胃肠模拟消化最优富含谷氨酰胺酶多肽的筛选
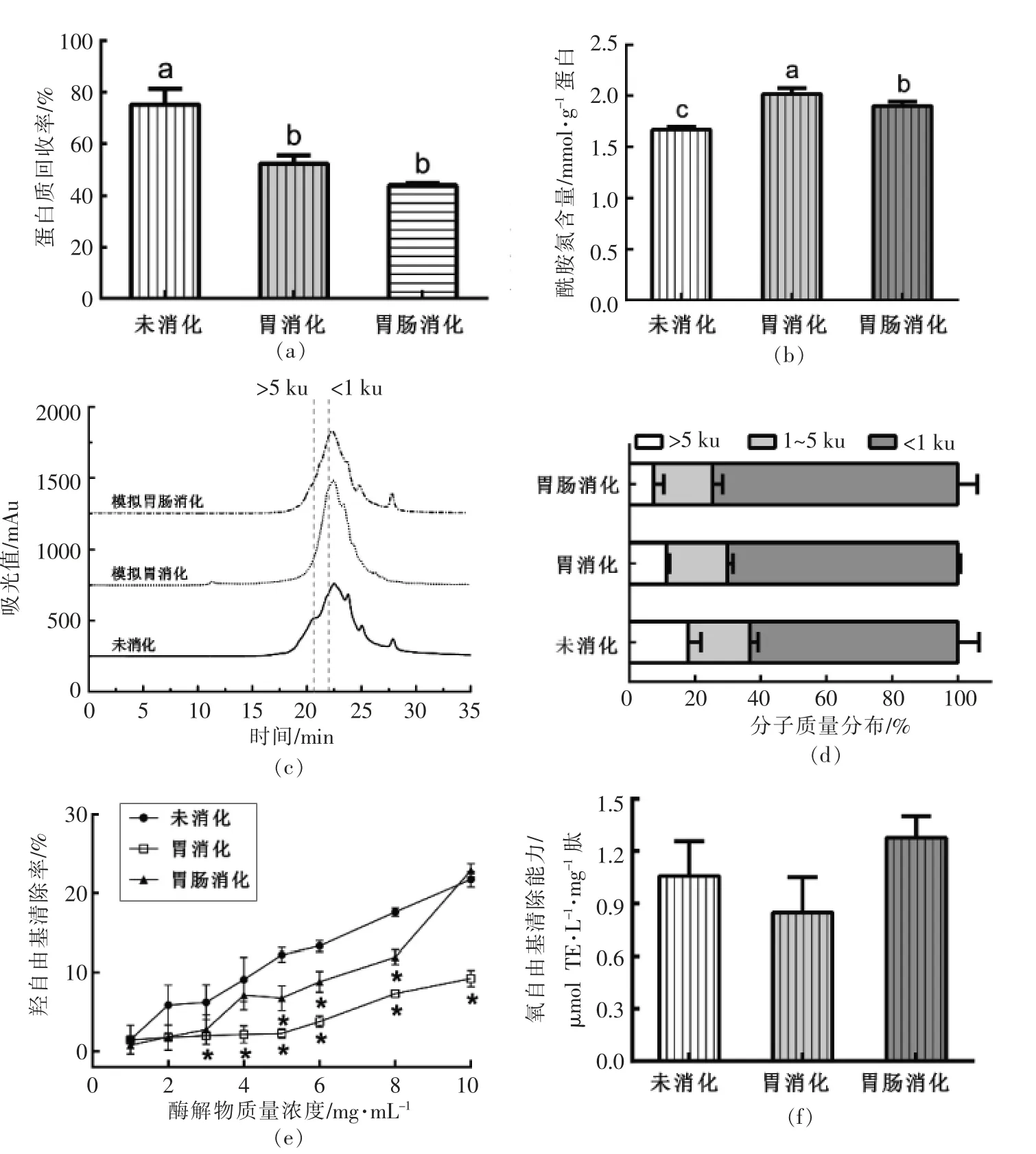
图6 模拟消化对小麦蛋白肽(风味蛋白酶组)蛋白质回收率(a)、酰胺氮含量(b)、分子质量图谱(c)、分子质量分布比例(d)、羟自由基清除率(e)和氧自由基清除能力(f)的影响Fig.6 Influence of simulated digestion on the protein recovery (a), amide nitrogen content (b), molecular weight chromatogram (c), molecular weight distribution (d), hydroxyl radical scavenging activity (e)and ORAC value (f)of wheat peptides (Flavourzyme group)
由图7a 和7b 可知, 小麦蛋白肽经胃肠模拟消化后的蛋白质回收率显著低于乳清蛋白肽和大米蛋白肽(P <0.05)。 然而,从酰胺氮含量来看,小麦蛋白肽的酰胺氮含量显著高于其余两组 (P <0.05)。 小麦蛋白肽在经模拟消化后获得的可被人体吸收利用的肽少, 这些肽中还含有大量谷氨酰胺,其生物利用效率极高。
如图7c 所示,对小分子肽段(Mw <1 ku)占比进行考察, 大米蛋白肽和小麦蛋白肽经模拟胃肠消化后小分子肽段含量无统计学差异, 且均显著高于乳清蛋白组(P <0.05)。 根据张瑞等[15]、Yang B 等[16]的研究,小分子质量肽段往往具有较高的抗氧化活性和生物利用度。 据此推测这两组模拟消化产物具有良好的抗氧化活性。
如图7e 和7f 所示, 尽管3 种胃肠模拟消化产物的ORAC 活性无统计学差异(P >0.05),小麦蛋白风味蛋白酶肽模拟消化产物的羟自由基清除活性还是显著高于其余两组(P <0.05),其被人体利用的组分具有更高的活性。
综合考虑,选择小麦蛋白肽(风味蛋白酶组)作为具有保护胃肠道黏膜功能的最佳功能性食品基料。
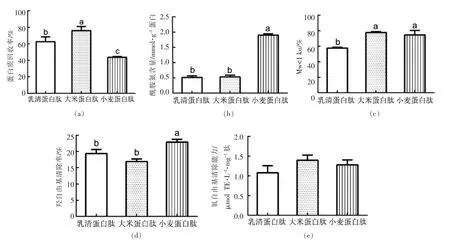
图7 胃肠模拟消化对富含谷氨酰胺的多肽蛋白质回收率(a)、酰胺氮含量(b)、分子质量图谱(c)、分子质量分布比例 (Mw<1 ku)(d)、羟自由基清除率(e)和氧自由基清除能力(f)的影响Fig.7 Influence of simulated gastrointestinal digestion on the protein recovery (a), amide nitrogen content (b),molecular weight distribution (Mw <1 ku)(c), hydroxyl radical scavenging activity (d)and ORAC value (e)of glutamine-rich peptides
3 结论
1)综合考虑蛋白质回收率、 酰胺氮含量、分子质量分布和抗氧化活性等4 个评价指标, 从3种富含谷氨酰胺的蛋白原料(乳清、大米和小麦)中筛选出乳清蛋白肽(胰蛋白酶组)、大米蛋白肽(风味蛋白酶组)及小麦蛋白肽(风味蛋白酶组)作为模拟消化的研究对象。
2)结合体外胃、 胃肠模拟消化试验结果,选定肠溶胶囊作为乳清蛋白肽功能性食品的包装材料, 以普通胶囊作为大米蛋白肽或小麦蛋白肽功能性食品的包装材料。
3)体外模拟消化试验结果表明,相比乳清蛋白肽和大米蛋白肽, 小麦蛋白肽具有相对强的抵抗胃肠道模拟消化的能力,且小分子肽段占比高,更易被人体吸收和利用。 选择小麦蛋白作为制备富含谷氨酰胺的多肽的原料。其酶解工艺条件为:风味蛋白酶0.75%,料液比1∶10,酶解温度50℃,酶解时间4 h,酶解过程调节pH 6.0。
