黑蒜多糖的斑马鱼体内抗氧化、抗炎症活性分析
2020-09-01马耀宏孟庆军杨俊慧黄金栋
郑 岚 马耀宏* 孟庆军 杨俊慧 夏 青 彭 耀 黄金栋 任 鑫
(1 齐鲁工业大学(山东省科学院)山东省科学院生物研究所 山东省生物传感器重点实验室 济南250103 2 莱芜裕源食品有限公司 山东莱芜271199)
黑蒜又名发酵黑蒜,是一种口感软糯,味道酸甜,具有多种保健功效的新型大蒜发酵制品[1]。 由于黑蒜具有提高免疫力[2]、抗氧化[3-5]、抗炎症[6-7]、抗疲劳[8]、调节血糖和血脂水平[9-11]、保护肝脏[12-14]、抗过敏[15]、润肠通便[16]等作用,因此,近年来受到消费者的青睐, 成为大蒜深加工领域最受关注的研究热点[17]。
虽然黑蒜的蒜臭味及辛辣味大大降低, 但是仍有部分消费者不易接受残留的蒜味。 提取黑蒜中的有效成分,将其加工为黑蒜保健品,成为延长黑蒜产业链的有效途径之一。高温、高湿的黑蒜发酵工艺使大蒜发生一系列复杂的变化, 多种有益成分含量显著提高, 其中糖类物质含量升高最为显著[18-19]。大蒜多糖是大蒜中含量较高的活性成分之一,具有多种生物学活性[20],对黑蒜多糖的研究正引起人们的重视。 黑蒜多糖是开发黑蒜保健品的良好材料, 如何有效利用黑蒜多糖的保健价值值得深入研究。 黑蒜多糖的提取方法是黑蒜开发利用的重要技术问题, 而活性评价是研发黑蒜多糖保健品的前提和基础。 本研究采用Plackett-Burman 及响应面试验设计方法优化黑蒜多糖的超声提取工艺, 采用多种体外试验分析黑蒜多糖的体外抗氧化能力。 通过建立斑马鱼氧化应激模型和炎症模型,评价黑蒜多糖的体内抗氧化、抗炎症能力,为黑蒜多糖保健品的开发奠定理论基础。
1 材料与方法
1.1 材料与试剂
独瓣黑蒜,莱芜裕源食品有限公司提供;Tg(krt4:NTR-hKitGR)cy17系斑马鱼、AB 系斑马鱼、Tg(Lyz:GFP)系斑马鱼,山东省科学院生物研究所药物筛选技术重点实验室提供。
1,1-二苯-2-苦基肼 (DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、甲硝锉,阿拉丁化学试剂公司;三卡因(3-氨基苯甲酸乙酯甲基磺酸盐),美国Fluka 公司;Pronase E 蛋白酶,索莱宝生物科技有限公司;活性氧(ROS)试剂盒(DCFH-DA),南京建成生物工程研究所;脂多糖,美国Sigma 公司;磷酸盐缓冲液(PBST)、4%组织细胞固定液(PFA)、吲哚美辛,北京索莱宝科技有限公司;其余试剂均为国产分析纯级。
1.2 仪器与设备
JY92-Ⅱ超声波细胞破碎机,上海新芝生物技术研究所;Dynex Spectra MR 酶标仪,美国Dynex Technologies 公司;HH-2 数显恒温水浴锅,常州国华电器有限公司;5804R 离心机, 德国eppendorf公司;LE204E 电子天平, 梅特勒-托利多(Mettler Toledo)公司;UV2700 型紫外-可见分光光度计,日本岛津公司;SZX16 体视显微镜, 奥林巴斯(OLYMPUS)有限公司;101A-2 电热鼓风干燥箱,南通宏大实验仪器有限公司。
1.3 方法
1.3.1 黑蒜多糖的提取 黑蒜→加水捣碎→超声波破碎→热水浸提→离心(10 000 r/min,10 min,4℃)取上清液→按上述步骤重复提取→合并上清液→减压浓缩→醇沉→离心 (10 000 r/min,10 min,4 ℃)→沉淀于55 ℃烘干→黑蒜多糖。
1.3.2 多糖含量的测定 苯酚-硫酸法测定多糖含量[21]。 标准曲线的绘制:分别取2 mL 不同浓度葡萄糖标准液于试管中, 加入1 mL 6%苯酚和5 mL 浓硫酸溶液, 摇匀后静置20 min, 于490 nm处测定吸光值,绘制标准曲线并求回归方程。样品测定:取2 mL 待测样品于试管中,加入1 mL 6%苯酚, 以下同标准曲线的测定,3 次重复取平均值,根据回归方程计算多糖含量。
1.3.3 黑蒜多糖得率的计算
多糖得率(%)=[多糖质量浓度(mg/mL)×溶液体积(mL)×稀释倍数]/黑蒜质量(mg)×100
1.3.4 黑蒜多糖提取工艺的优化
1.3.4.1 Plackett-Burman(PB)试验 以影响黑蒜多糖提取率的因素(固液比、超声功率、超声时间、提取温度、提取时间、提取次数、乙醇倍数、醇沉时间)为响应变量(X),以黑蒜多糖提取率为响应值(Y),选取的因素和水平见表1。
利用Design Expert 8.0 软件设计PB 试验,选出对黑蒜多糖提取显著影响的因素。
1.3.4.2 响应面试验 根据PB 试验结果,选择固液比(x1)、提取时间(x2)、提取次数(x3)3 个因素为响应变量,以黑蒜多糖的提取率为响应值(Y),响应面试验的因素和水平表见2。
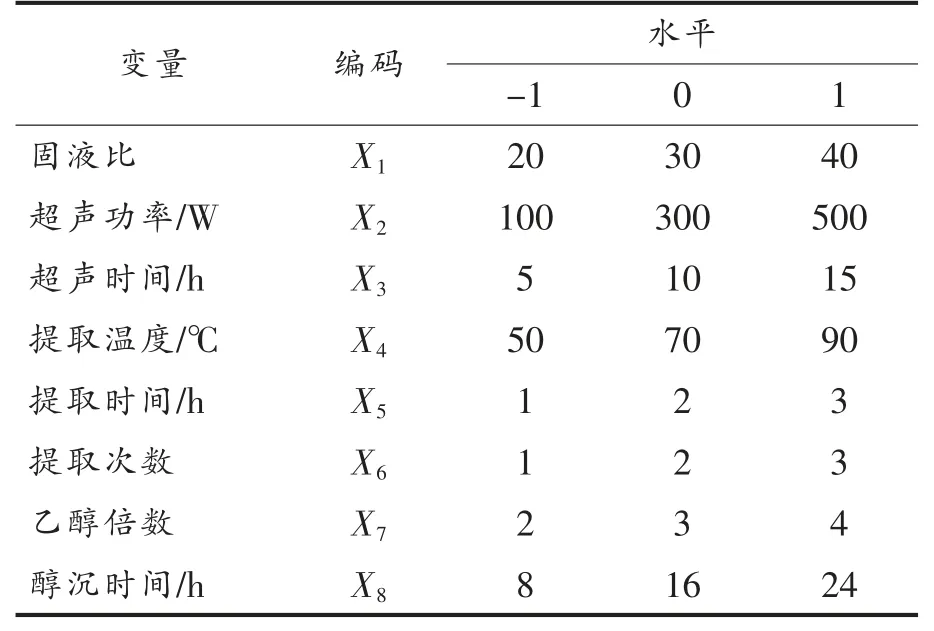
表1 黑蒜多糖提取PB 试验因素和水平表Table 1 The factor and level of PB experiment for black garlic polysaccharides extraction
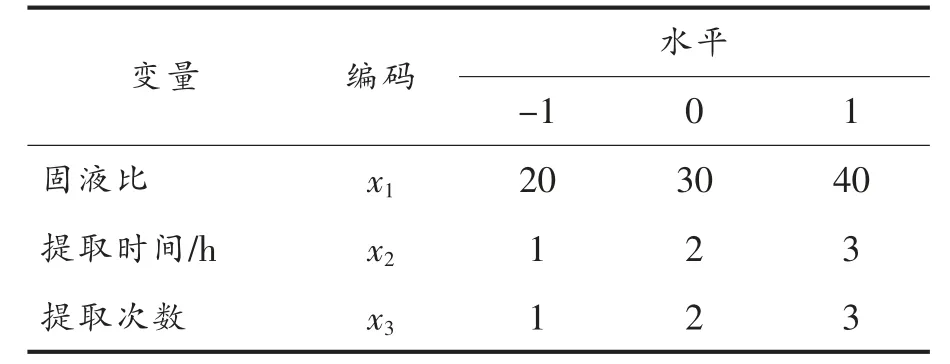
表2 黑蒜多糖提取响应面试验因素和水平表Table 2 The factor and level of response surface experiment for black garlic polysaccharides extraction
利用Design Expert 8.0 软件按照Box-Behnken 的中心组合试验原理设计响应面试验,分析黑蒜多糖的最优提取条件。
1.3.5 体外抗氧化能力的测定
1.3.5.1 羟基自由基清除能力[22]向试管中依次加入1 mL 硫酸亚铁溶液(9 mmol/L)、1 mL 水杨酸乙醇溶液(9 mmol/L)、1 mL 多糖样品溶液和1 mL过氧化氢溶液(8.8 mmol/L),37 ℃水浴30 min,离心(6 000 r/min,10 min,4 ℃),于波长510 nm 处测定上清液的吸光度A。 维生素C 为阳性对照。
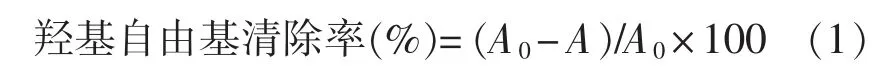
式中,A0——去离子水代替样品的吸光度。
1.3.5.2 ABTS 自由基清除能力[23]将ABTS 溶液(7 mmol/L)和过硫酸钾溶液(4.9 mmol/L)等体积混合,避光静置20 h,用0.1 mol/L 磷酸盐缓冲液(pH 7.4)稀释,使其在波长734 nm 处吸光度为0.7 ±0.02。 取上述ABTS 工作液0.8 mL 与0.2 mL 样品溶液混匀,避光6 min,于波长734 nm 处测吸光度A。

式中,蒸馏水代替样品为空白组(A空),磷酸盐缓冲液代替ABTS 工作液为对照组(A对)。
1.3.5.3 DPPH 自由基清除能力[24]向试管中加入2 mL 样品溶液和2 mL DPPH乙醇溶液(0.2 mmol/L), 混合均匀后避光反应30 min, 于波长517 nm 处测定其吸光度A。

式中,A0——2 mL 乙醇与2 mL 样品混合液的吸光度;A1——2 mL 去离子水与2 mL DPPH 乙醇溶液混合液的吸光度。
1.3.5.4 还原力[25]分别将1 mL样品溶液、2.5 mL 0.2 mol/L 磷酸盐缓冲液(pH 6.6)和1 mL 铁氰化钾溶液(10 g/L)于试管中混合均匀,置于50 ℃水浴20 min, 加入2 mL 100 g/L 三氯乙酸和1.2 mL 1 g/L 三氯化铁溶液,混匀后于波长700 nm 处测定吸光度。
1.3.5.5 总抗氧化能力[26]取0.4 mL 样品于试管中, 加入4 mL P 溶液 (含有0.6 mol/L 硫酸,28 mmol/L 磷酸三钠,4 mmol/L 钼酸铵),95 ℃水浴90 min,冷却后于波长695 nm 处测定其吸光度。
1.3.6 斑马鱼体内活性评价
1.3.6.1 清除自由基 斑马鱼的养殖和繁殖参照Westerfield 等[27]的方法。 挑选受精后24 h 健康并带有绿色荧光的Tg(krt4:NTR-hKitGR)cy17 系斑马鱼胚胎,加入1 mg/mL 蛋白酶脱膜,将脱膜后的斑马鱼移入24 孔板中, 随机分为5 组, 每孔10条。(NC)正常对照组:养殖水。(MC)氧化应激模型组:养殖水中含有甲硝唑(10 mmol/L)。 (PC)阳性对照组:养殖水中含有甲硝唑(10 mmol/L)和维生素C(25 μg/mL)。 (I,II)高、低剂量黑蒜多糖干预组:养殖水中含有甲硝唑(10 mmol/L)和不同浓度黑蒜多糖 (质量浓度分别为10 μg/mL 和25 μg/mL)。 将装有斑马鱼的24 孔板置于恒温培养箱中28 ℃培养24 h。 每孔加入100 μL 1 g/mL 三卡因溶液麻醉斑马鱼,在荧光显微镜下拍照,用Image pro-plus 软件计算躯干部荧光点数。

1.3.6.2 抑制炎症导致的活性氧簇(ROS)形成将受精后72 h 健康AB 系斑马鱼移入24 孔板中,随机分为6 组,每孔10 条。 (NC)正常对照组:养殖水。 (MC)炎症模型组: 养殖水中含有脂多糖(LPS,25 μg/mL)。(PC)阳性对照组:养殖水中含有25 μg/mL 脂多糖和25 μg/mL 维生素C。 (I,II,III)高、中、低剂量黑蒜多糖干预组:养殖水中含有脂多糖(25 μg/mL)和黑蒜多糖(质量浓度分别为25,50,100 μg/mL)。 于28 ℃培养72 h 后, 加入300 μL DCFH-DA 染色40 min,清洗,麻醉斑马鱼,在荧光显微镜下拍照。 用Image J 软件计算荧光强度。
1.3.6.3 抗炎作用 挑选受精后72 h 健康并带有荧光的Tg(Lyz:GFP)系斑马鱼,随机移入24 孔板中,分为6 组,每孔10 条。将黑蒜多糖样品或吲哚美辛与斑马鱼共孵育2 h, 然后用20 μmol/L 硫酸铜处理2 h。用4% PFA 处理斑马鱼1 h,清除PFA并使用PBST 清洗斑马鱼。(NC)正常对照组:养殖水。 (MC)炎症模型组:硫酸铜处理2 h。 (PC)阳性对照组:5 μg/mL 吲哚美辛处理2 h,然后硫酸铜处理2 h。 (I,II,III)高、中、低剂量黑蒜多糖干预组:黑蒜多糖(质量浓度分别为25,50,100 μg/mL)处理2 h, 然后硫酸铜处理2 h, 在荧光显微镜下拍照。 用Image pro-plus 软件计算中性粒细胞迁移个数。
1.3.7 统计学方法 试验数据采用SPSS 软件进行统计学分析, 组间比较采用t 检验,P <0.05 为差异显著标准。
2 结果与分析
2.1 优化的黑蒜多糖提取工艺
2.1.1 PB 试验结果
2.1.1.1 PB 试验设计及结果 苯酚-硫酸法标准曲线的回归方程为y=0.0088x+0.168,R2=0.9995。PB 试验设计及结果见表3。
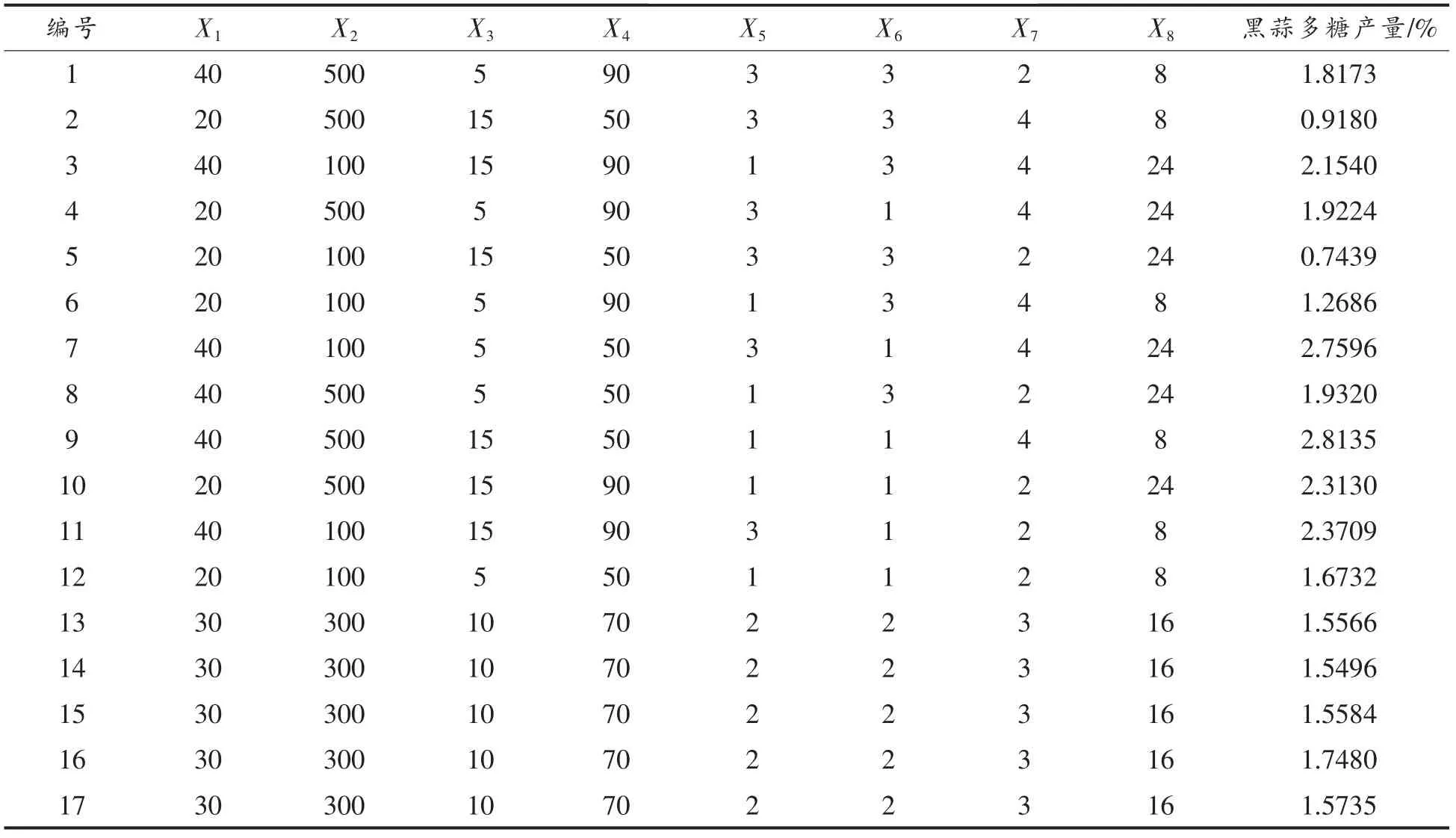
表3 PB 试验设计及结果Table 3 The design and result of PB experiment
运用Design Expert 8.0 软件对试验数据进行回归拟合,获得多元一次回归方程:
Y= 1.80 + 0.42X1+ 0.062X2- 0.004983X3+0.084X4- 0.14X5- 0.42X6+ 0.082X7+ 0.080X8,R2=0.9174。
2.1.1.2 PB 试验的回归模型方差分析 试验结果的统计学分析见表4。
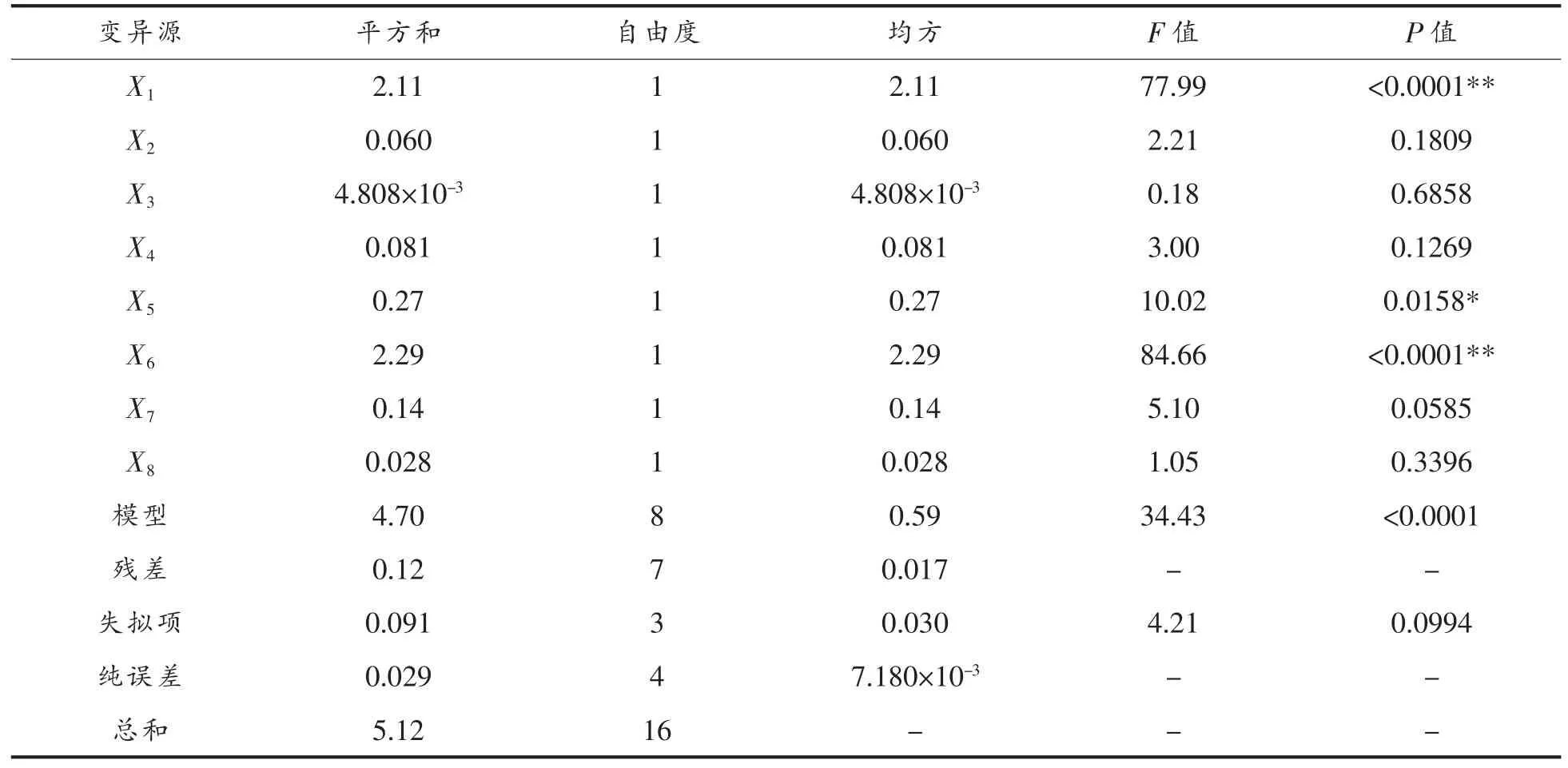
表4 PB 试验的回归模型方差分析Table 4 ANOVA for the regression model in PB experiment
由表4 可见, 各因素对黑蒜多糖提取率的影响为:提取次数>固液比>提取时间>乙醇倍数>提取温度>超声功率>醇沉时间>超声时间。其中提取次数、固液比、提取时间为显著因素,其它为不显著因素。 模型显著(P <0.01),失拟值不显著(P >0.05)。 决定系数R2= 0.9174, 调整性决定系数R2Adj=0.8348,说明模型在整个回归区域中拟合度较好,可准确描述试验结果。
2.1.2 响应面试验
2.1.2.1 响应面试验设计及结果 响应面试验设计及结果见表5。
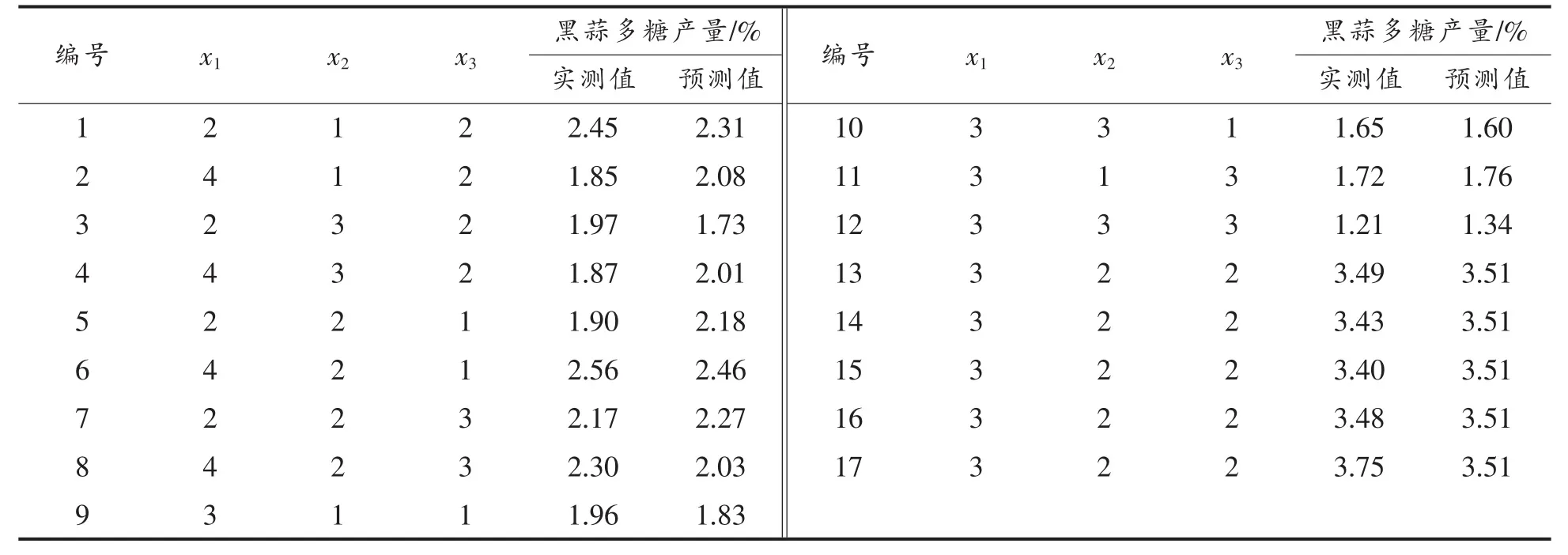
表5 响应面试验设计及结果Table 5 The design and result of the response surface experiment
运用Design Expert 8.0 软件对试验数据进行多元回归拟合,获得二次多项回归方程:
Y=3.51+0.011x1-0.16x2-0.084x3+0.13x1x2-0.13x1x3-0.048x2x3-0.44x12-1.04x22-0.84x32,R2=0.9568。
2.1.2.2 响应面试验的回归模型方差分析 对响应面试验的回归模型进行方差分析, 结果见表6。
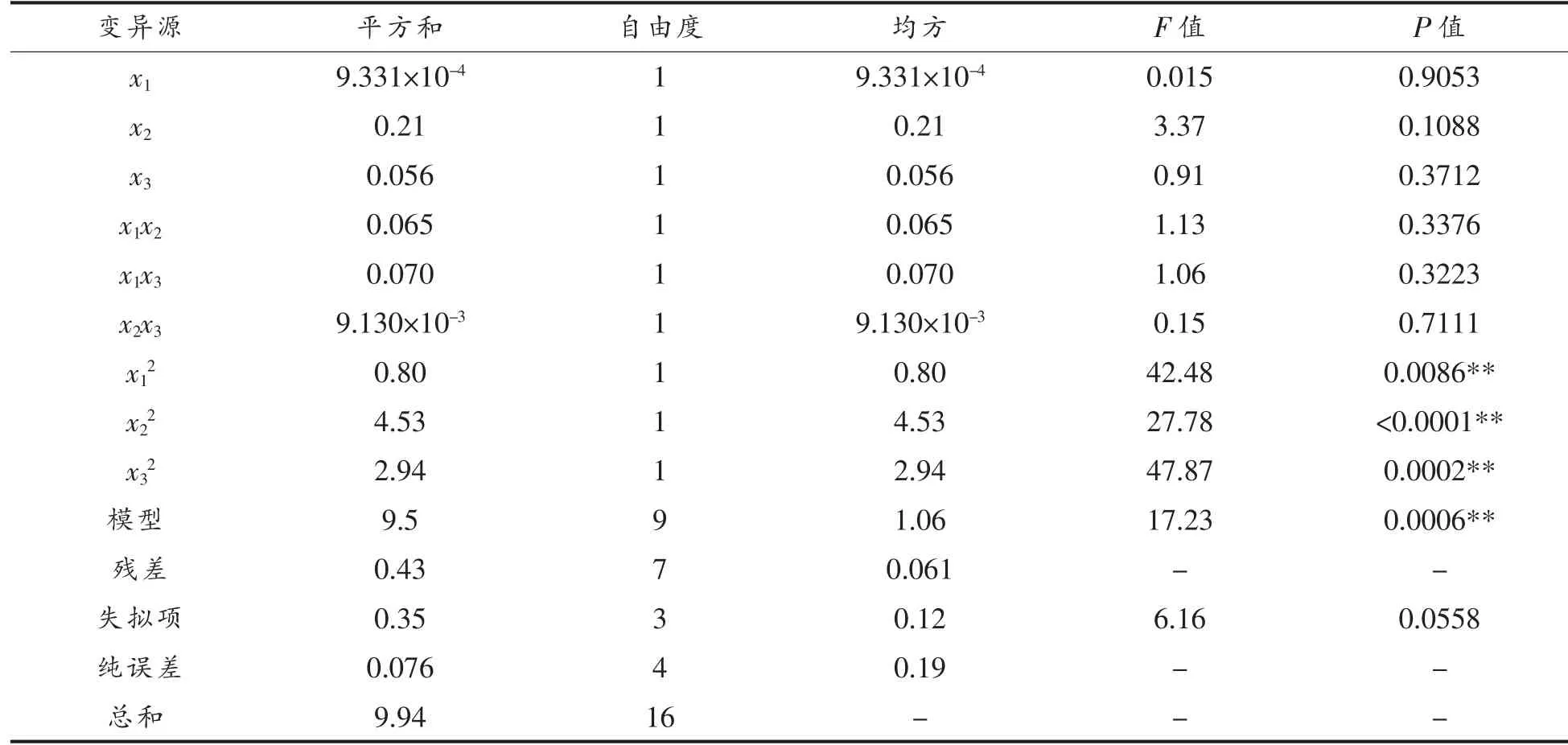
表6 响应面试验的回归模型方差分析Table 6 ANOVA for the regression model of response surface experiment
如表6 所示,二次项(x12,x22,x32)对黑蒜多糖提取率显著影响,而交互项(x1x2,x1x3,x2x3)均不显著, 说明提取条件间的交互作用较小。 模型显著(P <0.01),失拟值不显著(P >0.05),决定系数R2= 0.9568,调整性决定系数R2Adj= 0.9013,说明回归方程与实际情况拟合程度较好, 模型可很好地反映响应变量(x)与响应值(Y)之间的关系。
2.1.2.3 响应面试验的响应面图 用Design Expert 8.0 软件处理得到的响应面图(见图1)。
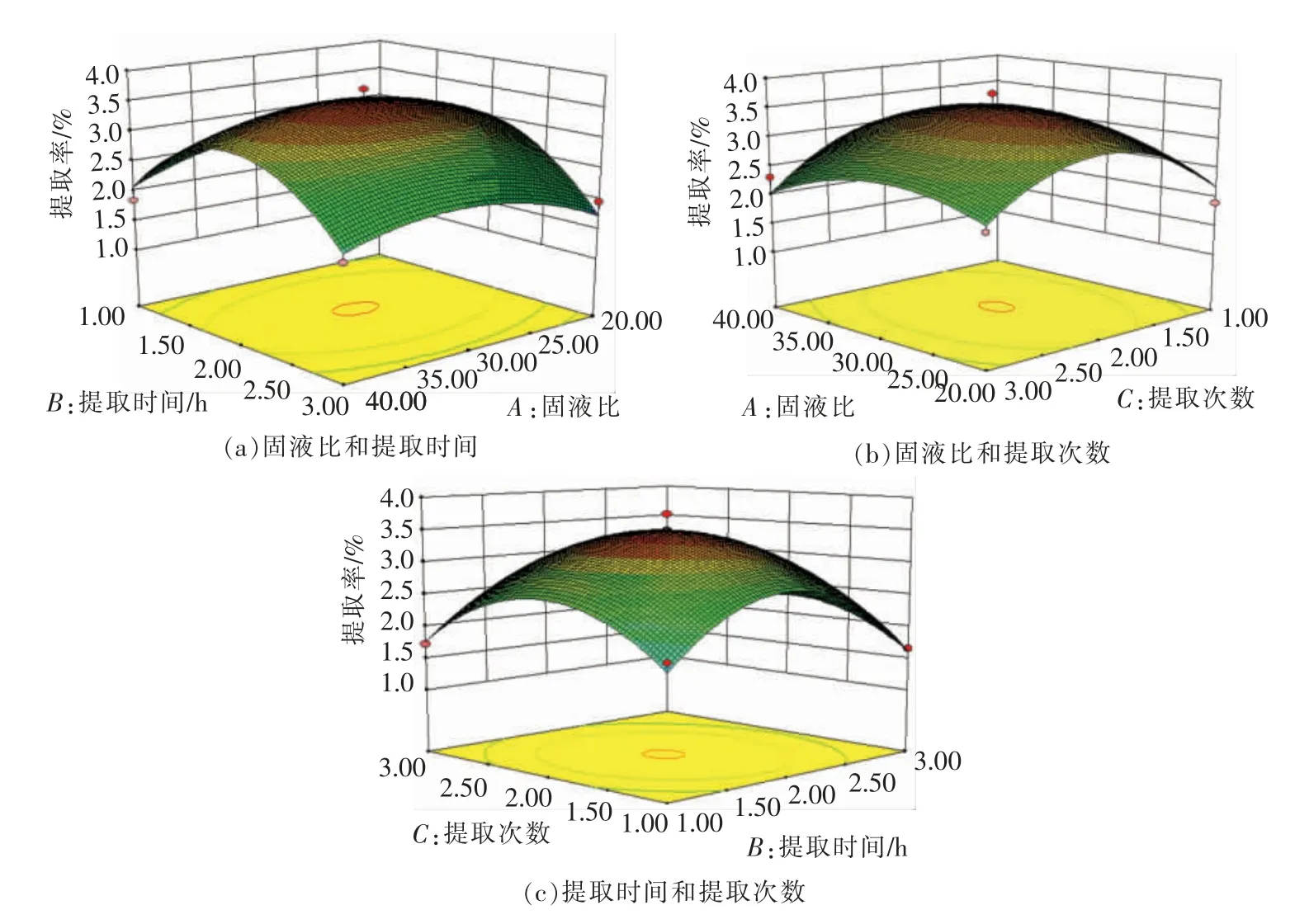
图1 不同因素对黑蒜多糖提取率交互影响的响应面图Fig.1 Response surface plot of interaction of different factors on extraction rate of polysaccharides from black garlic
响应面图直观反映因素间相互作用对响应值的影响。如图1 所示,响应面均为开口向下的凸形曲面,说明响应值(Y)在响应变量(x)所选取的范围存在最大值。 由响应面模型得出提取黑蒜多糖的最优工艺条件:固液比30.09 倍,提取时间1.92 h,提取1.95 次,预测提取率为3.51%。因操作的局限性,故将提取工艺条件修正为:固液比30 倍,提取时间2 h,提取2 次。 在此工艺条件下,黑蒜多糖提取率的实际值为3.65%, 与预测值无显著差异(P <0.01)。 最优工艺条件较为可靠,具有实际应用价值。
2.2 黑蒜多糖的体外抗氧化能力
黑蒜多糖的羟基自由基、ABTS 自由基和DPPH 自由基的清除能力以及还原力、总抗氧化能力见图2。
羟基自由基是一种化学性质活泼且破坏性强的活性氧自由基。DPPH 法和ABTS 法是分析抗氧化物质清除自由基能力最常用的检测方法。 由图2a,2b,2c 可见, 黑蒜多糖清除自由基的能力随浓度的增加而逐渐增强,呈现明显的量效关系。黑蒜多糖清除羟基自由基、DPPH 自由基和ABTS 自由基的EC50值分别为4 322.43,312.15,198.36 mg/L。由图2d,2e 可见, 黑蒜多糖的还原力和总抗氧化能力呈现明显的量效关系。 在质量浓度为6 000 mg/L 時, 黑蒜多糖的还原力和总抗氧化能力分别为1.66 和3.35,分别是维生素C 还原力和总抗氧化能力的61.94%和95.99%。
2.3 黑蒜多糖的斑马鱼体内活性评价
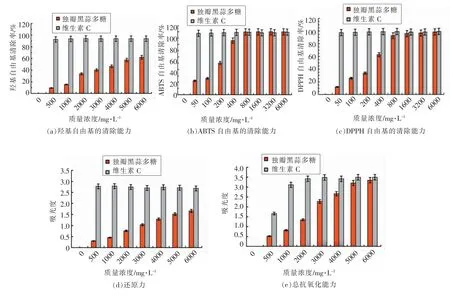
图2 黑蒜多糖的体外抗氧化能力Fig.2 Anti-oxidant activities in vitro of black garlic polysaccharides
2.3.1 清除自由基 Tg (krt4:NTR-hKitGR)cy17系斑马鱼是评价活性物质抗氧化能力的转基因斑马鱼, 其表皮细胞被构建成为特异性标记荧光蛋白与硝基还原酶的共表达体系,带有绿色荧光点。当环境中存在甲硝唑时, 甲硝唑可与表皮细胞中的硝基还原酶结合,产生大量的自由基,引起细胞死亡,绿色荧光点消失。 当抗氧化物质存在时,自由基被及时清除, 从而避免表皮细胞的凋亡和绿色荧光点的消失。 黑蒜多糖清除斑马鱼体内自由基能力的测定结果见图3、图4。
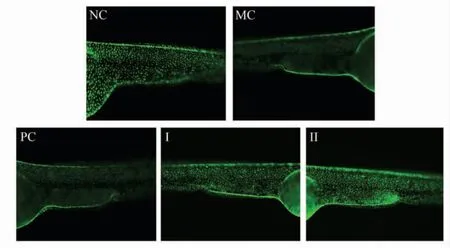
图3 黑蒜多糖清除体内自由基的能力Fig.3 Free radicals scavenging activity in vivo of black garlic polysaccharides
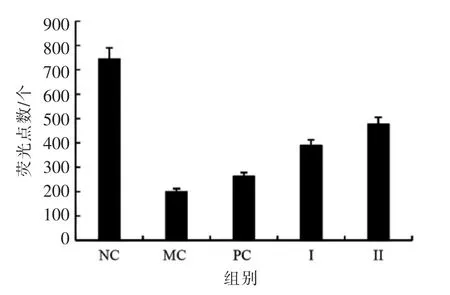
图4 斑马鱼皮肤细胞的荧光点数Fig.4 The number of fluorescent spots in zebrafish skin cells
由图3、图4 可见,氧化应激模型组(MC)斑马鱼的荧光点数显著少于空白对照组(NC)的荧光点数(P <0.01),氧化应激模型构建成功。 与氧化应激模型组相比, 黑蒜多糖干预组的荧光点数显著提高(P <0.01),黑蒜多糖低剂量干预组(I)和高剂量干预组 (II)的抗氧化率分别为40.18%和50.6%,呈现明显的量效关系。 维生素C 阳性对照组(PC)的抗氧化率为11.38%。黑蒜多糖通过清除自由基产生较强的抗氧化能力,在25 μg/mL 干预浓度下黑蒜多糖的抗氧化能力高于维生素C。
2.3.2 抑制炎症导致的活性氧簇(ROS)形成 LPS是革兰氏阴性细菌特有的物质, 是系统性炎症反应综合症的启动因子, 可以诱导机体产生炎症反应,进而导致ROS 含量的升高[28-29]。 黑蒜多糖抑制斑马鱼体内ROS 形成的测定结果见图5、图6。
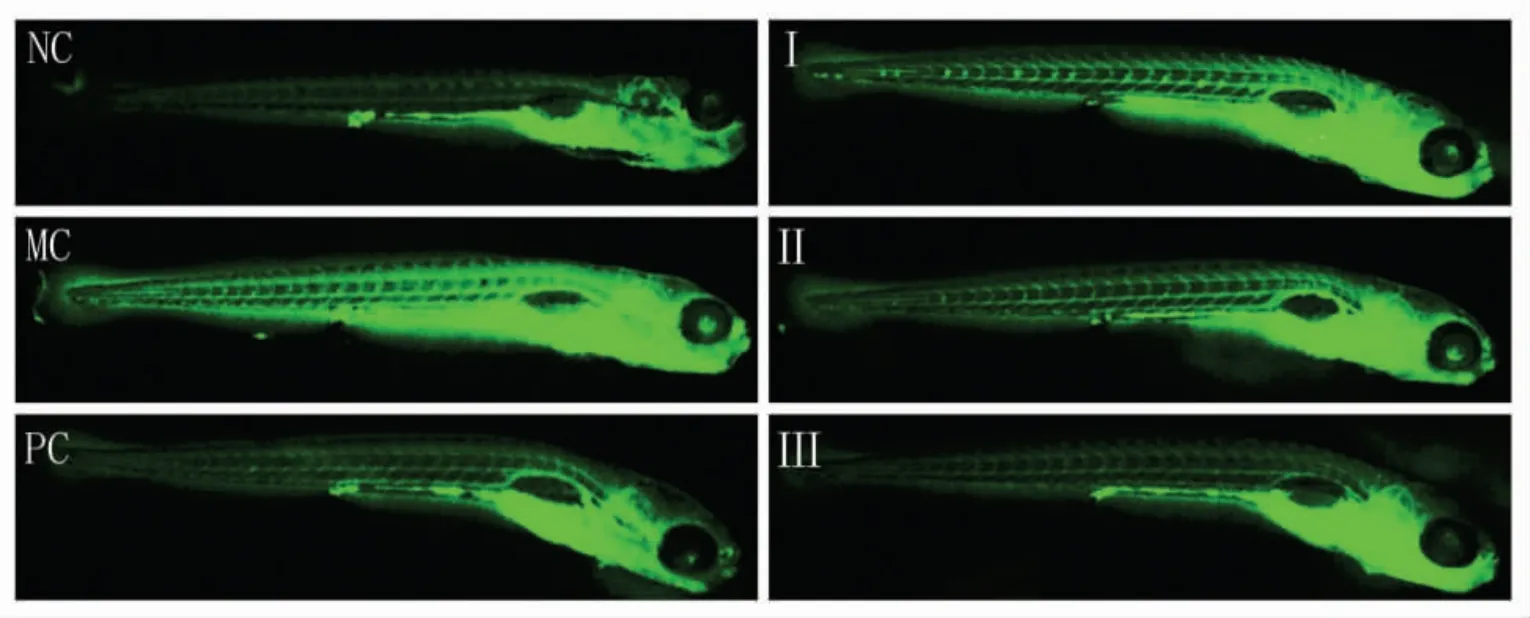
图5 黑蒜多糖抑制体内ROS 形成的能力Fig.5 Inhibition of ROS formation in vivo by black garlic polysaccharides
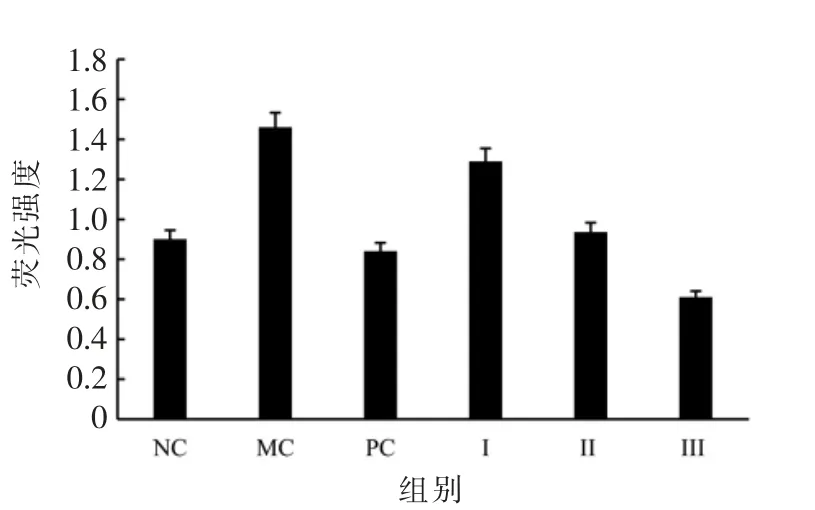
图6 斑马鱼体内ROS 的荧光强度Fig.6 The fluorescence intensity of ROS in zebrafish
斑马鱼体内的ROS 被标记为绿色荧光。 由图5、图6 可见,炎症模型组(MC)斑马鱼的荧光强度显著高于空白对照组(NC)(P<0.01),炎症模型构建成功。 与炎症模型组相比,黑蒜多糖干预组的荧光强度显著降低,黑蒜多糖低、中、高剂量干预组(I,II,III)的荧光强度分别降低了11.6%(P<0.05),35.9%(P<0.01)和58.2%(P<0.01), 阳性对照组(PC)的荧光强度降低了42.5%,说明黑蒜多糖通过抑制斑马鱼体内ROS 形成,减轻氧化应激损伤和炎症反应。 然而,在25 μg/mL 干预质量浓度下,黑蒜多糖抑制ROS 形成的能力略低于维生素C。
2.3.3 抗炎作用 转基因Tg(Lyz: GFP)系斑马鱼的中性粒细胞被标记为绿色。 中性粒细胞的激活、迁徙及聚集是炎症反应的重要特征,可直接反映机体的炎症水平。 黑蒜多糖抗炎作用的测定结果见图7、图8。
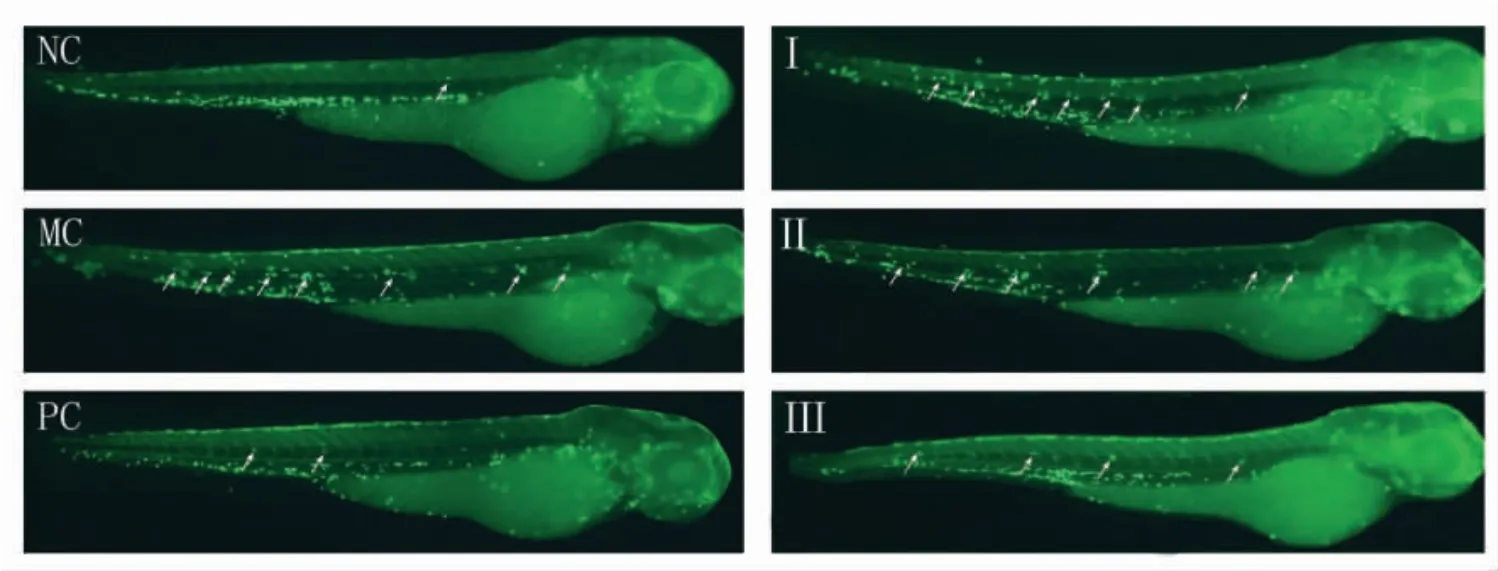
图7 黑蒜多糖的体内抗炎能力Fig.7 Anti-inflammatory ability in vivo of black garlic polysaccharides
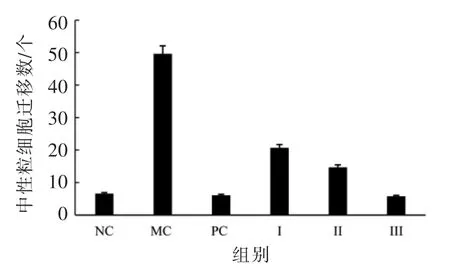
图8 斑马鱼中性粒细胞的迁移个数Fig.8 The number of migrating neutrophils of zebrafish
由图7、图8 可见,炎症模型组(MC)斑马鱼的中性粒细胞迁移数显著高于空白对照组(NC)(P <0.01),硫酸铜诱导的炎症模型构建成功。 与炎症模型组相比, 黑蒜多糖干预组的中性粒细胞迁移数显著减少,黑蒜多糖低、中、高剂量干预组(I,II,III)的细胞迁移数分别降低了58.33%(P <0.01),70.34%(P <0.01)和88.35%(P <0.01),阳性对照组(PC)的荧光强度降低了73%。 这说明黑蒜多糖具有显著的抗炎作用, 当其干预质量浓度为100 μg/mL 时,其抗炎效果与抗炎药物吲哚美辛(5 μg/mL)无显著差异(P >0.05)。 由于黑蒜多糖具有显著的抑制炎症导致的ROS 形成能力,所以黑蒜多糖的抗炎机制可能与其阻断ROS 介导的炎症反应信号途径相关。
3 结论
黑蒜多糖最优提取工艺为:提取2 次、固液比30 倍、提取时间2 h、乙醇3 倍、提取温度70 ℃、超声功率300 W、 醇沉时间16 h、 超声时间10 min,在该条件下黑蒜多糖的实际提取率达3.65%。 黑蒜多糖具有良好的体外抗氧化能力,清除羟基自由基、DPPH 自由基和ABTS 自由基的EC50值分别为4 322.43,312.15 和198.36 mg/L,在黑蒜多糖质量浓度为6 000 mg/L 时, 还原力和总抗氧化能力分别为1.66 和3.35。 通过建立甲硝锉诱导的斑马鱼氧化应激模型, 发现黑蒜多糖具有显著的自由基清除能力(P <0.01)。 通过建立脂多糖诱导的斑马鱼炎症模型, 发现黑蒜多糖可显著抑制炎症导致的ROS 含量升高(P <0.01)。 通过建立硫酸铜诱导的急性炎症模型, 发现黑蒜多糖具有显著的抗炎活性(P <0.01)。 结论:黑蒜多糖具有良好的抗氧化、抗炎症活性,可用于开发具有相应功效的保健食品。
