PEI 磁珠吸附IBRV 主要囊膜蛋白基因的DNA 疫苗的构建
2020-09-01于国伟刘行波倪宏波
于国伟,刘行波,倪宏波
(黑龙江八一农垦大学动物科技学院,大庆 163319)
牛传染性鼻气管炎(Infectious bovine rhinotracheitis,IBR) 是牛传染性鼻气管炎病毒(Infectious bovine rhinotracheitis virus,IBRV)引起的一种急性发热型传染病。根据感染的组织器官不同,可分为生殖道型、呼吸型、眼型、脑膜炎型和流产型五种。仅感染牛传染性鼻气管炎的牛,不会有较高的死亡率,但是它能导致母牛的产奶量下降、肉牛生长缓慢,从而给养牛业带来了严重的经济损失[1-3]。
IBRV 在生物学分类上被划分为疱疹病毒科a-疱疹病毒亚科[4]。该病的感染的主要来源是带毒的病畜[5]。实验发现在山羊和猪的死胎、水獭和雪貂中均能够分离出该病毒来[6];人工感染实验表明,牛在多种途径下都容易感染,但对于绵羊、马、猪、猫、狗、豚鼠和小鼠等动物在测试时均表现出抗性。在对鹿进行不同途径的人工感染实验时,这些患病鹿均能产生于牛相似的临床症状并能够检测出相应的抗体[7]。该疾病在秋季和寒冷的冬季更为普遍,尤其是在较为集中和拥挤的情况下饲养的大群奶牛中。此外,应激因素、社会因素、发情和分娩等因素与本病的发生也密切相关[8-9]。
疫苗免疫是预防和控制本病的主要手段[10],欧洲采用扑杀抗体阳性牛的方式消除本病成本过高,与我国国情不符。目前国内预防本病的疫苗为IBRV 和BVDV 二价灭活疫苗,欧美普遍采用IBRV gE 基因缺失疫苗,但该疫苗对于怀孕母牛以及新生牛安全性不佳[11]。作为兽用疫苗经济效益是首要考虑问题亚单位疫苗因为生产成本问题无法在兽用领域广泛应用。DNA 疫苗因其安全性高、成本低、制备容易、能引起较高的细胞免疫水平,在兽用疫苗领域有极好的应用前景,但由于其无法高效进入细胞内进行高效蛋白表达,进而引起较高的体液免疫水平,而无法广泛应用[12-13]。
1995 年首次发现PEI(聚乙酰亚胺)可以作为载体输送DNA 进入真核细胞,从此对PEI 作为载体的研究进入了一个高潮,PEI 作为载体的机制是其特殊的富含阳离子结构可以中和DNA 的负电荷从而形成带有正电荷的转染复合物进入到细胞。它不仅能够大规模的生产而且成本方面较其他转染试剂具有天然的优势,且PEI 是化学成分固定并是非生物来源不会引起免疫反应,因此被广泛应用,聚乙酰亚胺(PEI)作为一种带有强正电荷的有机聚合物,作为DNA 和RNA 载体用于体内和体外转染已有多年,但因其毒性较大,一直未获得足够的安全性[14]。聚乙二醇(PEG)作为具有较好生物相容性的聚合物,一直以来用于人蛋白药物等相关药物研究,经过大量研究证明其在体内不被降解,不产生毒副作用,应用范围越来越广,它是典型的无毒、非免疫原性、非抗原性的聚合物,已经被作为一种最常用的修饰物质,据报道,它除了具有良好的生物相容性和安全性之外,PEG 所修饰的磁性载体能够隐藏起来在避免被网状内皮系统识别从而不被吞噬,从而能够延长药物在血液中的循环时间,因此被广泛应用于降低PEI 毒性[15]。研究以50 nm PEI 磁珠作为载体吸附gB gC gD基因的真核表达质粒,并在其表面包裹一层双羧基PEG600 作为保护层,以提高其安全性验证其在体外细胞水平能否表达。
1 材料与方法
1.1 真核表达质粒与细胞
pCDNA4-gB-His、pCDNA4-gC-His、pCDNA4-gD-His 真核表达质粒由实验室构建完成并保存。小鼠胚胎细胞(NIH/3T3)由实验室保藏。实验室已成功根据GenBank 公布的IBRV(Cooper1)株(GenBank 登录号Z78205)gB、gC、gD基因构建了基因全长真核表达质粒。并在gB基因上下游加入HindⅢ、AgeⅠ酶切位点,在gC基因上下游加入KpnⅠ、BSTBⅠ酶切位点,在gD基因上下游加入KpnⅠ、BSTBⅠ酶切位点。
1.2 主要材料及试剂
无内毒素质粒大提试剂盒,购自天根生化有限责任公司。HindⅢ、KpnⅠ、AgeⅠ、BSTBⅠ限制性内切酶,均采购于Thermo Fisher 公司,PEG、PEI 磁珠购自英芮诚(Enriching)生化上海有限公司,His 标签单克隆抗体购自美国abcam 公司(1∶10 000 稀释),羊抗鼠HRP 二抗,购自北京博奥森生物(bioss),ECL 显色液,购自索莱宝生化有限公司。兔抗小鼠多克隆抗体由实验室制备并保存。
1.3 重组质粒的提取及酶切鉴定
将实验室构建完成的pCDNA4-gB-His、pCDNA4-gC-His、pCDNA4-gD-His 真核表达质粒在含有25%甘油的Top10 菌种中取复苏后在无菌环境下分别将其接种至5 mL 含有1%氨苄的LB 液体培养基中,放置于摇床130 r·min-1,12 h。小提质粒后,根据表1 中的酶切位点,对扩增后的pCDNA4-gB/gC/gDHis 质粒双酶切鉴定,鉴定正确的重组质粒送至哈尔滨博仕生物有限公司进行序列的测定。
1.4 质粒转染小鼠胚胎细胞(NIH/3T3)
取质粒5 μg 加入含有10% FBS 的DMEM 培养基对NIH/3T3 细胞系进行培养。待细胞生长至细胞瓶90%时进行转染操作,按照每10 μg 质粒对应20 μL PEI 磁珠的比例均匀混合,使质粒吸附到磁珠上,将细胞瓶中处于对数生长期的NIH/3T3 细胞吹打下来,转移至15 mL 离心管中,在2 000 r·min-1条件下离心3 min,弃掉上清,将所得到的沉淀加入1 mL 无血清的DMEM 培养基中,并将细胞吹打混匀后转移至新的细胞瓶,加入足量的10% FBS 1640 培养基中进行培养,培养3 d 后蛋白开始表达。
1.5 Western Blot 检测蛋白表达情况
质粒转染细胞后72 h,收取转染后的上清,对细胞进行蛋白纯化验证,用镍柱进行蛋白纯化。纯化后蛋白按照每孔10 μg 蛋白上样,140 V 条件下电泳55 min,250 mA 条件下湿转,90 min,用5%脱脂乳4 ℃封闭过夜。过夜后的样品加入小鼠抗His 标签单克隆抗(1∶10 000 稀释)37 ℃孵育2 h,PBST 清洗3 次,每次清洗5 min,用山羊抗小鼠辣根过氧化物酶(HRP)标记的二抗(1∶2 000 稀释)加入所得到的样品,37 ℃孵育45 min,PBST 清洗3 次,每次5 min,滤纸吸干PBST,加入500 μL ECL 显色液(A∶B 液1∶1 混合)2 min,滤纸吸干显色液,用ECL 显色仪曝光10 s读取显色图片并进行分析。
1.6 间接免疫荧光检测表达情况
实验前一天,将小鼠胚胎细胞(NIH/3T3)接入铺有22 mm×22 mm 盖玻片的六孔板中,第二天,待小鼠胚胎细胞(NIH/3T3)密度达到80%左右开始进行染色步骤。用新鲜配制的2%多聚甲醛固定细胞10 min 清洗后,用0.2%~0.5% Triton X-100(PBS 配制)对细胞透化处理10 min,再次清洗。用2%BSA 封闭30 min,加入实验室制备的兔抗IBRV 多克隆抗体500 倍稀释,室温孵育1 h。PBS 清洗后,加入200 μL羊抗兔二抗(FITC 标记),室温孵育30 min。细胞核染色:加入0.5 μg·mL-1DAPI(PBS 配制)染色3 min 用PBS 洗3 遍,去除多余的DAPI。加入20 μL 封片剂封片,荧光显微镜下观察并分析结果。
1.7 大提质粒
取上步复苏菌种(pCDNA4-gB-HisB、pCDNA4-gC-His、pCDNA4-gD-His)接种至1 L 氨苄LB 培养基中放37 ℃恒温摇床摇12 h,将所得的菌体放置于恒温高速离心机内,4 ℃,12 000 g·min-1离心分4 min,收集菌体沉淀,所得到的菌体沉淀按照天根生化公司出品的大提质粒试剂盒说明书进行大提质粒并将得到的质粒进行浓度测定且用0.22 μm 无菌滤器进行过滤,-20 ℃保存用于后续实验。
1.8 PEI 磁珠最大吸附量的确定
将50 μL PEI 磁珠分别加入50、100、150、200、250、300、350 μg 的pCDNA4-gB-His 质粒到无菌1.5 mL EP 管内,终体积均为1 mL 并混合均匀,12 000 r·min-1离心5 min 收集上清,用微量紫外分光光度计测定各EP 管上清中DNA 浓度,加入量减去上清中总DNA 含量,计算磁珠载量。
1.9 疫苗的制备
实验前经电镜下观察50 nm PEI 形态后将大提并鉴定纯度后的pCDNA4-gB-HisB、pCDNA4-gCHis、pCDNA4-gD-His 真核表达质粒按1∶1∶1 的比例均匀混合,并分为A,B 两组,将A 组加入50 nm 的PEI 磁珠室温静置2 h,B 组加入50 nm 磁珠的同时加入PEG 静置吸附2 h。对吸附后的质粒进行电镜观察,确定吸附效果。
2 结果
2.1 质粒酶切鉴定及测序结果
经送gB/gC/gD 克隆质粒测序结果表经BLAST比对,同源性均达到99%以上。将质粒酶切后的结果如图1 所示:gB 基因酶切后可得到2 780 bp 的目的条带,gC 基因、酶切后可得到1 587 bp 的目的条带,gD 基因酶切后可得到1 396 bp 的目的条带,目的基因大小与插入序列相符。结果表明成功复苏了由实验室构建完成的pCDNA4-gB/gC/gD-His 真核表达质粒。
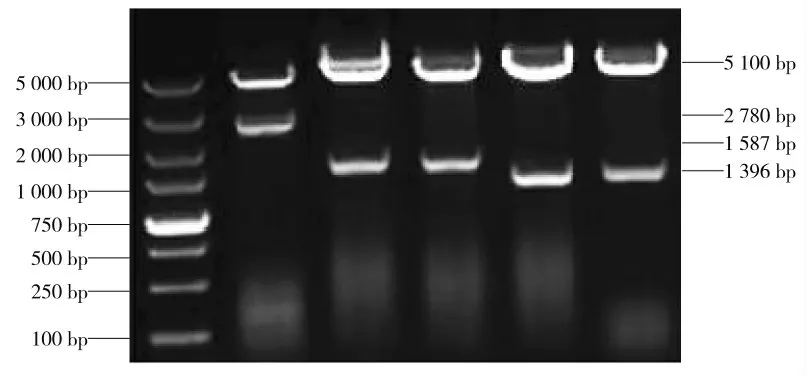
图1 质粒酶切鉴定结果Fig.1 Identification results of plasmid double enzyme digestion
2.2 gB/gC/gD 蛋白在小鼠胚胎细胞(NIH/3T3)表达结果
为验证构建的pCDNA4-gB/gC/gD-His 真核表达质粒能否能否体外表达gB/gC/gD 蛋白,采用Western Blot 方法对其进行验证。结果见图2 可检测到相应的gB,gC,gD 蛋白(60 Kda)的出现,证明了重组质粒能够在小鼠胚胎细胞进行表达。
2.3 间接免疫荧光结果
将处理好的小鼠胚胎细胞(NIH/3T3)置于免疫荧光显微镜下进行观察,可见到转染pCDNA4-gBHis、pCDNA4-gC-His、pCDNA4-gD-His 的真核表达质粒的细胞有明显的绿光(图A-C),而转染了pCDNA4-His 的对照细胞无特异荧光(图D)。结果表明真核表达质粒可在小鼠胚胎细胞进行有效表达。

图2 转染后pCDNA4-gB/gC/gD-His 在NIH/3T3 表达鉴定Fig.2 Expression identification of pCDNA4-gB/gC/gD-His eukaryotic expression plasmid in NIH/3T3 after transfection

图3 pCDNA4-gB/gC/gD-His 真核表达质粒体外感染小鼠胚胎细胞间接免疫荧光检测基因表达(100×)Fig.3 Indirect immunofluorescence assay for analyzing gene expression in mouse embryonic cells infected with pCDNA4-gB/gC/gD-His eukaryotic expression plasmid in vitro(100×)
2.4 PEI 最大吸附量的确定
经测定100 μL 50 nm PEI 磁珠最大吸附量为60 μg pCDNA4-gB-His 质粒。
2.5 50 nm PEI 磁珠吸附前及吸附后电镜结果
电镜结果显示PEI 磁珠吸附前形态不规则,表面粗糙(图A)。吸附质粒后粒径变大,表面粗糙程度减少(图B)。添加的PEG 能够将质粒包覆粒径变大,表面粗糙程度继续减少(图C)。

图4 PEI 磁珠吸附前后电镜结果(80 000×)Fig.4 Electron microscopy results before and after PEI magnetic beads adsorption(80 000×)
3 讨论
牛传染性鼻气管炎病毒基因组为双股线性DNA分子,囊膜表面分布11 种糖蛋白,这些糖蛋白在病毒致病性和免疫功能上有着不可替代的重要性。研究表明gB 基因表达的蛋白高度保守而且在病毒感染的过成中是必不可少的,该蛋白是刺激宿主免疫应答的主要的抗原蛋白之一[16]。gC 基因表达的蛋白是最重要的IBRV 吸附蛋白,据文献报道gC 基因所表达的蛋白与细胞表面的糖蛋白相互作用,不仅能够介导病毒吸附的起始,还能够诱导细胞介导的免疫反应[17]。gD 基因所表达的蛋白位于病毒囊膜和感染细胞的表面,对病毒复制至关重要[18]。正是由于这些因素决定了本试验选择gB/gC/gD 基因作目的基因进行真核表达质粒的构建。
PEI 作为载体的机制是其特殊的富含阳离子结构可以中和DNA 的负电荷从而形成带有正电荷的转染复合物进入到细胞。它不仅能够大规模的生产而且成本方面较其他转染试剂具有天然的优势[19-21]。常用DNA 转染方法有脂质体、PEI、电转等。其利用原理均为正电荷促进带负电荷的DNA 进入细胞,进而有利于免疫细胞识别[22]。但是PEI 由于其毒性较强,并未大量普及[23]。研究基于单纯使用PEI 作为转染试剂的毒性问题,特制备了50 nm 粒径的磁珠。其具有纳米粒径具有容易被细胞吞噬、用四氧化三铁作为纳米粒子核可以极大减少同等转染条件下PEI的用量,减少PEI 毒性、用长链PEI 作为包裹层可以增强其正电荷方面进行多层修饰等优点。李继昌[24]研究表明小鼠单独注射以gD 基因为抗原的DNA 疫苗所产生的抗体明显弱于脂质体和gD 基因混合免疫的小鼠。孙泽强[25]以肾癌G250 为抗原制备DNA 疫苗与PEI 混合对小鼠进行免疫,结果表明免疫PEI与DNA 疫苗混合的试验组相比于只免疫DNA 疫苗的试验组能够产生极为明显的细胞免疫与体液免疫。综上所述,试验设想将PEI 与pCDNA4-gB-His、pCDNA4-gC-His、pCDNA4-gD-His 真核表达质粒混合能够产生更为显著的免疫水平。
为鉴定所构建成功的真核表达质粒能否在体外有效表达,试验采取了Western-Blot 和间接免疫荧光两种方法来对其进行验证,结果显示pCDNA4-gB-His、pCDNA4-gC-His、pCDNA4-gD-His 真核表达蛋白均可与His 标签抗体发生特异性反应。间接免疫荧光结果显示转染了pCDNA4-gB-His、pCDNA4-gC-His、pCDNA4-gD-His 真核表达质粒的小鼠胚胎细胞产生特异性荧光,转染的空载体质粒并无特异性荧光出现。以上试验均可证明所构建的真核表达质粒在小鼠胚胎细胞中得以表达,所制备的疫苗经电镜结果可见质粒能够成功吸附在PEI 磁珠上,与设想相符,这为牛传染性鼻气管炎DNA 疫苗的研究工作奠定了基础。这对IBR 的防治方式进行了一种新的研究,也为兽用DNA 疫苗研发做出有益探索。
