Pd(II)/氧化剂催化的sp2杂化碳C-N键的形成
2020-08-31李金海
赵 军,李金海
(贵州工程应用技术学院化学工程学院,贵州毕节 551700)
1 引言
不饱和碳氢化合物在金属络合物作用下发生的变化反应,在有机金属化学中占有十分重要的地位,尤其是当络合物作为催化剂的时候。过去20年,在用过渡金属络合物实现选择性的C-H键官能化方面,取得了相当多的成果。合适的金属能活化不饱和C-C键,使其容易发生加成反应,这类反应多数用钯来催化。
在钯催化的反应中,常用的是Pd(II)/氧化剂催化体系。在这些过程中,Pd(II)在反应中由于转化成Pd(0)而减少。为了维持催化循环,必需加入氧化剂,如Cu(II)、苯醌(BQ)和O2等,以重新生成或维持Pd(II)。众多的C-N键形成反应都使用该催化体系完成。为了实现期望的反应过程,需要改变配体、底物、溶剂、温度和添加剂等反应条件,而钯催化剂都能适应这些条件变化,因而其具有很好的通用性。大量不同的官能团已经被考察,通常能实现很好的立体或区域选择性。
2 C-N键的形成
Pd(II)促进氨基中的氮与C=C双键的亲核加成导致氧化胺化。底物与钯配位活化,帮助克服键与氮原子上的孤电子对之间的排斥。烯烃与亲电的Pd(II)配位,使得C=C双键容易受到氮原子的亲核进攻。在整个过程中,关键的中间体是β-氨基烷基钯络合物,该络合物消去β氢得到氧化胺化产物,也就是不饱和胺。最后一步产生Pd(0),如要维持催化循环,则必须再氧化成Pd(II)。
2.1 分子内反应
Hegedus等人创下了胺钯化反应领域的里程碑。他们最初使用化学计量的Pd(II),随后发展到使用催化计量的Pd(II)。从烯丙基苯胺衍生物1开始,使用催化计量的PdCl2(MeCN)2或者PdCl2,和化学计量的BQ作为氧化剂,得到产物吲哚类化合物2(图1)。[1]取代的程度决定了环化反应产物的不同。当R2不是H时,胺化更容易生成喹啉衍生物3。2-巴豆基苯胺在标准的条件下环化生成唯一的产物2-甲基喹啉。反之,在过量LiCl的条件下,2-乙基吲哚是唯一的产物。Harrington和Hegedus很快注意到,氨基化合物或磺胺类化合物的缺电子氮在耦联反应中得到更好的结果。[2]
后来,Izumi等人利用相似的途径分别用邻乙烯基乙酰苯胺类化合物和邻乙烯基苯甲酰胺类化合物制备了吲哚类化合物和异喹啉酮类化合物(图2)。[3]在这些例子中,环化形式上就是胺化反应。相同的方法论为Daphniphyllum生物碱的构建提供了依据。[4]

图1 吲哚类化合物2

图2 吲哚类化合物和异喹啉酮类化合物
类似地,根据不同的反应条件,利用N-磺化的邻烯丙基苯胺类化合物4,得到不同的环化产物5-7(图3)。[5]利用NHC配体(如IMes、IPr或七元杂环)和Pd(II)络合,能提高催化剂的稳定性和产物收率。倘若使用羧酸催化剂如AcOH、PhCO2H,则反应是在空气而不是在氧气中进行。

图3 不同的环化产物5-7
中国科学技术大学以Pd(OAc)2为催化剂、邻菲罗啉为配体,在空气中利用邻烯丙基苯胺类化合物8环化得到一系列2-甲基喹啉化合物9(图4)。[6]
Scheme 5描述了由Pd(II)催化的磺化的N-烯丙基邻氨基苯甲酰胺类化合物10发生分子内加成反应,生成喹唑啉-4-酮类化合物11和1,4-苯并二氮-5-酮类化合物12(图5)。[7]
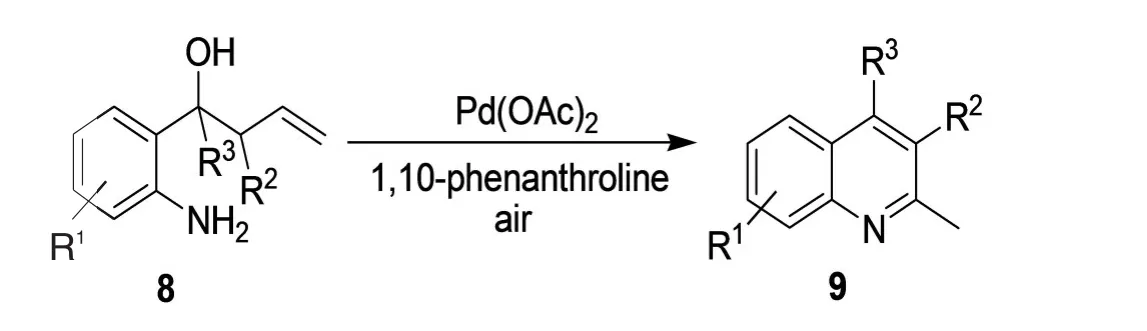
图4 2-甲基喹啉化合物9

图5 喹唑啉-4-酮类化合物11和1,4-苯并二氮-5-酮类化合物12
邻芳基乙酰苯胺类化合物13通过C-H活化和C-N键形成结合得到咔唑类化合物14(图6)[8]。反应路径设想生成了一个六元的钯环,然后通过还原消除得到产物和Pd(0)。Pd(0)由Cu(OAc)2再氧化成Pd(II),而还原的Cu又被O2再氧化成Cu(II)。

图6 咔唑类化合物14
2-(1-甲硅烷氧基乙烯基)-苯胺类化合物15通过分子内环化得到3-甲硅烷氧基吲哚类化合物16(图7)。去除保护基团,然后用卤代烷跟羟基反应得到3-烷氧基吲哚类化合物。[9]同样的方法应用到由2-(1-羟基烯丙基)-3-氨基吡啶合成1H-吡咯[3,2-b]吡啶17(图8)。[10]
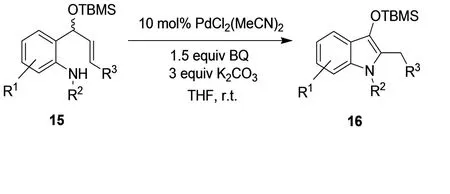
图7 3-甲硅烷氧基吲哚类化合物16

图8 1H-吡咯[3,2-b]吡啶17
1-烯丙基2-吲哚酰胺类化合物18通过分子内胺化得到高收率的吡嗪[1,2-a]吲哚衍生物19(图9)。[11]反应过程可能生成环化的钯络合物中间体,随后发生双键异构化。
Larock等报道,脂肪族和环状烯属的N-甲苯磺胺类化合物环化得到一个含烯丙基的氮杂环(图10)。[12]反应在DMSO和O2氛围中进行。Pd(OAc)2/O2/DMSO催化氧化体系的机理研究表明,分子氧将钯再氧化是催化循环的决定步骤。Stall等通过加入吡啶或其他亚胺配体能提高氧化胺化反应的催化效率[13],Pd(OAc)2/吡啶(1:2)催化体系在各类无极性和极性的溶剂中都能很好地工作。

图9 吡嗪[1,2-a]吲哚衍生物19

图10 含烯丙基的氮杂环
Liu等人考察了五个不同的催化体系对带有氮亲核基团烯烃的Wacker类型氧化环化反应的影响,结果表明,使用 Pd(OAc)2/DMSO、Pd(OAc)2/pyridine、Pd(O2CCF3)2/pyridine和 Pd(O2CCF3)2/(-)-sparteine催化体系,能使烯烃只进行顺式的胺钯化。使用NHC催化体系进行顺式和反式的胺钯化,如向该体系加入化学计量的布朗斯特碱(NaOAc,Na2CO3),则只观察到顺式的胺钯化。[14]
氮杂环20和21是己-5-烯胺在wacker类型条件下环化的产物,其它带有一级或二级胺的烯烃得到相应的环胺,而带有三级胺的烯烃得到氨基酮22(图11)。[15]

图11 氨基酮22
由磺化的2-羟基-3-丁烯基胺类化合物23也能得到吡咯衍生物(图12)。[16]羟基基团对反应是必不可少的。用Pd(OAc)2代替PdCl2(MeCN)2时,不发生反应。事实上,氯离子在环化反应中扮演了一个极为重要的角色。PdCl2先在C3-C4加成,然后氯被氮亲核取代。
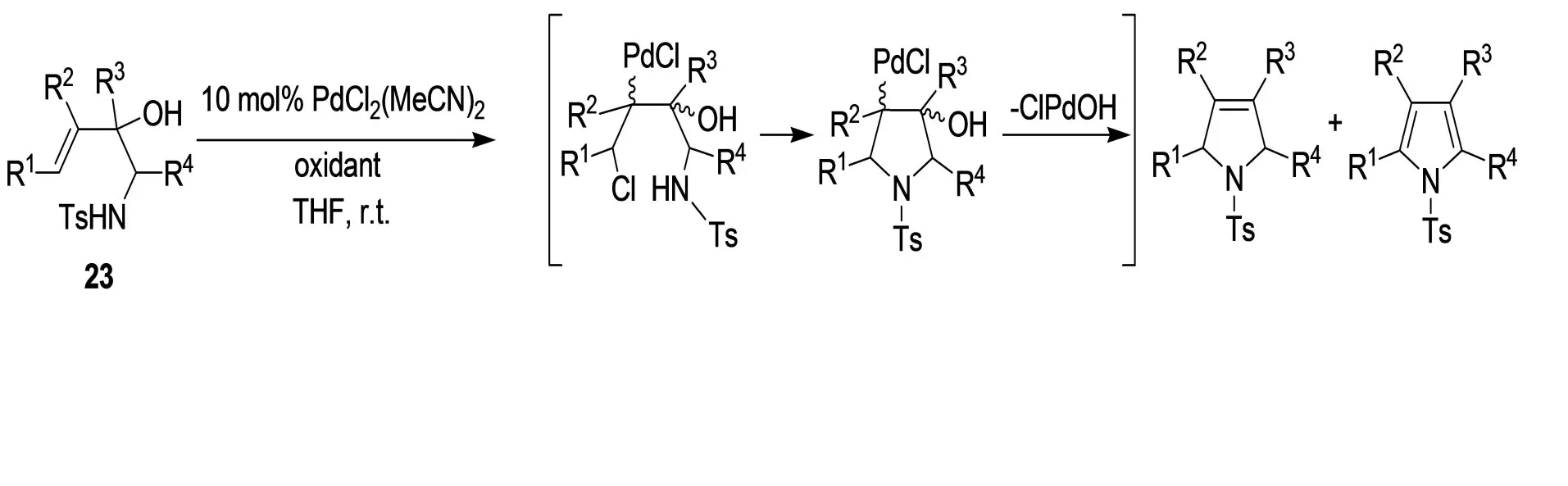
图12 吡咯衍生物
链二烯烃酸的氨基化合物发生1,4加成形成两个C-N键。通过改变不饱和共轭双键和氨基基团之间的碳链长度,得到吡咯里西啶24或吲哚里西啶25骨架(图13)。[17]
咪唑啉衍生物27可由缩醛胺类化合物26环化得到,而26由N-Boc保护的烯丙基胺、甲醛和一个氮源制备(图14)。[18]标准的氧化环化反应条件使底物转化为相应的咪唑啉类化合物,而后者则可能转化为二胺化合物。
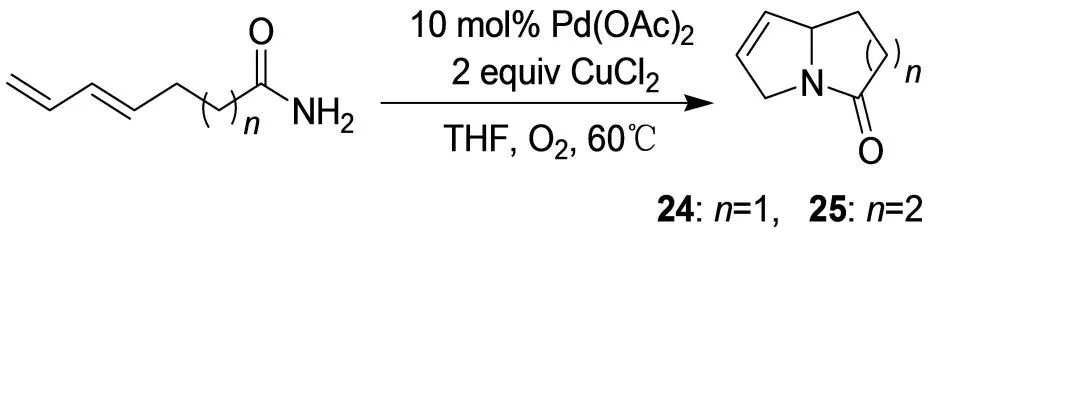
图13 吡咯里西啶24或吲哚里西啶25骨架
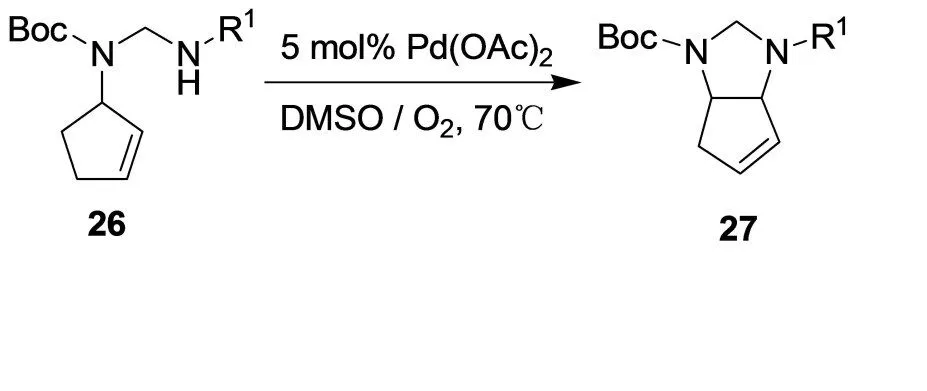
图14 咪唑啉衍生物27
邻烷基取代的羟胺化合物在Pd催化下环化生成异恶唑烷类化合物(图15)。[19]氮上的拉电子基团对反应是必不可少的。
异恶唑烷-5-螺环丙烷28在还原剂作用下打开异恶唑烷环生成-氨基环丙醇,随后发生钯(II)催化的多米诺开环/环化/氧化反应(图16)[20],重排成二氢吡啶酮29或三氢吡啶酮30。

图15 异恶唑烷类化合物
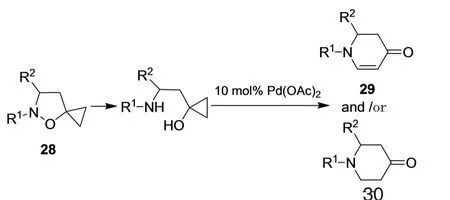
图16 二氢吡啶酮29或三氢吡啶酮
2.2 分子间反应
Bozell和Hegedus所描述的分子内胺化反应被延伸到取代苯胺化合物31和缺电子烯烃的分子间反应,得到β-苯氨基-α,β-不饱和烯酮、酯和腈(图17)。[21]取代基团对共轭烯酮和钯的反应影响是十分明显的,因为如果烯酮是α或β位取代,钯插入反应是不会进行的。
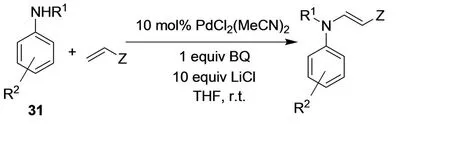
图17 β-苯氨基-α,β-不饱和烯酮、酯和腈
Lee等人改进了由一级胺和共轭烯烃反应制备烯胺的方法(图18)。[22]至于容易形成Z-烯胺,大概是因为氨基的质子和碳基氧形成分子内氢键的缘故。
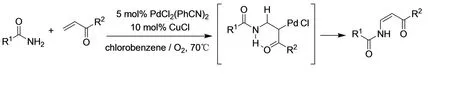
图18 制备烯胺的方法
用PdCl2(MeCN)2/CuCl/O2催化体系将胺酯加到烯烃(如甲基丙烯酸酯)上得到烯烃的氨基甲酸酯32(图19)。[23]在Pd(acac)2/磷配体/路易斯酸的催化体系下,用共轭二烯(如异戊二烯)和2,3-二甲基丁二烯反应能得到更好的结果。
N-磺酰基-2-氨基二苯化合物33用Pd(OAc)2和Cu(OAc)2作催化剂,在空气氛围下,和缺电子烯烃发生耦联反应,形成菲啶衍生物34(图20)。[24]

图19 烯烃的氨基甲酸酯32
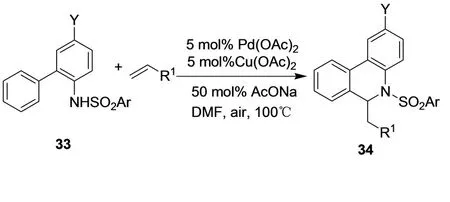
图20 菲啶衍生物34
根据Hosokawa等人的工作,缺电子烯烃和作为亲核试剂的环状氨基甲酸酯或内酰胺胺化得到相应的N-取代的化合物35。反应用PdCl2(MeCN)2/CuCl体系在1atm的O2中进行(图21)。[25]氨基甲酸酯比内酰胺具有更高反应活性。

图21 N-取代的化合物35
Timokhin等人实现了用PdCl2(MeCN)2/CuCl2作催化剂、1atm的O2下,利用唑烷酮直接胺化得到对位取代的苯乙烯类化合物(图22)。[26]伴随加入的TEA确保完全的区域选择性,生成唯一的马氏构型产物36。实验证实,该区域选择性是源于布朗斯特碱的影响。事实上,先前用到的质子化的唑烷酮甚至在没有外加碱的条件下也能形成马氏构型的产物。
乙烯醚和氮亲核试剂如氨基化合物、氨基甲酸酯和磺胺化合物能发生交叉耦合反应,得到烯胺衍生物37(图23)。[27]用不同的催化剂实验得出,在空气氛围下,用Pd(OCOCF3)2和DPP能收到最佳的效果。但一级胺和二级胺这样的氮亲核试剂甚至在最佳条件下都不反应。

图22 对位取代的苯乙烯类化合物
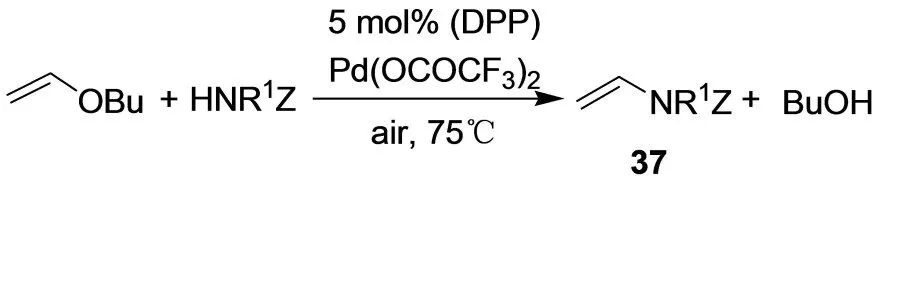
图23 烯胺衍生物37
这种反应也应用到没活化的烯烃上。苯邻二甲酰亚胺和环状烯烃(环辛烯、环戊烯)或脂肪族烯烃(1-己烯、1-辛烯)反应时,由于双键发生顺式的胺钯化,得到含氮化合物38(图24)。[28]经过考察不同的催化剂后,最佳的条件是氧气氛围下,苯甲腈为溶剂的Pd(OAc)2催化体系。该发现的价值体现在无助催化剂的氧化上。非酸性的NH基团,包括马啉、哌啶和苯胺,在相同的条件下是没有反应活性的。
共轭二烯的二胺化反应实例是关于二烯和N,N-二烷基尿素的。N,N-二烷基尿素和异戊二烯在BQ或分子氧的存在下,得到同分异构体产物39和40的混合物(图25)[29]。和其它的1,3二烯反应,胺化具有更高的区域选择性,得到产物41(图26)。BQ作为再氧化剂被证实远比O2高效,它避免了不必要的副反应。

图24 含氮化合物38
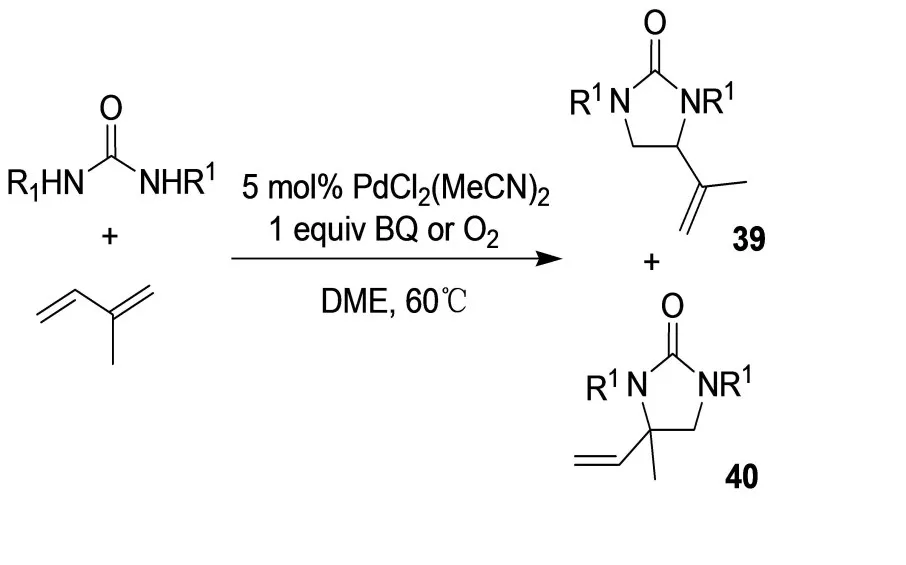
图25 同分异构体产物39和40的混合物

图26 产物41
3 结论
本文论证了钯(II)催化过程是烯烃和芳烃官能化的有效方法,形成C-N键,并应用到日益增多的多官能化合物的合成上。在这类型的反应中,烯烃的芳构化或杂环芳构化、烷基化和胺化,是最常用的。这些反应在相关的温和条件下进行,并适应多种类型的官能团,其优点是使用了易处理的钯。钯比较稳定,而且有的反应在空气中都能进行。另一个值得重视的方面就是溶剂能够不同程度地适应并稳定钯催化剂,因而能控制反应的速度。
本文也论证了在Pd催化反应中,催化剂的角色是至关重要的。不同催化剂对反应过程和产物收率有极大的影响。例如,醋酸钯和氯化钯的反应活性是十分不同的。选择催化剂和溶剂对反应至关重要。Pd(II)氧化催化反应的另一个关键是氧化剂。大部分以钯为催化剂的氧化反应除了分子氧以外,仍然需要一个最终的氧化剂,而这些限制因素仍未能完全明白。
Pd(II)催化的烯烃官能化有很好的区域和立体选择性,这对实际的有机合成是十分重要的。不过,在利用新的手性配体来提高不对称催化方面,仍有一些挑战。最后,钯催化反应最低程度地产生副产物,因此属于环境友好的化学过程。
