高效制备霍乱弧菌菌影及其增强猪瘟疫苗免疫效果的研究
2020-08-31姬生乐韩美晴杜丽宏彭名正徐思艳杨梦华
姬生乐,韩美晴,杜丽宏,彭名正,徐思艳,杨梦华
(浙江农林大学 动物科技学院/动物医学院,浙江 杭州 311300)
细菌菌影(Bacterial ghost,BG)是通过在细菌中表达噬菌体φX174 裂解E 蛋白使细菌的内外膜融合后形成孔道,由于渗透压的作用丢失其内容物而保留一个完整的空壳[1]。BG 含有许多天然免疫刺激因子,能有效激活先天性免疫和适应性免疫[2-3]。许多研究表明BG 作为免疫佐剂可有效协助不同的抗原产生免疫保护作用。Jiao 等利用肠炎沙门氏菌菌影装载淋病奈瑟菌DNA 疫苗并在体内和体外进行实验显示,肠炎沙门氏菌菌影可以促进巨噬细胞RAW264.7 吸收DNA,并且刺激小鼠产生更强的特异性抗体[4]。Eko 等研究发现,霍乱弧菌菌影(Vibrio cholerae ghosts,VCG)可以刺激并活化树突状细胞,增强树突状细胞对抗原的应答能力[5]。Pan 等以VCG或者CpG+FL 为佐剂,与Pmp18D 蛋白联合使用时发现,菌影组T 细胞活化相关分子的表达上调更明显[6]。上述研究表明,BG 有望成为一种效果良好的新型免疫佐剂。
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种接触性传染病。临床症状表现为高热,全身多处出血,并以多处出血、梗死和内脏器官坏死等为主要病理特征[7]。由于该病高度的传染性及致病性,给养猪业带来了严重经济损失[8]。目前,猪瘟疫苗主要有减毒活性疫苗和亚单位疫苗。猪瘟C 株减毒活疫苗是目前最常用的疫苗,是CSFV 在家兔体内反复传代获得的弱毒疫苗,免疫效果较好[9]。猪瘟亚单位疫苗是一种新型疫苗,通常是纯化CSFV 的保护性抗原来作为疫苗使用,如CSFV 囊膜E2 蛋白是亚单位疫苗的主要目标蛋白,其中E2 蛋白AD 和BC 区是诱导CSFV 抗体产生的主要抗原结构域[10]。猪瘟亚单位疫苗仅使用一个或者多个抗原,减少传统疫苗可能引发的不良反应,但亚单位疫苗存在着免疫原性低下的缺点,需要配合佐剂的使用才能发挥更好效果。鉴于猪瘟对养殖业造成的严重危害,对增强现有猪瘟疫苗效果以及开发新型猪瘟疫苗的研究显得尤为迫切。
VCG 具有很好的免疫原性,并且相较于其它佐剂生产成本低,制备工艺简单。此外,VCG 可以以冻干粉的形式在室温下保存和运输,大大降低保存和运输成本。本实验制备了高裂解率的VCG,并将其分别与猪瘟活疫苗和E2 蛋白主要抗原区亚单位疫苗联合使用,评价其对猪瘟活疫苗和亚单位抗原免疫效果的影响,以期为今后研发廉价高效的疫苗佐剂提供重要的实验依据。
1 材料与方法
1.1 菌株、载体及实验动物CSFV 石门株囊膜E2蛋白包含AD 与BC 主要抗原区重组蛋白(2 mg/mL)由本实验室制备并保存;非O1/139 群霍乱弧菌由本实验室保存;CSFV 弱毒株由浙江农林大学王晓杜老师惠赠;pBV220-E 质粒由中国农业大学何诚老师馈赠;家兔购自杭州市余杭区科联兔业。
1.2 主要试剂及培养基经典猪瘟活疫苗(传代细胞源)购自中牧实业股份有限公司(江西生物药厂),生产批号为1801009,每头份约含15000 RID50的病毒;CSFV 阻断ELISA 抗体检测试剂盒购自武汉科前生物股份有限公司;弗氏完全佐剂(CFA)购自Sigma 公司;LB 培养基各成分购自生工生物工程(上海)股份有限公司。
1.3 VCG 的制备制备霍乱弧菌电转化感受态细胞[11],将裂解质粒pBV220-E 电转化至霍乱弧菌感受态细胞中,筛选阳性菌。参照文献[12]制备VCG,并通过冷冻干燥制备菌影冻干粉。利用平板活菌计数的方法计算菌影裂解率,计算公式:[(裂解前活菌数-裂解后活菌数)/裂解前活菌数]×100%。按常规方法利用透射电镜观察VCG。
1.4 不同剂量猪瘟活疫苗免疫家兔的抗体检测选用18 只健康家兔分为6 组,3 只/组。各组分别经颈背部皮下方式注射3000 RID50、1000 RID50、200 RID50、100 RID50和50 RID50的经典猪瘟活疫苗,即CSF ST,对照组注射1 mL PBS。免疫后第7 d、14 d、21 d、28 d、35 d 和42 d 通过耳缘静脉采血方式采集兔血并分离血清,利用CSFV 阻断ELISA 抗体检测试剂盒检测各组抗体水平变化情况。获得的实验数据经统计学分析后选择抗体水平相对较低的猪瘟活疫苗使用剂量进行后续研究。
1.5 VCG 联合猪瘟活疫苗免疫家兔的抗体检测为探究VCG 作为佐剂对猪瘟活疫苗效果是否有增强作用,选用15 只健康家兔共分为3 组,每组5 只家兔。第一组为对照组,第二组为猪瘟活疫苗组(CSF ST),第三组为109个细胞量的VCG 加猪瘟活疫苗组(VCG+CSF ST)。免疫方式、采血时间、以及抗体检测同1.4。
1.6 VCG 与E2 蛋白主要抗原区蛋白联合免疫家兔的抗体检测参照文献[13],以600 μg/只纯化的E2 蛋白与CFA 混合免疫家兔后,猪瘟抗体生成速率过快,因此按照300 μg/只蛋白量进行后续试验。为了评价VCG 对E2 蛋白BC 和AD 主要抗原区亚蛋白的免疫效果,将15 只健康家兔分为3 组,每组5 只。第一组为对照组;第二组注射300 μg 蛋白加CFA,即CFA(E2);第三组注射300 μg 蛋白加109个细胞量的VCG,即VCG(E2)。颈背部皮下注射免疫,免疫4 次,每次免疫间隔两周。首次免疫后第21 d、28 d、35 d、42 d、49 d 和56 d 通过耳缘静脉采血方式采集兔血并分离血清,利用CSFV 阻断ELISA 抗体检测试剂盒检测抗体水平变化。
1.7 家兔定型热反应检测上述1.5 和1.6 试验涉及的所有家兔分别在免疫42 d 和56 d 后进行CSFV 攻毒实验,以500 RID50/只的CSFV 弱毒株通过耳缘静脉对家兔进行攻毒,此后每隔6 h 测定家兔直肠温度,连续观察3 d,以判定家兔是否产生定型热反应。定型热判定标准为,连续3 个测温时间点高于基础体温1 ℃[14]。
2 结 果
2.1 VCG 的制备及裂解效果评价将制备的VCG进行平板活菌计数检测,结果显示,在诱导E 基因表达前,活菌数为1.7×107cfu/mL,裂解后活菌数为4×103cfu/mL,根据裂解率计算公式得出细菌裂解率为99.9%。菌影制备成冻干粉后,取约109细胞的菌影量涂板计数发现无活菌生长。透射电镜观察可见,表达E 基因的霍乱弧菌在裂解之后,细胞失去大部分的细胞内容物,形成了完整细菌空壳(图1A),而未表达E 基因的霍乱弧菌,其细胞完整(图1B)。结果表明,制备的VCG 裂解率高,裂解效果良好。
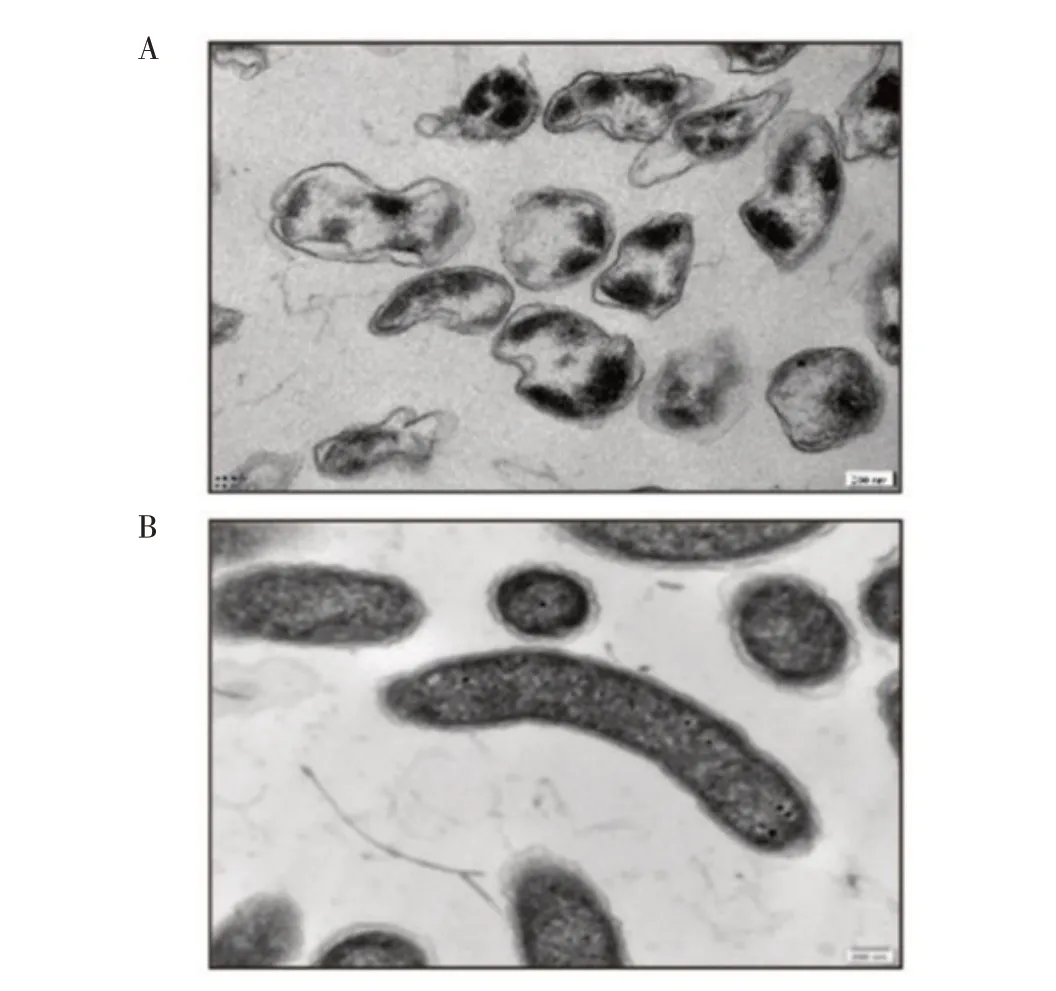
图1 VCG(A)与霍乱弧菌(B)透射电镜结果Fig.1 TEM images of Vibrio cholerae ghosts(A)and Vibrio cholerae cells(B)
2.2 不同剂量猪瘟活疫苗免疫家兔的抗体检测利用不同剂量猪瘟活疫苗(传代细胞源)免疫家兔,并监测家兔体内猪瘟抗体产生的变化。结果显示,当使用免疫剂量为50 RID50的猪瘟活疫苗时,家兔体内CSFV 抗体的产生速度相较于其它免疫剂量组显著降低(p<0.001),而当猪瘟活疫苗接种剂量大于200 RID50时,相较于免疫剂量较低的实验组,其抗体产生速度显著加快(p<0.001)(图2)。表明当以50 RID50的猪瘟活疫苗免疫家兔,动物的抗体生成速率最低,适合观察VCG 对猪瘟活疫苗刺激家兔后抗体阻断率的上升趋势。因此,在后续实验中使用50 RID50的猪瘟活疫苗进一步研究VCG 对猪瘟活疫苗免疫效果的作用。

图2 猪瘟活疫苗免疫家兔的猪瘟抗体水平Fig.2 The blocking rate of serum antibodies in live vaccine immunized rabbits
2.3 VCG 与猪瘟活疫苗联合免疫家兔的抗体检测实验利用含有或不含有VCG 的50 RID50经典猪瘟活疫苗(CSF ST)以及等量的PBS(作为阴性对照)分别免疫家兔一周后,每周采血进行抗体检测。结果显示,VCG+CSF ST 组家兔产生的抗体阻断率在14 d 后的大部分时间点显著高于CSF ST 组(p<0.05)(图3)。表明VCG 可以增强猪瘟活疫苗的免疫效果,具有良好的佐剂效果。

图3 VCG 与猪瘟活疫苗联合免疫后家兔抗体水平Fig.3 The blocking rate of serum antibodies in immunized rabbits
2.4 VCG 与猪瘟活疫苗联合免疫家兔的定型热反应检测VCG 联合猪瘟活疫苗免疫实验的所有家兔在一免后的42 d 进行耳缘静脉攻毒,攻毒剂量为500 RID50的CSFV 弱毒株。结果显示空白对照组的5只家兔均出现了定型热反应,而注射了联合VCG 的猪瘟活疫苗和单独的猪瘟疫苗的两组均无定型热反应(表1)。

表1 VCG 与猪瘟活疫苗联合免疫家兔的定型热反应Table 1 Fever reactions of the immunized rabbits
2.5 VCG 与E2 蛋白主要抗原区蛋白联合免疫家兔的抗体检测分别用CFA(E2)、VCG(E2)以及等量的PBS 免疫家兔,免疫后每周采血检测抗体。结果显示,在二免一周后除对照组外均有特异性抗体产生,且均为上升趋势(p<0.001)。此外,VCG(E2)组阻断率略低于弗氏佐剂乳化E2 蛋白主要抗原区组,然而在免疫后第56 d 后也可达到80%以上(图4)。表明了VCG 联合E2 蛋白主要抗原区蛋白可以诱导机体产生抗体,引发了较强的体液免疫。

图4 VCG 与E2 蛋白亚单位疫苗免疫家兔后的抗体水平Fig.4 The blocking rate of serum antibodies in subunit vaccine immunized rabbits
2.6 VCG 与E2 蛋白主要抗原区蛋白联合免疫家兔的定型热反应检测所有家兔在免疫56 d 攻毒,方式同2.4。结果显示,注射PBS 的5 只家兔产生了定型热反应,而通过VCG(E2)和CFA(E2)免疫的实验家兔均没有发生定型热反应(表2)。

表2 VCG 与E2 蛋白亚单位疫苗联合免疫家兔的定型热反应Table 2 Fever reactions of the immunized rabbits
3 讨 论
VCG 保留了细菌的天然抗原成分,能够显著增强机体的免疫反应,被认为是一种新型佐剂。与传统化学佐剂相比,VCG 不会对机体造成伤害,具有更好的安全性。有学者以胸膜肺炎放线杆菌菌影作为佐剂联合猪圆环病毒2 型衣壳蛋白Cap 亚单位疫苗免疫仔猪,发现菌影佐剂效果优于ISA61 佐剂[15]。Macmillan 等利用VCG 同时呈递衣原体MOMP 蛋白和疱疹病毒2 型的gD2 蛋白,制备了重组菌影免疫小鼠,发现小鼠可以产生针对两种抗原蛋白的特异性抗体[16]。因此,VCG 不仅可以单独作为佐剂使用,还可以搭载外源蛋白作为新型载体疫苗使用。
本研究评价了VCG 作为佐剂对猪瘟活疫苗以及CSFV E2 蛋白主要抗原区蛋白亚单位疫苗免疫效果的影响。在VCG 的制备实验中发现,所获得的VCG仍有少量活菌残留。因此,为进一步提高VCG 的生物安全性,实验将VCG 作冻干处理。活菌平板计数结果显示,处理后的VCG 无活菌残留。在VCG 联合猪瘟活疫苗使用的实验中发现,VCG 联合猪瘟活疫苗组的抗体阻断率从14 d 后大部分时间点显著高于单独使用猪瘟活疫苗组。主要原因可能是VCG 可以刺激并活化树突状细胞,增强树突状细胞对抗原的应答能力[5],使得机体识别猪瘟疫苗的速度加快,从而提高猪瘟疫苗的免疫效果。另外,在VCG 联合猪瘟E2 蛋白主要抗原区蛋白的实验中发现,CFA(E2)和VCG(E2)两组的抗体阻断率均呈上升趋势,表明了VCG 联合E2 蛋白主要抗原区蛋白可以刺激机体产生较强的体液免疫。主要原因可能是因为BG 可以被树突状细胞有效的摄取并诱导促炎性细胞因子的产生,随后上调共刺激分子以有效地将蛋白抗原呈递给幼稚T 细胞[17]。但是弗氏佐剂组的抗体阻断率在各个时间点略大于VCG 佐剂组,这可能是因为作为商业化佐剂的CFA 具有很好的免疫佐剂效果,而VCG 作为一种新型佐剂在剂量使用上有可能并未达到其最佳值,因而无法发挥其的最佳佐剂效果。因此,为了提高VCG 作为佐剂的使用效果,在其使用剂量方面仍需进一步研究。同时,在家兔定型热反应实验中,各个疫苗组均无家兔产生定型热反应,而对照组家兔均出现定型热反应,这也说明猪瘟活疫苗和加了CFA 或者VCG 的E2 蛋白主要抗原区亚单位疫苗均为家兔提供了一定程度抵抗CSFV 感染的能力。除此之外,在本研究中还发现,猪瘟活疫苗各组的抗体生成速率明显快于亚单位疫苗各组的抗体生成速率,可能是由于猪瘟活疫苗是完整的病毒粒子,在免疫原性方面要优于单独的CSFV E2 蛋白主要抗原区蛋白。也有可能是本实验使用的E2 蛋白剂量较低,这是为了更显著的区分CFA 和VCG 的效果差异,但较低的E2 蛋白量可能会使家兔产生抗体的速度变慢,今后需要做进一步细化的研究才能更好的比较猪瘟活疫苗与E2 蛋白亚单位疫苗的免疫保护效果。
本研究的结果均表明,VCG 可以增强猪瘟活疫苗的免疫效果,并且与CSFV E2 蛋白主要抗原区蛋白联合使用可以有效激发机体的体液免疫反应,产生了良好的免疫效果。因此,VCG 作为一种新型疫苗佐剂具有广阔的应用前景。
