猪源肉孢子虫双重套式PCR检测方法的建立
2020-08-31闫文朝钱伟锋韩利方
刘 婕,闫文朝,钱伟锋,韩利方,薛 瑞
(河南科技大学 动物科技学院,河南 洛阳 471023)
肉孢子虫病是由肉孢子虫(Sarcocystis)引起的一种人兽共患寄生虫病,能感染哺乳动物、鸟类及人等宿主,在动物群体中感染率较高[1-2]。目前能够感染猪的肉孢子虫有3 种,即米氏肉孢子虫(S. miescheriana)、猪人肉孢子虫(S.suihominis)和猪猫肉孢子虫(S.porcifelis),其中米氏肉孢子虫和猪人肉孢子虫在世界各地均有相关报道,其种的有效性得到公认[2-3]。但猪猫肉孢子虫仅在少数局部地区有报道,因数据资料缺乏,其种的有效性尚存在争议[2-3]。
肉孢子虫的生活史需要中间宿主和终末宿主[4-5]。猪人肉孢子虫以人为终末宿主,人感染后的临床表现为发热、恶心、腹泻、呕吐,有时还会出现脱水和关节酸痛等症状,严重危害人的健康[6-8]。肉孢子虫的包囊主要寄生于猪的膈肌、颈背侧肌、腿肌、心肌等部位[9-11],会引起仔猪发热、贫血、呼吸困难、运动障碍等症状,引起怀孕母猪流产,严重时导致死亡[2,5]。包囊寄生在宿主心肌和骨骼肌中并发生炎性反应,造成肉类产品污染及废弃[3]。
建立敏感、特异和快捷的肉孢子虫检测技术对猪肉孢子虫病防控具有重要意义。目前肉孢子虫常用的检测方法主要是肌肉压片镜检法[12-13],该法虽然操作简单,但是目前已知的米氏肉孢子虫和猪人肉孢子虫包囊均是小型包囊,肉眼不易发现,在显微镜下其与脂肪滴和结缔组织相似,容易误诊。另外,肌肉压片镜检法检出率偏低[12]。与常规PCR 相比,套式PCR 技术具有更灵敏更特异的优点[14],多重PCR 具有一管PCR 反应同时检测多种病原DNA 的便捷和高效优势[15]。基于此,本研究将套式PCR 和多重PCR 结合建立了猪源肉孢子虫双重套式PCR 检测方法,可实现对猪肉和血液等样品中米氏肉孢子虫和猪人肉孢子虫的准确、快速鉴别检测,为猪肉孢子虫病诊断和分子流行病学研究提供高效的检测手段。
1 材料与方法
1.1 主要实验材料2×EasyTaq® PCR SuperMix、DL2000 Plus DNA Marker、EasyPure® Quick Gel Extraction Kit、pEASY-T1 克隆载体、EasyPure® Plasmid MiniPrep Kit 购自北京全式金生物技术有限公司、细胞/组织基因组DNA 提取试剂盒购自天根生化科技(北京)有限公司;3 g~5 g 镜检包囊阳性、并经PCR 鉴定分别为米氏肉孢子虫和枯氏肉孢子虫的猪肉和牛肉以及不含肉孢子虫包囊的猪肉均来自洛阳冷鲜肉专卖店;刚地弓形虫和犬新孢子虫速殖子为本实验室保存。各肉制品经组织匀浆后,提取其基因组DNA 以及刚地弓形虫和犬新孢子虫速殖子的基因组DNA;从洛阳地区超市和冷鲜肉专卖店购买22 份新鲜肉样。这些基因组DNA 和肉样于-20 ℃保存。
1.2 引物的设计与合成从GenBank 下载米氏肉孢子虫(JN256123、JX840465)18S rRNA 和猪人肉孢子虫18S rRNA 基因序列(MH404229、KP732435),利用DNASTAR-MegAlign 软件进行序列比对,利用软件Oligo 6.0 分别在这两个18S rRNA 基因序列均保守区设计猪源肉孢子虫双重套式PCR 外引物EXPCF/R(表1),再在这两个孢子虫18S rRNA 基因序列的变异区分别设计米氏肉孢子虫和猪人肉孢子虫特异性套式PCR 内引物INPM2F/R 和INPSF/R(表1),内、外引物均由生工生物工程(上海)股份有限公司合成。
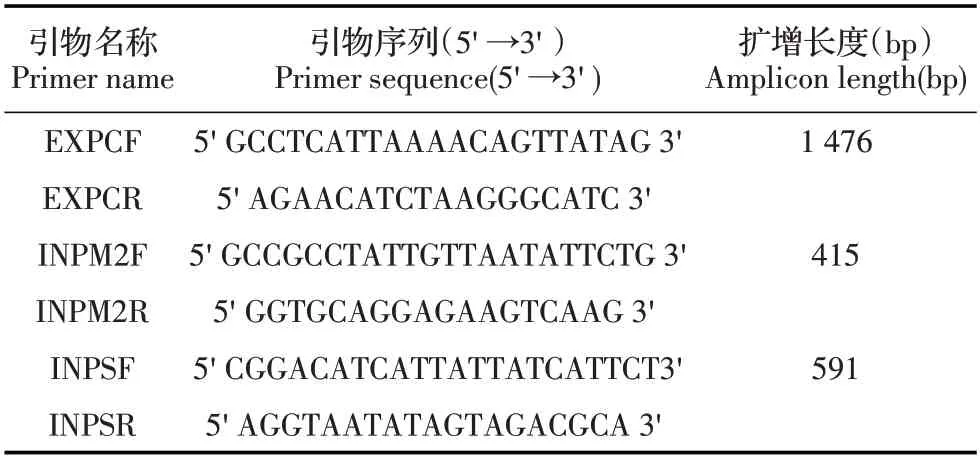
表1 猪源肉孢子虫双重套式PCR 的引物Table 1 Primers of the duplex nested PCR assay for detecting the Sarcocystis species in pig samples
1.3 重组质粒标准品的构建与鉴定以米氏肉孢子虫包囊阳性肉样的基因组DNA 为模板,利用外引物EXPCF/RPCR 扩增米氏肉孢子虫18S rRNA 基因序列,并克隆到pEASY-T1 载体中,通过菌落PCR和测序鉴定获得重组质粒pEASY-T1-Sm18S rRNA;根据GenBank 中猪人肉孢子虫18S rRNA 基因序列(MH404229)[4],由生工生物工程(上海)股份有限公司合成猪人肉孢子虫18S rRNA 序列,并克隆到pEASY-T1 载体中,通过菌落PCR 和测序鉴定获得重组质粒pEASY-T1-Ss18S rRNA。利用分光光度计测定和计算这两种重组质粒的浓度(ng/μL),再按照公式M=(6.02×1023)×(X1 ng/μL×10-9)/((质粒碱基数X2×660)=拷贝数/μL,计算质粒的拷贝数[14],最后将两种质粒均稀释成3×1010拷贝/μL 作为标准品用于后续试验。
1.4 单巢式PCR 反应条件的优化参考文献[16],采用25 μL反应体系,两种质粒标准品浓度均为3×104拷贝/μL,作为DNA 模板,分别以外引物EXPCF/R和内引物INPM2F/R 及INPSF/R(表1)进行单巢式PCR 扩增,引物浓度设置为2.0 μmol/L、1.5 μmol/L、1.0 μol/L、0.5 μmol/L。第一轮PCR 扩增程序:94 ℃5 min;94 ℃40 s、51 ℃~59 ℃30 s、72 ℃90 s,共35 个循环;72 ℃10 min;将第一轮PCR 产物10 倍稀释后作为模板,进行第二轮PCR 扩增,扩增程序:
94 ℃5 min;94 ℃40 s、51 ℃~59 ℃30 s、72 ℃40 s,共35 个循环;72 ℃10 min。评价米氏肉孢子虫和猪人肉孢子虫单巢式PCR 内、外引物的扩增效率,优化最佳引物浓度和退火温度等反应条件。
1.5 双重套式PCR 反应条件的优化参考1.4 单巢式PCR最佳反应条件,进行双重套式PCR扩增条件的优化。外引物和内引物浓度分别设置为2.0 μmol/L、1.5 μmol/L、1.0 μmol/L、0.5 μmol/L。在外引物(EXPCF/R)的扩增反应管中加入米氏肉孢子虫和猪人肉孢子虫重组质粒标准品各1 μL 作为模板,两种质粒浓度均为3×104拷贝/μL,第一轮PCR 扩增程序:94 ℃5 min;94 ℃40 s、51 ℃~59 ℃40 s、72 ℃90 s,共35个循环;72 ℃10 min;将PCR 产物10 倍稀释后,取1 μL 作为模板,加入米氏肉孢子虫和猪人肉孢子虫两种内引物(INPM2F/R 和INPSF/R),进行第二轮PCR扩增,扩增程序:94 ℃5 min;94 ℃40 s、51 ℃~59 ℃40 s、72 ℃40 s,共35 个循环;72 ℃10 min。通过琼脂糖凝胶电泳结果优化内、外引物合适浓度和最佳退火温度。
1.6 双重套式PCR 方法的特异性试验采用优化的反应条件,以刚地弓形虫和犬新孢子虫速殖子基因组DNA、不含肉孢子虫包囊的猪肉基因组DNA、米氏肉孢子虫和枯氏肉孢子虫包囊基因组DNA、猪人肉孢子虫质粒标准品、米氏肉孢子虫和猪人肉孢子虫重组质粒混合样品为模板,进行套式PCR 扩增,以评价双重套式PCR 的特异性。
1.7 双重套式PCR 方法的敏感性试验采用优化的反应条件,以10 倍倍比稀释的米氏肉孢子虫和猪人肉孢子虫重组质粒标准品(0.5×104拷贝/μL~5×104拷贝/μL)为模板,进行双重套式PCR 扩增,评价其敏感性。
1.8 临床样品的检测将22 份猪肉样品每份采集3 g~5 g 肉样匀浆后,提取组织总DNA 作为模板,采用本研究建立的双重套式PCR 方法进行扩增。同时采用肌肉压片镜检方法[12-13]检测这些临床样品的肉孢子虫,比较二者的检测结果,并计算二者的符合率。
2 结 果
2.1 重组质粒标准品的鉴定结果经菌落PCR 和测序分析,构建的重组质粒pEASY-T1-Sm18S rRNA包含了正确的1 476 bp 米氏肉孢子虫18S rRNA 基因序列;重组质粒pEASY-T1-Ss18S rRNA 包含了正确的1 500 bp 猪人肉孢子虫18S rRNA 基因序列。经测定,pEASY-T1-Sm18S rRNA 为235.4 ng/μL,pEASYT1-Ss18S rRNA 为289.2 ng/μL。根据公式计算重组质 粒pEASY-T1-Sm18S rRNA 为3.97×1010拷 贝/μL,pEASY-T1-Ss18S rRNA 为4.86×1010拷贝/μL。将二者分别稀释至3.0×1010拷贝/μL 作为标准品,用于后续试验。
2.2 单巢式PCR反应条件的优化结果米氏肉孢子虫和猪人肉孢子虫的单巢式PCR优化结果显示,其反应体系为25 μL,内、外引物浓度均为0.5 μmol/L。外引物(EXPCF/R)的最佳退火温度是56 ℃,循环中的延伸时间是90 s;米氏肉孢子虫内引物(INPM2F/R)的最佳退火温度是57 ℃,循环中的延伸时间是40 s;猪人肉孢子虫内引物(INPSF/R)的最佳退火温度是58 ℃,循环中的延伸时间是40 s。
2.3 双重套式PCR 反应条件的优化结果米氏肉孢子虫和猪人肉孢子虫的双重套式PCR 优化结果显示,其反应体系为25 μL,最佳内、外引物浓度均为0.5 μmol/L。最佳PCR 扩增条件:第一轮扩增条件为94 ℃5 min;94 ℃40 s、56 ℃40 s、72 ℃90 s,共35 个循环;72 ℃10 min;第二轮PCR 扩增条件为:94 ℃5 min;94 ℃40 s、58 ℃40 s、72 ℃40 s,共35 个循环;72 ℃10 min。琼脂糖凝胶电泳结果显示,两轮PCR扩增产物大小均与预期一致,外引物扩增长度为1 476 bp,米氏肉孢子虫内引物(INPM2F/R)扩增长度为415 bp;猪人肉孢子虫内引物(INPSF/R)扩增长度为591 bp,片段大小差别明显(图1),可以很好的区分。

图1 猪源肉孢子虫双重套式PCR 扩增结果Fig.1 Amplication results of the duplex nested PCR assay for detecting the Sarcocystis species in pig sample
2.4 双重套式PCR 的特异性试验结果特异性试验结果显示,本研究建立的双重套式PCR 方法对枯氏肉孢子虫、刚地弓形虫、犬新孢子虫和不含肉孢子虫包囊的猪肉基因组等样品均未扩增出目的条带,而米氏肉孢子虫包囊基因组、猪人肉孢子虫质粒标准品pEASY-T1-Ss18S rRNA、米氏肉孢子虫和猪人肉孢子虫重组质粒混合样品均扩增出目的条带(图2),表明本实验建立的双重套式PCR 具有较强的特异性。

图2 猪源肉孢子虫双重套式PCR 特异性试验结果。Fig.2 Specificity of the duplex nested PCR specific assay
2.5 双重套式PCR 的敏感性试验结果敏感性试验结果显示,双重套式PCR 对米氏肉孢子虫和猪人肉孢子虫18S rRNA 质粒标准品的最低检测限均为5 拷贝/μL,但是扩增条带比较弱;50 拷贝/μL 以上浓度的重组质粒均扩增出较明亮的目的条带(图3)。表明本实验建立的双重套式PCR 具有较高的敏感性。

图3 猪源肉孢子虫双重套式PCR 敏感性试验结果Fig.3 Sensitivity of the duplex nested PCR assay
2.6 临床样品的检测结果双重套式PCR 对22 份猪肉样品的检测结果显示,有5 份样品为米氏肉孢子虫阳性,没有检测出猪人肉孢子虫,17 份阴性样品;肌肉压片镜检结果显示,有3 份样品为肉孢子虫阳性,19 份样品为阴性。经计算,本研究建立的多重套式PCR 方法与肌肉压片镜检阳性符合率为100%,阴性符合率为89.5%,总体符合率为90.9%(表2)。表明本研究建立的双重套式PCR 方法比肌肉压片镜检具有更高的敏感性,可用于临床样品的检测。

表2 临床样品的检测结果Table 2 Results of the PCR assay for clinical samples
3 讨 论
肉孢子虫是一种重要的食源性人兽共患寄生虫,不仅引起猪、牛等动物发病和死亡,而且也存在感染人等的公共卫生风险[2,7]。猪感染肉孢子虫孢子囊后,在其肝脏等脏器血管内皮细胞内裂殖生殖,最后裂殖子随血流到达骨骼肌和心肌等部位形成大量包囊[2-3],此时在病猪的骨骼肌、心肌、血液和脏器组织中均存在肉孢子虫不同发育阶段的虫体。如果犬科动物、灵长类或人等终末宿主食入生的或不熟的、携带有肉孢子虫包囊的猪肉就会被感染,在终末宿主的小肠完成配子生殖和孢子生殖,最后随粪便排出孢子囊[8,17-18]。因此,有效检测猪的肌肉、血液、脏器以及犬和人粪便中的肉孢子虫虫体可为猪和人肉孢子虫病防控提供重要依据。
目前肉孢子虫检测最常用的方法是肌肉压片镜检法,但该方法无法确定肉孢子虫的种类,并且敏感性低,容易出现误诊和漏诊[11,13]。随后又有报道基于18S rRNA基因序列的分子鉴定方法,这些方法通常是利用肉孢子虫属通用引物进行常规PCR扩增,经测序和序列比对分析来确定肉孢子虫种类[11,19]。该方法虽然快捷,但由于是通用引物,可能存在非特异性扩增问题,导致鉴定效率较低。本研究通过对米氏肉孢子虫和猪人肉孢子虫的18S rRNA 基因序列进行序列比对分析,首先在两种肉孢子虫均保守区设计上、下游引物,作为双重套式PCR 的外引物,然后在两种肉孢子虫18S rRNA 基因序列的变异区分别设计米氏肉孢子虫和猪人肉孢子虫种特异性引物,作为内引物。通过优化条件,建立了双重套式PCR,能够检测猪肉样本中米氏肉孢子虫和猪人肉孢子虫。相对肌肉压片镜检和常规PCR 方法,该双重套式PCR 具有较高的敏感性[14-16],为肉样卫生检测、猪肉孢子虫病例诊断和流行病学研究提供方便有效的检测手段。
由于在实验过程中没有扩增到猪人肉孢子虫的全长18S rRNA 基因,所以本研究根据GenBank 登录的猪人肉孢子虫18S rRNA 基因序列,委托生物公司人工合成了1 500 bp 猪人肉孢子虫的18S rRNA 基因序列,并克隆到pEASY-T1 载体中,获得重组质粒pEASY-T1-Ss18S rRNA 作为猪人肉孢子虫标准品。本研究还构建了米氏肉孢子虫重组质粒pEASYT1-Sm18S rRNA 作为米氏肉孢子虫标准品。总之本研究建立的猪源肉孢子虫双重套式PCR 方法为猪肉孢子虫病诊断和分子流行病学研究提供了高效的检测手段。
